2016-2020年中国银屑病临床试验质量评估
朱蓓蓓 刘 毅 李 婧 宦 静 倪 琪 杨雪源
中国医学科学院皮肤病医院(中国医学科学院皮肤病研究所),南京,210042
银屑病(psoriasis)是一种慢性、复发性、免疫介导的炎症性皮肤病,具有一定的遗传倾向[1]。典型临床特征包括局部或广泛分布,边界清晰的红斑或斑块伴白色鳞屑[2]。我国银屑病的发病率为0.47%~0.59%[3]。银屑病除了给患者造成明显的皮肤损害外,病情迁延不愈、反复发作还给患者带来较大的心理压力,严重影响患者的生活质量。在过去的10年中,全球银屑病治疗格局发生了较大变化,很大程度上是许多与传统口服系统性治疗药物和光疗相比更为安全有效的新型生物制剂临床试验的开展及成功上市,使患者有了更多治疗选择[4-6]。然而,除了临床试验设计时须遵守的基本规范(如CONSORT checklist)外,银屑病临床试验的最大挑战在于如何评估银屑病患者的严重程度和治疗效果[7]。本研究旨在对近5年国内外企业发起的临床试验的质量进行系统评估,力图全面分析银屑病临床研究中方法学设计及疗效评价工具等的应用情况,为今后我国银屑病临床研究标准化的构建提供建议和参考。
1 资料和方法
从全球临床试验注册数据库(Clinicaltrial.gov)、国家食品药品监督管理总局药品评审中心(Center for Drug Evaluation, CDE)、药物临床试验登记与信息公示平台和中国临床试验注册中心(Chinese Clinical Trial Registry, ChiCTR)三个临床试验登记平台中收集在2016年1月至2020年12月注册登记的银屑病治疗药物临床试验,通过对临床试验的整理,探讨国内外银屑病领域药物临床试验的设计、研究终点的现状,并进行对比分析。
2 结果
2016-2020年,企业发起的适应证为银屑病临床试验,总计国外和国内各有314和123个临床试验有试验设计的信息。国外采用随机分配患者的试验有77.4%(243/314);而国内研究则有91.9%(113/123)采用随机分配。试验设计方面,国内外最常选择平行对照的方法,但国内有高达29.3%(36/123)试验采用了交叉设计。本研究纳入的银屑病临床试验中,国外有32.2%(101/314)采取了四盲设计,这一设计远高于中国临床试验所占比例6.5%(8/123)。国内44.7%(55/123)临床试验是双盲法,即对研究者和参与者隐藏分组信息,39.0%(48/123)临床试验为开放标签。对比国内外纳入分析的适应证为银屑病的临床试验,国内临床试验中有49.6%(61/123)试验<100例,这个比例稍高于国外(43.9%,138/314)。对于银屑病试验的研究终点评价指标,国外和国内各有28.0%(88/314)和19.5%(24/123)的试验选择PASI做研究终点评价指标(表1)。
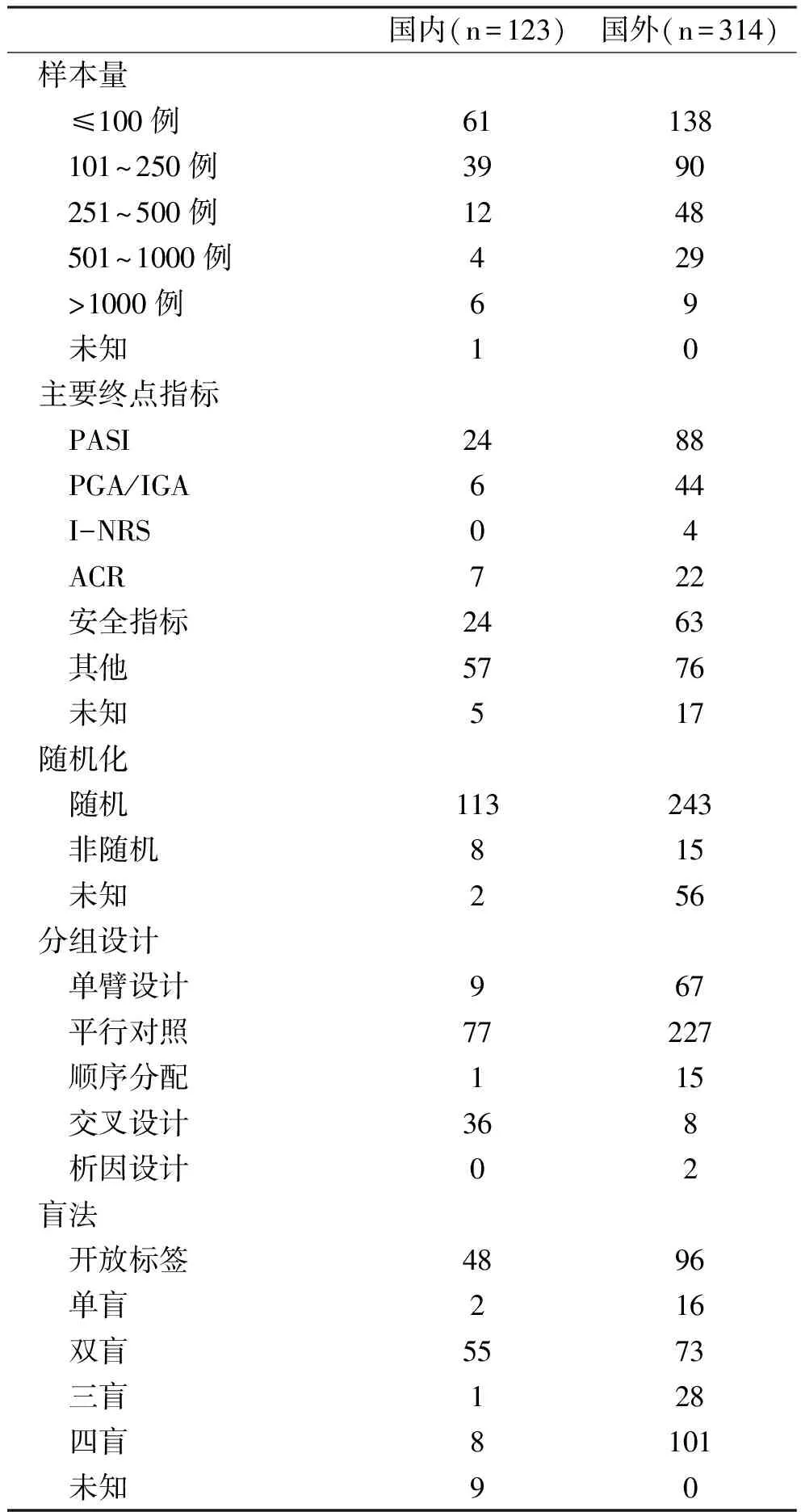
表1 企业发起的银屑病临床试验的实验设计 个
3 讨论
3.1 银屑病临床试验方法学设计 中国有着较高比例的交叉设计可能源自较多的生物等效性试验,根据国家药品监督管理局制定的《生物等效性研究的统计学指导原则》,生物等效性试验通常建议使用交叉设计,该设计优点在于患者自己既是试验组又是对照组,所以能更好地减少因为基线状况不同所带来的研究结果偏倚;另外,交叉设计能在样本数相当的情况下提供较高的检验效能,因此在生物等效性试验中选择交叉设计可缩短试验时间以及减少试验的花费。但不足是容易出现在临床试验中脱落、退出和失访情况[8]。使用盲法有助于控制试验结果的偏倚,最高标准的盲法是四盲,即对受试患者、临床照护者、研究者、数据分析人员都隐藏患者的分组情况。本研究结果显示:国外采取了四盲设计的比例远高于中国临床试验所占比例,而国内一般的临床试验是采用双盲法设计。理论上,试验所包含的样本量越高检验效能也越高,但是由于样本量计算牵涉到需要事先预估,不同研究组中有多少患者会达到研究终点;且同样需要事先决定,有多少比例患者可从试验药物中获益。此外,愿意接受多少比例的第一型及第二型错误也会影响到样本量计算[8-10]。在没有公布过多试验相关信息和研究结果的注册平台去比较样本量的分布有失公允。另外,交叉设计在中国有着较高的比例,其特点正是用较少的样本量来达到一样的检验效能,这能部分解释为何中国的样本量相对较低。
3.2 银屑病临床试验研究终点 主要终点指标可以分为三大类,疗效(在银屑病临床试验中主要使用ACR, PASI,PGA等常用量表)、安全性、其他。安全性相关研究多以I期试验为主,而其他终点指标的临床试验以生物等效性试验和I期试验为主,这些使用其他终点指标的研究通常以血液中的药物浓度当研究终点。国内相对较高比例的其他终点指标(国内46.3%,国外24.2%)同样是高比例的生物等效性试验。
目前,银屑病临床试验常使用量表工具来帮助医生准确评估患者疾病的严重程度和治疗效果。银屑病临床试验最常用的两个量表工具包括: 银屑病皮损面积及严重程度指数(psoriasis area and severity index, PASI)[11]和医师全面评估(physician global assessment, PGA或investigator global assessment, IGA)。银屑病临床试验中,最重要设计点之一是如何评估药物疗效[12],有专家提出PASI下降率50%(PASI 50)作为研究终点即可代表治疗成功[7,13]。然而,从2012年至今,德国、意大利、英国、法国等许多欧洲国家的银屑病治疗指南所推行银屑病治疗评价标准由过去的PASI 50逐渐提升至PASI 75、PASI 90,甚至PASI 100作为有效性研究终点[14]。因PASI评价标准较为客观、准确,PASI一直被视为国际通行的临床试验中评估银屑病疗效的金标准。近年来,银屑病临床研究中越来越多使用PASI评分作为疗效评价标准。本研究结果显示,全球和国内选择PASI作为银屑病临床试验研究终点评价指标分别占28.0%和19.5%,但PASI评估复杂,耗时较长,且不同医师对同一银屑病患者的PASI评估有所差异,在医师对问卷熟悉程度不高情况下,该测量工具的可信度会降低。因此,人工智能化PASI评估将是今后的发展趋势。相反,PGA很容易被医师或患者所理解但却不能全面地评估银屑病且缺乏鉴别较小疾病变化的能力[7]。除此以外,银屑病临床试验中还有一些新的评估工具[7]如lattice system,这项评估工具已被证明与PASI有良好的相关性,且该量表工具与PASI相比具有更高的可信度;另外还有美国国家银屑病基金会(National Psoriasis Foundation,NPF)开发的银屑病量表(NPF psoriasis score, NPF-PS),NPF-PS为了提高评估者对银屑病斑块厚度评估的可靠性,还带有用于厚度测量的参考卡。另外,在轻度银屑病患者中(PASI<3),PASI无法准确地评估药物疗效,仍需要其他量表如NPF-PS[7]。即使目前不断有新的测量工具被开发出来,但总体来说,目前最主要的量表工具仍为PASI和IGA,2017-2018年间,在英国NIH(National Institute of Health)临床试验注册平台上登记的银屑病药物临床试验中全部试验都使用了PASI作为评估工具。使用频率排在第二位为PGA/IGA,有超过90%试验都采用了该量表。银屑病领域的临床试验由于牵涉较多的量表,导致临床试验研究终点的规范性仍未达到共识[7]。银屑病相关的临床试验显示,目前并没有一个最佳量表来做终点指标,通常合并使用PASI、PGA和患者生活质量的测量可以用来全方位评估中重度银屑病对患者的影响。因此,我们认为人工智能化PASI评估联合PGA共同作为中重度银屑病有效研究终点,有可能成为银屑病临床研究标准化构建的重要指标之一。
众所周知,银屑病会导致患者生活质量降低,然而纳入生活质量为终点的皮肤病临床试验稀缺。根据本研究数据分析的结果显示,近5年以银屑病作为适应证的临床试验中,仅有0.46%(2/437)使用了生活质量作主要研究终点;其他皮肤病的临床试验罕有用患者的生活质量改善做研究终点。虽然生活质量量表无法直接测量药物对于疾病的疗效,但是生活质量的测量却能直接反映患者生活的改善程度,此目标正符合所有治疗药物的初衷[15,16]。有些患者可能有很严重的皮损,但事实是这些患者并不会被这些皮损影响太多的生活质量;相反,有些患者可能因为一点局部皮损而对日常生活产生了严重的影响[7]。如果大多数的临床试验都以皮损严重程度来作治疗有效性的终点指标而忽略了对患者生活质量的评估,那么试验结果无法反映药物能为患者带来多少实质的益处[15,16]。
临床试验中使用的生活质量量表包括普适性量表medical outcome survey short form 36(SF-36)[17]和Euro QoL[18]等; 而用于皮肤病患者生活质量测量的特异性量表则包括了Dermatology Life Quality Index(DLQI)[19]和Skindex[20]等。生活质量量表可用于验证临床早期的PASI统计学改变是否具有临床意义,从而作为临床试验中对皮肤病改善程度的一个有效补充。
3.3 银屑病临床试验的规范性 临床试验如果有参考试验指南如CONSORT checklist来设计试验,基本都会符合试验的规范。由于本研究不是从已发表的临床试验去分析数据,因此无法全面地比较整体皮肤病试验的规范性。另外,本研究采用了已登记在注册数据库中的临床试验来分析试验的质量和规范,其实“注册在数据库”本身就是属于试验规范的要求之一,因此本研究的结果可能有偏倚(高估了整体银屑病临床试验的质量),毕竟我们无法获得那些未登记在注册数据库的试验。即使如此,本研究数据结果依然能帮助即将开展的皮肤科临床试验朝着更高质量的试验设计的方向迈进,以解决更多皮肤病领域的未满足需求。
我国皮肤病临床试验的质量评估尚处于起步阶段,国内未有对药物临床试验质量进行整体评估的量化标准。因此,应注重中国临床试验的设计与实施,提高中国临床试验的总体质量。临床试验方案研究设计是保证临床试验取得成功并保证其科学性、可靠性和准确性的重要依据。尽管随着国家药品监督管理局对各类指南和指导原则的颁布和不断更新,我国临床试验方案的设计质量和合规性有了很大程度的提高,但在研究类型、主要终点选择等关键问题上仍存在诸多疑虑,和国际先进水平相比仍存在一定差距。我们要充分发挥皮肤病学专业优势,通过证据荟萃及专家咨询等方法制定银屑病临床试验研究设计的关键科学考量共识并推广应用。
综上所述,建立国家一体化信息平台并实现临床试验全流程电子化管理及无缝对接,可为我国临床试验研究动态化管理提供重要技术支撑及示范效应。能更好地开展临床试验的质量评估,为今后我国银屑病临床研究标准化的构建提供有力的数据支撑和技术保障,回应医药产业对我国临床试验机构专业效率与质量提升的诉求,吸引国内外医药企业优先在我国临床试验机构开展临床试验项目,加速我国创新医药产业健康地发展。

