脑小血管病与内分泌因素之间的关系
王椋铄综述, 苏敬敬审校
脑小血管病(cerebral small vessel disease,CSVD)是一组主要累及脑部小血管的疾病,会引起一系列病理、临床、影像综合征。CSVD的发病机制尚未完全阐明,血管内皮功能障碍、血脑屏障通透性增加,以及继发的炎症反应等都可能参与致病。内分泌因素也与CSVD的发生发展密切相关。其中,糖尿病作为CSVD公认的危险因素,近来有许多研究报道了其与CSVD在病理生理过程、影像学标志物、临床表现等方面的联系。其他内分泌因素,包括雌激素、甲状腺激素、糖皮质激素受体多态性等也可能与CSVD有关。本文就CSVD与糖尿病、雌激素、甲状腺激素等内分泌因素的联系展开综述,全面总结CSVD在内分泌方面的研究进展,以期为CSVD的发病机制、临床诊断和治疗提供新思路。
1 绪 论
1.1 引言
脑小血管病(cerebral small vessel disease,CVSD)指的是在多种病因和机制作用下发生脑部小血管(包括小动脉、微动脉、毛细血管、微静脉、小静脉)病变,进而引起一系列病理、临床、影像综合征[1~3]。CSVD的发病率随年龄升高而显著增加[4],占缺血性卒中和脑出血的20%~30%[5,6],是导致老年人功能丧失、残疾和认知能力下降的主要原因[7]。
然而,CSVD的发病机制至今仍未完全阐明,可能有多种机制参与了CSVD的发生发展[2]。其中,内分泌因素可能与CSVD密切相关。然而,相比于其他机制,内分泌在CSVD中的作用很少被提及。本文将讨论CSVD与内分泌之间的联系。
1.2 脑小血管病
1.2.1 分类 CSVD根据病理、影像学和临床表现可以分为不同的类型,目前主要分为六大类。Ⅰ型:动脉硬化/年龄相关的CSVD(arteriosclerosis/age-related CSVD);Ⅱ型:淀粉样蛋白相关的CSVD(amyloid-related CSVD);Ⅲ型:遗传性CSVD(genetic CSVD distinct from amyloid angiopathy);Ⅳ型:炎症/免疫介导的CVSD(inflammatory/immunologically mediated CSVD);Ⅴ型:静脉胶原病(venous collagenosis);Ⅵ型:其他类型CSVD[1,4]。
1.2.2 病因与发病机制 关于CSVD目前公认的病因包括β-淀粉样蛋白沉积于脑血管(脑淀粉样血管病)以及高血压性血管病(包括与年龄、高血压、糖尿病和其他血管危险因素相关的散发性非淀粉样小血管病)。近期有研究表明,氧化应激也在各型CSVD的发病中发挥重要作用[1]。
CSVD的发病机制至今仍未阐明,可能的机制包括慢性缺血与低灌注、内皮功能障碍与血流动力学改变、血脑屏障通透性增加、炎症反应等[2]。
1.2.3 神经影像学 在神经影像学上,CSVD可以表现为新发皮质下梗死(腔隙性卒中)、可能血管起源的腔隙、可能血管起源的脑白质高信号、血管周围间隙(Virchow-Robin Spaces,VRS)、脑微出血、脑萎缩[4]。
1.2.4 临床表现 根据病因、累及大脑部位的不同,CSVD可以出现不同的临床表现,包括突发性卒中症状、认知功能障碍(轻度认知功能障碍和痴呆)、运动障碍、步态障碍、括约肌功能障碍、精神异常等[4,7]。
2 与脑小血管病相关的内分泌因素
关于内分泌因素在CSVD中的作用,相关的研究并不多。糖尿病被公认为CSVD的危险因素,大多数的研究都聚焦于糖尿病在CSVD发生发展中的作用。除此之外,雌激素、甲状腺激素,以及某些激素受体基因及其多态性也可能与CSVD相关。
2.1 糖尿病
糖尿病所引起的全身性代谢紊乱会造成多种急慢性并发症。其中,血管病变(包括大血管和小血管病变)作为糖尿病的一个重要并发症,在脑部就表现为脑大、小血管病。因此,糖尿病是CSVD发生发展过程中的一个重要因素。
已经有多项研究表明,糖尿病患者比正常人更容易发生缺血性卒中,糖尿病也已经被公认为缺血性卒中的危险因素[8]。近期,也有研究表明,糖尿病也能增加出血性卒中的风险[9]。
2.1.1 糖尿病引起血管病变的机制 糖尿病不仅是脑大血管病的危险因素,同时也是CSVD的危险因素[10]。然而CSVD的发病机制仍没有完全阐明,内皮细胞的活化、血脑屏障通透性增加和炎症过程都可能参与其中[8]。已经有研究表明,高血糖诱导的多元醇途径亢进可能在CSVD的发生发展中起到致病作用[8,11]。
多元醇途径包括两个步骤:葡萄糖首先被醛糖还原酶(aldose reductase,AR)还原为山梨醇,这一过程需要消耗NADPH,然后生成的山梨醇被山梨醇脱氢酶(sorbitol dehydrogenase,SDH)转化为果糖[8]。高血糖状态下,经过多元醇途径代谢的葡萄糖从3%增加至30%[12]。多元醇途径的增加,消耗了NADPH,使得内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性下降,一氧化氮(nitric oxide,NO)的生成减少,从而引发内皮细胞功能障碍。同时,内皮细胞中黏附分子表达增加,抗炎和血管扩张作用减弱,促进了动脉粥样硬化,导致了血栓形成,进而导致了脑梗死的发生发展[8]。
高血糖诱导的多元醇途径亢进在糖尿病动脉粥样硬化的发展过程中发挥了重要作用[8]。多元醇途径的亢进会引起血栓素(thromboxane,TX)释放增加、血小板聚集增强[13]。多元醇途径还会影响烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyl transferase,NAMPT)介导的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)生物合成,导致血管细胞黏附分子(vascular cell adhesion molecule,VCAM)-1和组织因子(tissue factor,TF)表达增加,从而介导动脉粥样硬化[14]。许多研究都表明糖尿病动脉粥样硬化和糖尿病微血管病变存在相似之处,二者可能都与多元醇途径有关[8]。
糖尿病患者体内的高血糖、血脂异常和高胰岛素血症都是动脉粥样硬化的相关危险因素。与之相关的一氧化氮生物利用度下降,循环血管细胞粘附分子-1、纤溶酶原激活物抑制物-1和组织因子水平增高,以及血小板活化增加都会导致缺血缺氧的血管功能障碍[8]。越来越多的证据表明,高血糖引起的其他代谢异常,包括氧化应激、糖基化、蛋白激酶C(protein kinase C,PKC)变化都与多元醇途径之间存在交互联系[8,11,15]。多元醇途径在糖尿病血管病变中的作用见图1。
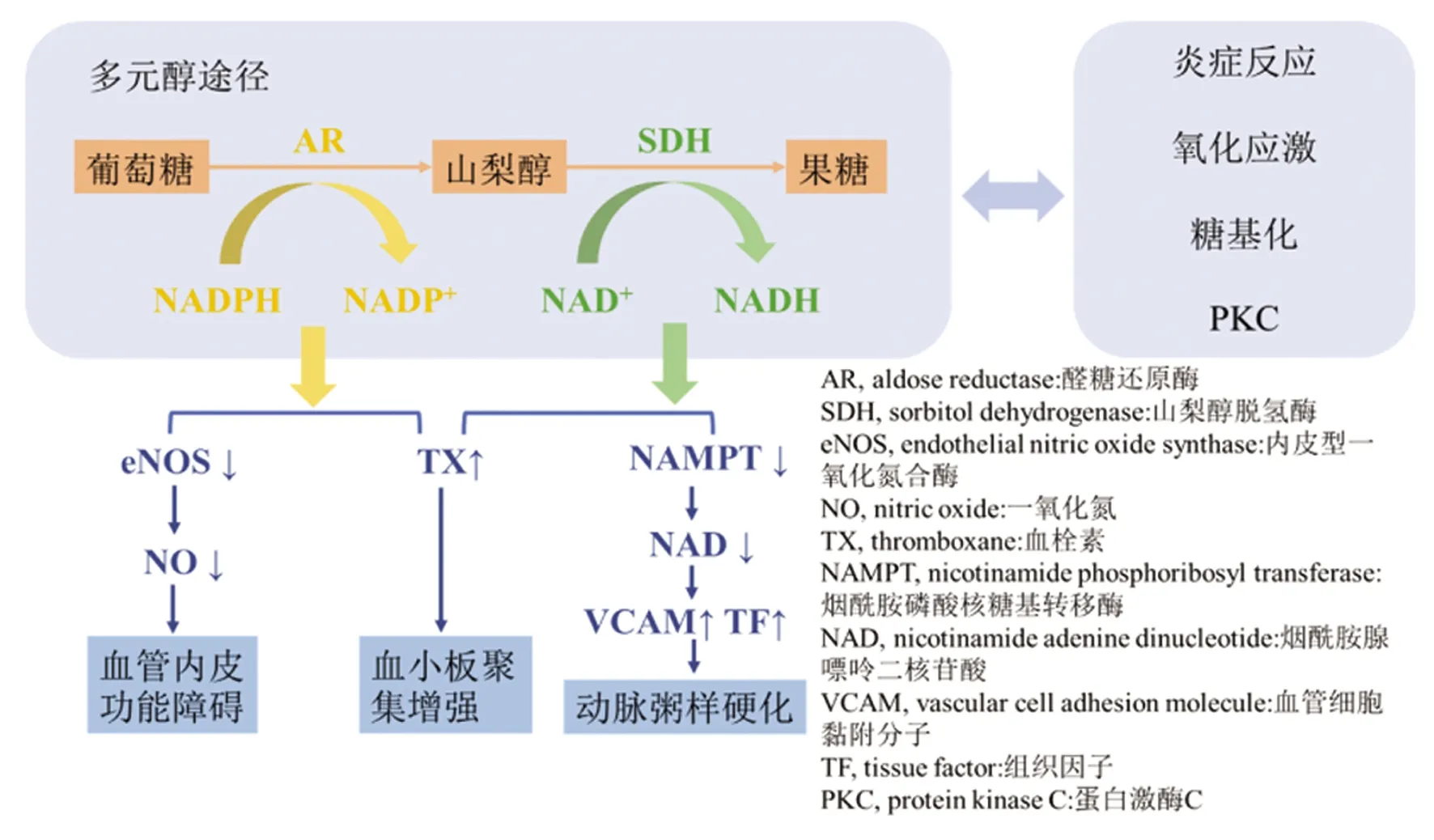
图1 多元醇途径在糖尿病血管病变中的作用
此外,胰岛素抵抗也被认为是脑梗死的危险因素之一,有研究表明在经历过短暂性脑缺血发作或缺血性卒中的非糖尿病患者中,大约有一半的人出现了胰岛素抵抗[16]。胰岛素抵抗不仅与糖耐量受损有关,还通过引起高血压、血脂异常、纤溶活性降低、血小板凝集增加以及促进内皮功能障碍来促进动脉粥样硬化[17]。据报道,胰岛素抵抗也是非糖尿病个体动脉粥样硬化性血栓性梗死的危险因素[18]。
2.1.2 糖尿病与脑小血管病的不同影像学标志物
2.1.2.1 腔隙性梗死 腔隙性梗死(lacunar infarctions,LIs)可归为脑部大动脉穿通支疾病,病理机制主要是高血压导致的脂质透明变性引起的动脉硬化[19]。多发性腔隙性梗死在糖尿病患者中更常见,有研究表明,大量蛋白尿是腔隙增加的唯一危险因素[20]。另外也有报道称,影像表现为有腔隙性梗死的糖尿病患者与缺血性卒中的高复发率以及更坏的临床结局有关[21]。
2.1.2.2 无症状性脑梗死、白质病变和脑微出血 在没有卒中史的老年糖尿病患者中,脑磁共振成像(magnetic resonance imaging,MRI)上常可观察到无症状性脑梗死(silent brain infarctions,SBIs),白质病变(white matter lesions,WMLs)和脑微出血(cerebral microbleeds,CMBs)[8]。这些病变是CSVD的典型MRI表现,因其进展与卒中发病率相关而具有重要的临床意义[8,22]。
近期有研究表明,SBI与未来卒中风险增加两倍有关[23]。除了年龄以外,高血压是SBI最公认的危险因素,然而,糖尿病是否也是SBI的危险因素仍不清楚[8]。对糖尿病患者的神经影像学研究发现糖尿病与LIs和脑萎缩有关,但与SBIs和WMLs的关系尚无定论[8]。
CSVD的发生与血脑屏障的通透性增加有关,进而引起了SBIs、WMLs和CMBs的发展[24~26],但是目前尚不清楚糖尿病患者的血脑屏障通透性是否容易增加[8]。此外,炎症、血管内皮功能障碍也与CSVD的发生发展有关[8]。与非糖尿病人群相比,2型糖尿病患者循环中的内皮细胞和炎症标志物水平升高[27,28]。糖尿病患者的血管内皮功能障碍很容易进展,在脑小血管和微血管水平上,由于微循环和血管扩张障碍,可能与CSVD的发生和进展有关[8]。CMBs也是CSVD在MRI上的一种表现。有人认为CMBs是高血压或脑淀粉样血管病引起的小血管病理损害的一种影像学标志[29]。年龄和高血压与CMBs密切相关。然而,糖尿病与CMBs的关系尚不清楚[8]。
2.1.3 糖尿病视网膜病变与脑小血管病的联系 大脑和视网膜小动脉具有相似的血管结构,并且血脑屏障在结构和功能上与血-视网膜屏障相似[30]。多项临床研究表明,视网膜微血管异常与CSVD(包括LIs、WMLs和CMBs)密切相关,视网膜微血管异常是脑微血管疾病的影像学标志物[31~33]。此外,还有流行病学研究表明,视网膜微血管异常也与认知能力下降有关[34]。这些研究提示视网膜微血管异常可能与CSVD有病理生理联系,引起血-视网膜破坏的机制可能也会导致血-脑屏障破坏[8]。
糖尿病患者视网膜血管壁完整性破坏,导致了血-视网膜屏障破坏,进而引起了糖尿病视网膜病变。虽然糖尿病患者血-视网膜屏障破坏的确切机制尚未确定,但高血糖诱导的多元醇途径亢进可能发挥了部分作用。因此,多元醇途径也可能是糖尿病患者CSVD发生发展的可能机制[8]。
2.2 雌激素
雌激素是公认的血管保护因素,在缺血性脑损伤中发挥了重要的保护作用。这些保护作用是通过增加缺血区脑血流量、抑制内皮细胞凋亡、抗氧化作用、抑制β-淀粉样变性、抑制神经细胞凋亡等多种途径实现的[35]。
2.2.1 雌激素与白质病变 雌激素可以促进脑血流,有利于神经修复。女性绝经后雌激素减少,推测其脑血流减少,神经修复机制减弱,容易发生脑白质病变。有研究表明绝经后女性脑内胆碱、肌氨酸酐和N-乙酰天冬氨酸代谢产物浓度较高,可能是女性易发生脑白质病变的另一个因素[36,37]。
2.2.2 雌激素与脑微出血 研究发现,在校正年龄、高血压等混杂因素后,性别仍是脑微出血(CMBs)的危险因素,男性比女性更容易发生脑微出血[38]。
2.3 甲状腺激素
有调查显示,女性CSVD患者游离三碘甲状腺原氨酸(FT3)、总三碘甲状腺原氨酸(TT3)水平较健康女性明显降低,而游离甲状腺素(FT4)、总甲状腺素(TT4)、促甲状腺素(TSH)与健康女性无明显差异,考虑女性CSVD可能与甲状腺功能,尤其是FT3、TT3水平相关[39]。
当临床上发现女性患者出现FT3、TT3水平降低时,应排查其是否患有CSVD,以利于CSVD的早期发现、早期诊断和早期治疗[39]。
2.4 糖皮质激素受体基因
近年来的研究发现,下丘脑-垂体-肾上腺轴中发挥调节作用的糖皮质激素受体(NR3C1)基因及其多态性在CSVD的发病机制中起重要作用。糖皮质激素受体基因及其多态性可能间接通过影响高血压、血糖、血脂异常等危险因素或直接参与到CSVD的发生发展中[40]。
研究与CSVD发病相关的基因多态性,有利于从精准医学角度进行CSVD的预防和治疗[40]。
3 结 论
CSVD的发病机制至今尚未完全明确,内皮细胞功能障碍、血脑屏障通透性增加,以及继发的炎症反应等多种机制都参与其中[2]。内分泌因素也与CSVD密切相关。糖尿病作为CSVD公认的危险因素,其在CSVD的致病机制、影像学、临床表现及与其他微血管病变的联系等方面的研究都已经非常深入[8]。另外,也有一些研究发现了雌激素、甲状腺激素、糖皮质激素受体基因多态性与CSVD相关,但是并未有更深入的研究报道[35~40]。
研究CSVD与内分泌因素之间的关系,有助于理解内分泌因素在CSVD发生发展中的作用,进一步阐明CSVD的发病机制,为CSVD的防治提供新思路。同时,通过研究CSVD进展过程中相关的内分泌变化,可以发现一些早期诊断CSVD的标志物,从而做到早期诊断、早期治疗,改善患者的预后。

