QuEChERS/LC-MS/MS法测定三文鱼中除虫脲残留
刘亿婕
福建省食品药品质量检验研究院(福州 350000)
三文鱼(Salmon),是鲑科鱼类或鲑鳟鱼类的商品名称[1],属冷水性溯河产卵洄游鱼类[2]。其鳞小刺少,肉质细嫩鲜美,同时营养价值丰富[3-4],因此深受人们的喜爱。随着人们对三文鱼消费需求的增长,国内外养殖业都在不断扩大三文鱼的养殖规模。在养殖产业化和规模化的同时,寄生虫病也随之出现[5]。鱼虱病是海水网箱养殖鲑鳟鱼类常见的寄生虫性疾病[6-7],也是困扰养殖者的一大难题。鱼虱大量寄生在鱼体,引起鱼体糜烂、损伤、出血,甚至死亡,严重危害着养殖业。目前对于鱼虱病的治疗主要有药浴治疗及饲料中预混杀虫药物[8]。除虫脲是一种能抑制靶标害虫的几丁质合成而导致其死亡或不育的杀虫剂,常用于鲑鳟鱼类鱼虱病的治疗[9]。然而除虫脲的过渡或不合理使用会导致药物在鱼体内的残留,进而危害人的身体健康。欧盟、挪威、智利和日本都制定了除虫脲在鲑科鱼肉中的最大残留限量(MRL),而中国尚未制定此限量。
除虫脲的检测方法主要有液相色谱法[10-11]、液相色谱-质谱法[12-13]。前处理中常用的净化方式主要有固相萃取柱净化法[14]和QuEChERS净化法[15]。在目前报道的文献及现行有效的国家标准中,对除虫脲残留的检测主要集中在蔬菜、水果等植物性食品中。刘锦霞等[16]建立了猪肉中苯甲酰脲类的检测方法。GB 23200.45—2016[12]可适用于鸡肉、牛肉、猪肉、猪肝等基质,但是三文鱼等鲑鳟鱼类水产品中除虫脲残留的检测未见报道。试验采用QuEChERS法进行前处理,通过高效液相色谱-串联质谱法测定三文鱼中除虫脲的残留。该方法简单、准确、灵敏度高,可用于三文鱼中除虫脲的快速检测,填补了三文鱼等鲑鳟鱼类中除虫脲残留检测的空白,同时为国内及进口三文鱼中除虫脲残留的监测提供了技术支撑。
1 试验部分
1.1 仪器与试剂
API QTrap5500 液相色谱-串联四极杆质谱仪,配有电喷雾离子源(美国AB公司);ExionLC AD高效液相色谱仪(美国AB公司);XPE206DR分析天平(瑞士Mettler Toledo公司);Vortex 4涡旋混合器(德国IKA公司);CR21N型落地式高速冷冻离心机(日本HITACHI公司)。
除虫脲对照品(A Chem Tek公司);乙腈、丙酮、乙酸乙酯、正己烷、二氯甲烷(色谱纯,德国Merck公司);甲酸、乙酸铵(色谱纯,上海阿拉丁公司);氯化钠(分析纯,国药集团化学试剂有限公司);N-丙基乙二胺(PSA)、硅胶键合十八烷基(C18)、石墨化碳黑(GCB),纳谱分析技术有限公司;超纯水由Milli Q系统制得(美国Milipore公司);三文鱼(市售)。
1.2 标准溶液的配制
将除虫脲标准品用乙腈稀释配成1 000 μg/L的标准储备液,置于4 ℃冰箱保存。试验时用空白基质溶液稀释成含除虫脲质量浓度为0.5,1.0,2.0,5.0,8.0和10.0 μg/L的系列基质匹配标准溶液。
1.3 样品前处理
取约100 g代表性样品,用绞肉机绞碎混匀,装入干净的自封袋内,密封并标明编号,于-20 ℃冷冻保存。
准确称取2 g(精确到0.01 g)试样,置于50 mL具塞离心管中,加入5 mL水和2 g NaCl涡旋混匀,样品充分分散后,加入10 mL 1%甲酸-乙腈,涡旋1 min,超声提取10 min,以9 000 r/min离心10 min,取2 mL上清液加入到装有50 mg PSA的离心管中,涡旋1 min,以9 000 r/min离心5 min,过0.22 μm的滤膜后,上机检测。
1.4 LC-MS/MS条件
1.4.1 液相色谱条件
Eclipse Plus-C18RRHD色谱柱(2.1 nm×50 nm,1.8 μm);流动相:纯水(A相)、乙腈(B相);流速:0.3 mL/min;进样体积:5 μL;柱温:40 ℃。液相色谱梯度洗脱程序:0~1 min,90% A;1~2 min,90%~5% A;2~3 min,5% A;3~4 min,5%~90% A;4~5 min,90% A。
1.4.2 质谱条件
电喷雾离子源(ESI源),负离子模式(ESI-)检测,扫描方式为多反应监测(MRM);离子源温度:450 ℃;电喷雾电压:-4 500 V;气帘气压力:35 Psi;雾化气压力:55.0 Psi;辅助气压力:55.0 Psi;碰撞室入口电压:-10 V;碰撞室出口电压:-15 V。
1.5 基质效应
水产品基质复杂,含有较高的蛋白质和脂肪等杂质,易产生基质效应。因此,试验考察了基质效应对目标化合物的影响。采用提取后加入法[17],用纯溶剂与空白基质提取液分别配制相同浓度的标准溶液,上机测定,根据公式ME=Am/As对基质效应(ME)进行评价。式中Am为鱼肉空白基质中除虫脲的吸光度,As为溶剂中除虫脲的吸光度。当ME=1时,表示无基质效应;当ME>1时,表示基质对目标物响应产生增强效应;当ME<1时,表示基质对目标物响应产生减弱效应。当0.8<ME<1.2时,表示为弱基质效应;当0.5<ME<0.8或1.2<ME<1.5时,表示为中等强度基质效应;当ME<0.5或ME>1.5时,表示为强基质效应[18]。
2 结果与分析
2.1 仪器条件的优化
配制50 ng/mL的除虫脲标准溶液,采用针泵进样方式将其注入离子源,离子源选择负离子模式。先找到准分子离子峰[M-H]-(母离子),再对准分子离子进行二级质谱扫描,得到碎片离子信息。选择丰度较大、丢失合理的子离子分别作为定量离子和定性离子,并对去簇电压(DP)、碰撞能量(CE)等参数进行优化,使各离子碎片响应强度达到最大。优化后的质谱条件参数见表1。
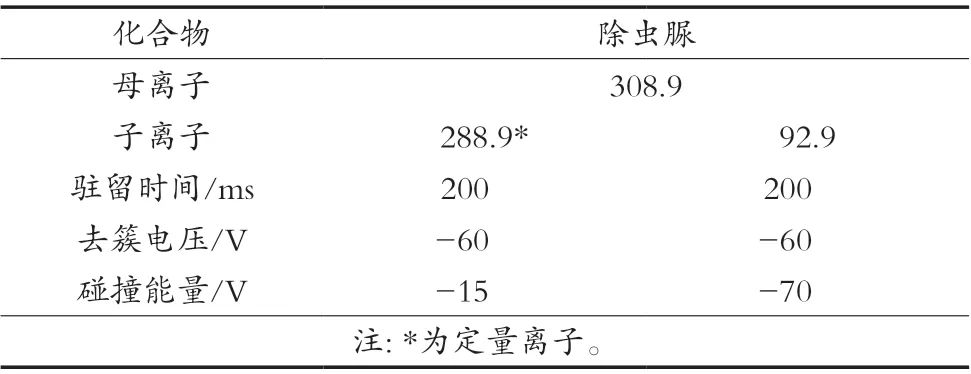
表1 除虫脲质谱检测条件参数
在色谱条件方面,主要对流动相进行了优化。试验比较了乙腈-5 mmoL/L乙酸铵、乙腈-水、甲醇-水分别作为流动相时对各物质的峰型及响应的影响。结果发现,选择乙腈-水作流动相时,响应更好,峰型也不会拖尾。所以最终流动相水(A相)和乙腈(B相)进行梯度洗脱。流速为0.3 mL/min,最终组分在5 min内出峰。色谱图见图1。
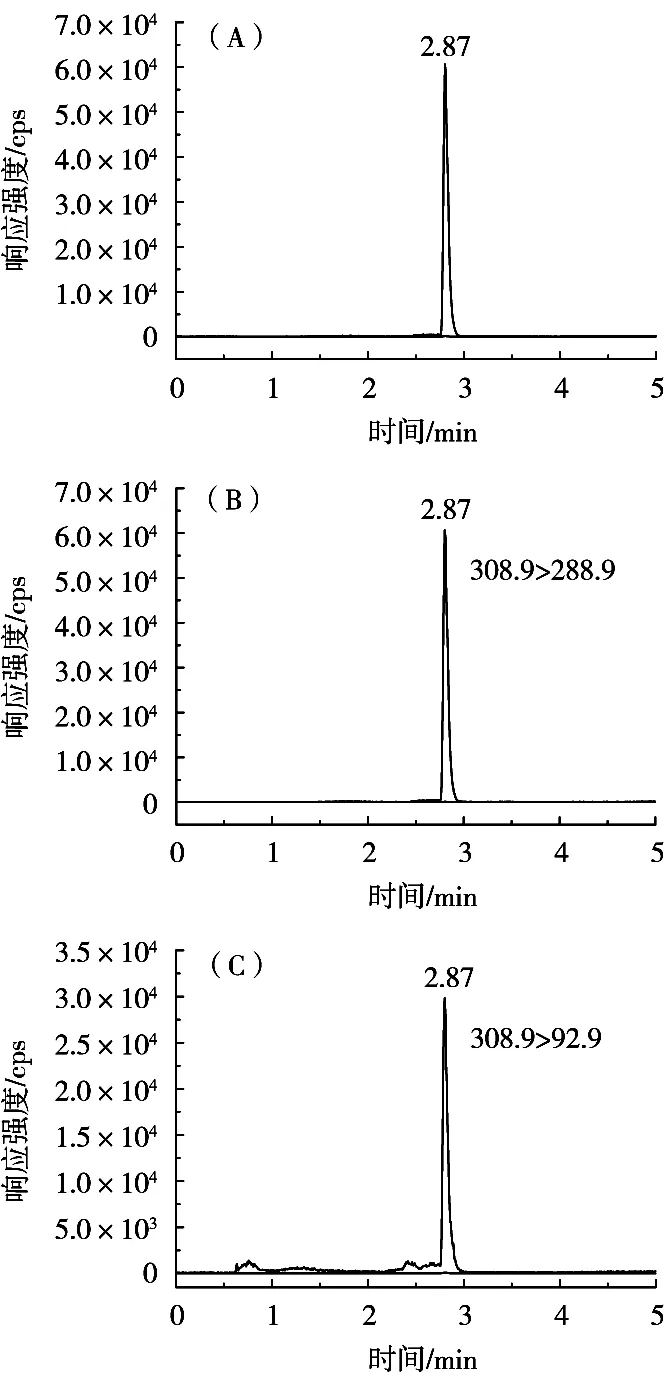
图1 除虫脲标准溶液总离子流图(A)和定量、定性离子流图(B和C)
2.2 样品前处理条件的选择
2.2.1 提取溶剂的选择
样品在提取之前先加少量的水,使之分散均匀,便于目标化合物的提取。由于用甲醇提取不利于后续提取液与水相的分层,因此试验将加标量为10 μg/kg的空白鱼肉样品分别用乙腈、乙酸乙酯、正己烷、二氯甲烷提取,考察各提取溶剂对回收率的影响,结果如图2所示。用正己烷提取时回收率不到10%,不能把除虫脲提取出来,而用乙腈提取的回收率高于乙酸乙酯、二氯甲烷,且乙腈可沉淀蛋白,同时可减少脂类等弱极性组分的提取,所以初步选择乙腈作为提取溶剂。由于除虫脲在酸性条件下比较稳定,因此选择不同酸度条件下的乙腈提取。比较了0.1%甲酸-乙腈、0.5%甲酸-乙腈、1%甲酸-乙腈和5%甲酸-乙腈分别作为提取剂的提取效果,结果(图3)发现,加入甲酸提取比单独用乙腈提取回收率更高,且随着甲酸添加量的增加,回收率也呈增高的趋势,当甲酸为1%时回收率最高,5%时有所下降,最终提取溶剂选择1%甲酸-乙腈。
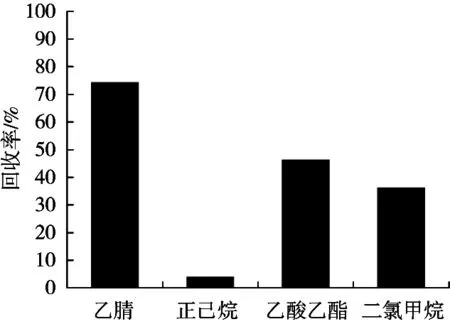
图2 不同提取溶剂对除虫脲提取效率的影响
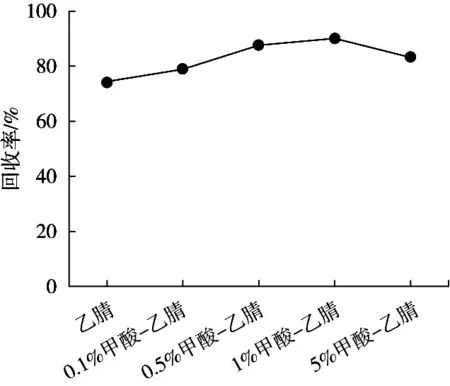
图3 不同酸度的乙腈溶液对除虫脲提取效率的影响
2.2.2 净化剂的选择
QuEChERS方法中常用的净化剂有PSA、C18、GCB等。PSA主要用于除去样品中的脂肪酸、酚类碳水化合物等[19-20],C18具有良好的除脂能力[21],而GCB通常用来除去样品中的色素,同时GCB会吸附一些具有平面及对称结构的化合物[22]。为考察不同净化剂的净化效果,试验将加标量为10 μg/kg的空白鱼肉样品进行前处理,考察了PSA、C18、GCB及其两两组合(保持净化剂的总量不变)作为净化剂的净化效果及对回收率的影响。图4显示:当添加GCB时,回收率均很低,说明GCB对目标物有较强的吸附。PSA、C18及其两者的组合均有较好的净化效果,但PSA单独作为净化剂时回收率略高于C18及两者的组合,因此选取PSA作为净化剂。进一步考察净化剂的用量对回收率的影响。将加标量为10 μg/kg的空白鱼肉样品提取后,考察了25,50,75,100和150 mg PSA分别作为净化剂对回收率的影响。结果(图5)表明:50 mg PSA在达到较好的净化效果的同时也可以满足较好的回收率,再增加PSA的用量回收率呈下降趋势,最终选择50 mg PSA作为净化剂。
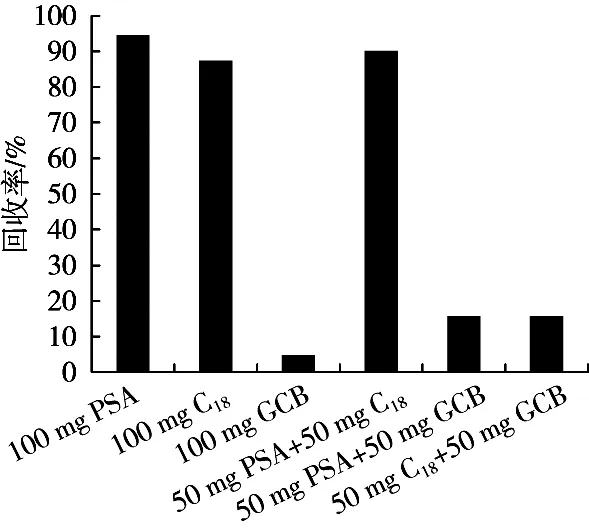
图4 不同净化剂对除虫脲的净化效果
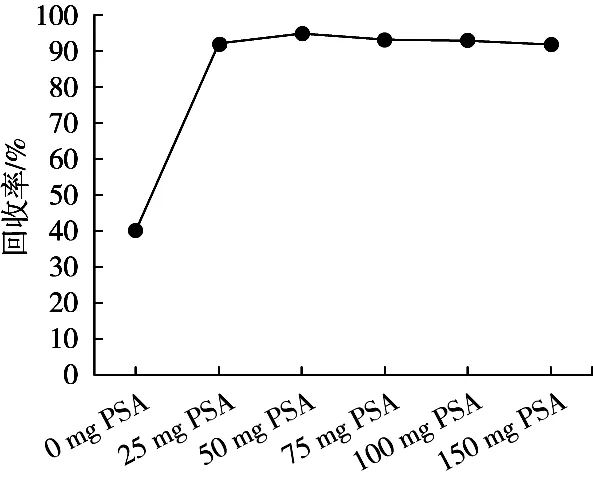
图5 不同质量的PSA对除虫脲的净化效果
2.3 基质效应
分别用溶剂(10%乙腈水溶液)和空白鱼肉基质提取液配制成含除虫脲质量浓度为10 ng/mL的标准溶液,分别连续进样3次,以空白基质中除虫脲峰面积与溶剂中除虫脲峰面积之比计算基质效应。基质效应评价结果(表3)显示:除虫脲在鱼肉基质中表现为强基质效应。为确保检测结果的准确性、降低基质效应对结果带来的误差,在实际样品的检测中采用基质配标。
2.4 标准曲线、检出限和定量限
称取6份阴性鱼肉样品,按前处理方法处理得到空白基质,以空白基质为稀释剂配制标准曲线,以被测物峰面积为纵坐标,以被测物浓度为横坐标,进行线性回归。结果表明:除虫脲在0.5~10 ng/mL质量浓度范围内线性良好,线性回归方程及相关系数见表2。
同时进行检出限、定量限测定试验,阴性样品加标后,按1.3小节的方法处理后上机测定,以信噪比(S/N)3和10分别确定方法的检出限(SLOD)和定量限(SLOQ),结果见表2。方法检出限为0.15 μg/kg,定量限为0.5 μg/kg,定量限低于GB 23200.45—2016《食品安全国家标准食品中除虫脲残留量的测定》的规定(定量限为10 μg/kg)。

表2 除虫脲的线性范围、线性方程、相关系数、检出限及定量限
2.5 方法回收率和精密度
在鱼肉阴性样品中添加低(5 μg/kg)、中(10 μg/kg)、高(20 μg/kg)3个质量分数水平的标准溶液,按1.3小节的样品前处理方法进行处理,每个水平的加标试验做6个平行样,各水平的加标量和结果见表3。除虫脲的回收率在87.3%~96.3%之间,相对标准偏差在1.2%~2.2%之间,回收率及精密度良好,符合检测要求。
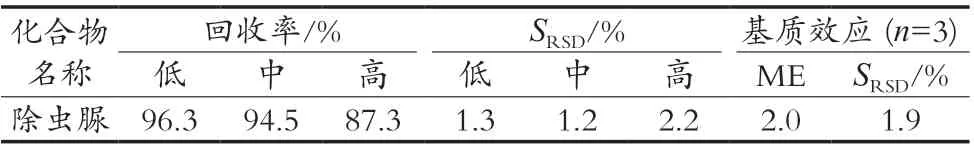
表3 除虫脲平均回收率、相对标准偏差(n=6)及基质效应(n=3)
2.6 实际样品的检测
从超市购买5份三文鱼样品,按试验方法检测,均未检出除虫脲残留。将5份样品都称2个平行样,并按10 μg/kg质量分数进行加标,前处理后上机得到平均回收率,结果分别为95.4%,92.3%,95.0%,94.3%和93.6%,再次证明该方法的准确性。
3 结论
试验建立了三文鱼中除虫脲残留的QuEChERS/LC-MS/MS分析方法。该方法前处理简单,检测周期短,基质干扰少,在3个添加水平(n=6)下的回收率为87.3%~96.3%,相对标准偏差为1.2%~2.2%,具有良好的准确度和精密度,方法检出限为0.15 μg/kg,定量限为0.5 μg/kg,低于GB 23200.45—2016中定量限,也低于欧盟、挪威制定的最大残留限量。该方法准确、可靠,为三文鱼中除虫脲残留监测提供了有力的技术手段。

