甲型肝炎病毒在太平洋牡蛎中的富集及消减规律
闫旭佳 ,袁亚迪 ,幺山山 ,崔博沛 ,宋丽芳 ,刘佩 ,孙世洋 ,卞莲莲,高帆,张洁,毛群颖,梁争论
1. 中国食品药品检定研究院,北京 102629;2. 长春生物制品研究所有限责任公司,吉林 长春130012;3. 北京成大天和生物科技有限公司,北京 100176
甲型肝炎病毒(hepatitis A virus,HAV)属于小RNA 病毒科嗜肝病毒属,为直径27 ~32 nm 的球形颗粒,在外界环境中无包膜[1]。HAV 是导致人类病毒性肝炎的主要病原体[2],常通过粪-口途径引起暴发或散发流行[3]。据报道,2005 年全球约有1. 19亿人感染HAV,其中约3 100 万人出现明显临床症状,约3. 4 万人死亡[4]。近20 年来,随着社会经济的飞速发展、卫生环境的极大改善以及甲肝疫苗的大量应用,全球范围内甲肝发病率均呈下降趋势[5],但因大多数人群均在儿童期间接种疫苗,成年后并未进行再次接种,从而出现了人群抗体水平降低,发病年龄后移,临床症状加重等问题[6]。因此,在现今的后HAV 疫苗时代,加强HAV 相关食品安全管理对我国乃至全球新特征下的HAV 防控具有新的意义。
双壳贝类(包括牡蛎、扇贝和贻贝等)通过摄食活动,以每小时40 升海水的过滤速度,有效积累水体中的各种食源性病原体[7]。全球每年因生食或未煮熟的贝类而导致甲肝流行的事件频频发生[8]。多项研究显示,HAV 可在贝类中长时间存在[9]。但HAV 在贝类中的动态富集、衰减规律和脏器分布尚不明确,特别是活病毒的动态改变等未见相关研究,这与我国日益增长的贝类消费需求,鲜牡蛎生食习惯的风靡,以及因其带来的不断加大的生物安全风险不相匹配。如何更好地控制食源性疾病、食品源头污染和保证食品安全已成为我国乃至全球食品行业的首要任务[10]。
本研究以太平洋牡蛎为模型,在实验室条件下采用海水人工养殖的方式,在养殖水体中加入HAV活病毒,富集后更换洁净海水,使牡蛎在洁净海水中净化养殖10 d,分析总HAV 及活HAV 在牡蛎体内富集和净化衰减的动态规律,为防控贝类中HAV 等生物安全提供科学依据。
1 材料与方法
1. 1 牡蛎及海水 太平洋牡蛎购自我国青岛养殖基地;洁净海水采集自我国青岛养殖基地的天然洁净海水,经检测不含HAV。
1. 2 病毒、细胞及质粒 活HAV 为HAV 疫苗减毒株(L-A-1 株,病毒滴度为 8. 33 LgCCID50/ mL),由长春生物制品研究所有限责任公司疫苗二室惠赠;人胚肺二倍体细胞(2BS 细胞)由中国食品药品检定研究院保存;HAV 质粒由英潍捷基贸易有限公司合成。
1. 3 主要试剂及仪器 小鼠抗HAV 单克隆抗体(XA036-7)由北京科兴生物制品有限公司惠赠;蛋白酶K 购自美国Sigma 公司;DynabeadsTM蛋白质G免疫沉淀试剂盒、MagMaxTM-96 病毒RNA 分离试剂盒和Multiskan FC 酶标仪购自美国Thermo Fisher公司;QuantiFast Pathogen PCR + IC 试剂盒购自德国QIAGEN 公司;MEM 培养基购自美国Gibco 公司;MagMAX 全自动核酸提取仪和PRISMA 7500 型荧光定量PCR 仪购自美国ABI 公司。
1. 4 牡蛎暂养、染毒及净化 选取大小规格相近(400. 0 ± 30. 0)g 的健康牡蛎,用刷子小心清除表面的附着物,置于洁净海水中适养3 d 后,在水体中加入活HAV,使水中HAV 浓度为4.33 LgCCID50/mL,富集24 h 后,将污染水体更换为洁净海水,之后每24 h 更换1 次海水,使染毒牡蛎在洁净海水中持续净化10 d。
1. 5 牡蛎和养殖水体的采集 分别在加毒后0、3、6、9、12、24、48、72、96、120、144、168、192、216、240及264 h(净化养殖后,每次均在更换海水前进行采样)随机选取5 ~8 只牡蛎,同时另取5 mL 养殖水体,首先采用免疫沉淀提取结合一步法实时荧光定量 RT-PCR(quantitative real-time reverse transcriptase polymerase chain reaction,qRT-PCR)法分别检测 0 ~264 h 不同时间点的养殖水体、牡蛎消化腺以及牡蛎其他组织的总HAV 含量;再采用qRT-PCR 法和叠氮溴化丙锭-定量RT-PCR(propidium monoazidequantitative reverse transcriptase-polymerase chain reaction,PMA-qRT-PCR)同时检测 3、12、24、72、120、168、216 和264 h 牡蛎消化腺总HAV 和活HAV 病毒含量,并对两者进行相关性分析。另取0、3 和24 h 的染毒牡蛎2 ~3 只,进行HE 染色及免疫组化检测,评价各组织的组化动态改变。
1. 6 牡蛎样本处理 参照国际标准ISO 15216-1 ∶2017,将不同时间点的牡蛎解剖后,分别取消化腺、鳃、唇瓣、外套膜和闭壳肌进行匀浆,在匀浆中加入10 μL 20 mg /mL 蛋白酶 K 溶液,37 ℃,320 r /min消化 60 min;60 ℃灭活蛋白酶 K 15 min;4 ℃,9 000 × g离心 10 min;取上清,用 2. 5 mol / L NaOH 溶液调整pH 至6. 0 ~ 8. 0,用于HAV 抽提以及活病毒检测。
1.7 引物、探针的设计及合成 利用SnapGene 3.2.1进行引物及探针设计,上游引物F 序列:5′-CTTGCAGTGTTAACTTGGCTYTC-3′,下游引物 R 序列:5′-CGCCGCTGTTACCCTATCC-3′;探针序列:FAM-TTGATCTTCCACAAG-MGB。引物及探针序列由英潍捷基贸易有限公司合成。
1. 8 总HAV 检测 利用本实验室前期建立的磁珠免疫沉淀法分别提取牡蛎消化腺等组织上清液和养殖水体[11],获得 50 μL 产物,用于 HAV 总 RNA 的抽提。按试剂盒说明书进行核酸抽提,收集50 μL总RNA。根据本实验室前期建立的HAV 荧光定量PCR法进行 qRT-PCR[12],以 HAV 质粒为标准,以拷贝数的对数和Ct 值绘制回归曲线,计算样品拷贝数。反应体系按试剂盒说明书添加,模板为5 μL。反应条件为:50 ℃ 20 min;95 ℃ 5 min;95 ℃ 15 s,60 ℃ 34 s,共 45 个循环。
1. 9 活 HAV 检测 将浓度为(3 ~ 4)× 105个 / mL的2BS 细胞接种于 12 孔板中,置 37 ℃,5% CO2条件下培养至单层后,用无血清MEM 将待测牡蛎上清 10 倍稀释,加入孔中,400 μL / 孔,并设复孔,置37 ℃,5% CO2孵箱吸附2 h;弃上清,按照本实验室前期建立的 PMA-qRT-PCR 方法处理后[13],取 50 μL上清,用于核酸抽提及qRT-PCR 检测。以HAV 活病毒为标准,以病毒滴度的对数和Ct 值绘制回归曲线,计算样品病毒滴度。
1. 10 免疫组化 将牡蛎解剖后,分别取消化腺、鳃、唇瓣、外套膜和闭壳肌,浸入福尔马林中充分固定48 h 后,包埋于石蜡中,制备石蜡包埋切片,按照试剂盒说明书进行处理、封闭、滴加小鼠抗HAV 单克隆抗体和显色,当肉眼观察到棕黄色时,浸泡于自来水中终止显色,迅速加盖盖玻片,显微镜下观察。
1. 11 统计学分析 应用SPSS 19. 0 软件进行统计学分析,两组比较采用独立样本t 检验,多组比较采用方差分析(ANOVA),以 P < 0. 05 为差异有统计学意义。使用GraphPad Prism 8. 0. 2 和Excel 绘图。
2 结 果
2. 1 牡蛎养殖水体中的总HAV qRT-PCR 检测结果显示,加毒后0 ~24 h,环境水体的HAV 总RNA从最初的 5. 544 Lgcopies / g 逐渐下降,至 3 和 6 h,分别降至 4. 916 和 4. 646 Lgcopies / g,显著低于 0 h的 RNA 浓度(t 分别为 8.777 和 9.062,P<0.000 1);6 h 后降速减缓,至 24 h 降至 4. 428 Lgcopies /g,24 h共下降 1.116 Lgcopies/g(t=10.380,P<0.000 1)。而更换洁净海水(24 h)后1 d(48 h),环境水体中仍可检测出2.757 Lgcopies /g 总HAV,并可持续检出,至 216 h 仍可检测到 1. 838 Lgcopies / g。见图 1。提示受污染牡蛎在养殖过程中,可持续在环境中释放低浓度的HAV,造成养殖环境的生物污染。

图1 牡蛎养殖水体中总HAV 的动态变化(n = 3)Fig. 1 Dynamic changes of total HAV in oyster culture water body(n = 3)
2. 2 牡蛎消化腺中总HAV 的富集和消减规律 qRTPCR 检测结果显示,牡蛎在污染水体中养殖3 h,消化腺中的总HAV 即显著升高至5. 810 Lgcopies / g(t = 9. 016,P < 0. 000 1);随着时间的延长,总 HAV浓度在消化腺中继续缓慢升高,至12 h 达最高点(6.152 Lgcopies/g);之后持续高水平存在,直至净化养殖后2 d(72 h),HAV 才缓慢下降,净化养殖后10 d(264 h),消化腺中 HAV 含量仍达 4.398 Lgcopies/g,较最高点仅下降1. 754 Lgcopies / g。见图2。牡蛎消化腺中总HAV 与环境水体总HAV 变化趋势存在明显差异。
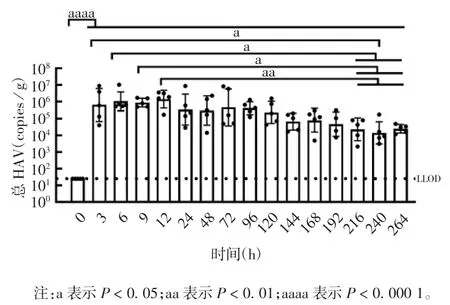
图2 牡蛎消化腺中总HAV 的富集及消减动态趋势(n=5)Fig. 2 Accumulation and depuration of total HAV in digestive gland of oyster(n = 5)
2. 3 牡蛎消化腺中总HAV 和活HAV 的富集和消减规律 qRT-PCR 和PMA-qRT-PCR 法检测结果显示,活HAV 和总HAV 含量均呈先升高后降低的趋势,均于染毒后3 h 即显著升高至3. 432 LgCCID50/g和 5.146 Lgcopies/g,12 h 达峰值(3.929 LgCCID50/g和 6. 440 Lgcopies /g),72 h 后缓慢下降,216 ~ 264 h降至最低点(2.675 LgCCID50/g 和 4.231 Lgcopies/g)。见图3。经配对t 检验,牡蛎消化腺中总HAV 和活HAV 的含量变化趋势差异无统计学意义(t 分别为1. 482、1. 464、1. 364、1. 044、1. 293、1. 274、1. 528和1. 164,P > 0. 05)。

图3 牡蛎消化腺中总HAV 与活HAV 的富集和衰减动态趋势(n = 3)Fig. 3 Dynamic trend of accumulation and depuration of total and live HAV in oyster digestive gland(n = 3)
相关性分析显示,各时间点的活HAV 与总HAV含量具有良好的相关性,R2达0. 811 6,见图4。经推算,牡蛎消化腺中 10 CCID50/ g 活 HAV 约相当于81 copies / g 总 HAV。

图4 牡蛎消化腺中总HAV 与活HAV 含量的相关性分析Fig. 4 Correlation of total and live HAV contents in digestive gland of oyster
2.4 不同组织中HAV 富集水平及免疫组化 qRT-PCR结果显示,染毒后24 h 牡蛎的消化腺、鳃、唇瓣、外套膜和闭壳肌中均可检出总HAV,含量在2. 965 ~6. 086 Lgcopies / g 之间,其中,消化腺中含量最高,唇瓣中最低;消化腺中总HAV 含量显著高于鳃、唇瓣、外套膜和闭壳肌(t 分别为 4. 721、4. 694、5. 633、5.400,P 分别为 0.009 2、0.001 8、0.019 3 和 0.006 4)。见图5。

图5 牡蛎各组织HAV 颗粒的富集和分布(n = 3)Fig. 5 Enrichment and distribution of HAV virus particles in various tissues of oyster(n = 3)
免疫组化结果显示,除闭壳肌因非特异性反应较强外,其他4 个组织均可见阳性HAV 颗粒,且随着感染时间的延长而增多,但不同时间的反应强度存在一定差异。其中,3 h 时即可在唇瓣上皮细胞内见到明显的HAV 阳性颗粒,而消化腺、鳃和外套膜3 h 仅可见弱阳性病毒颗粒,至24 h HAV 反应才见强阳性HAV 颗粒。见图6。
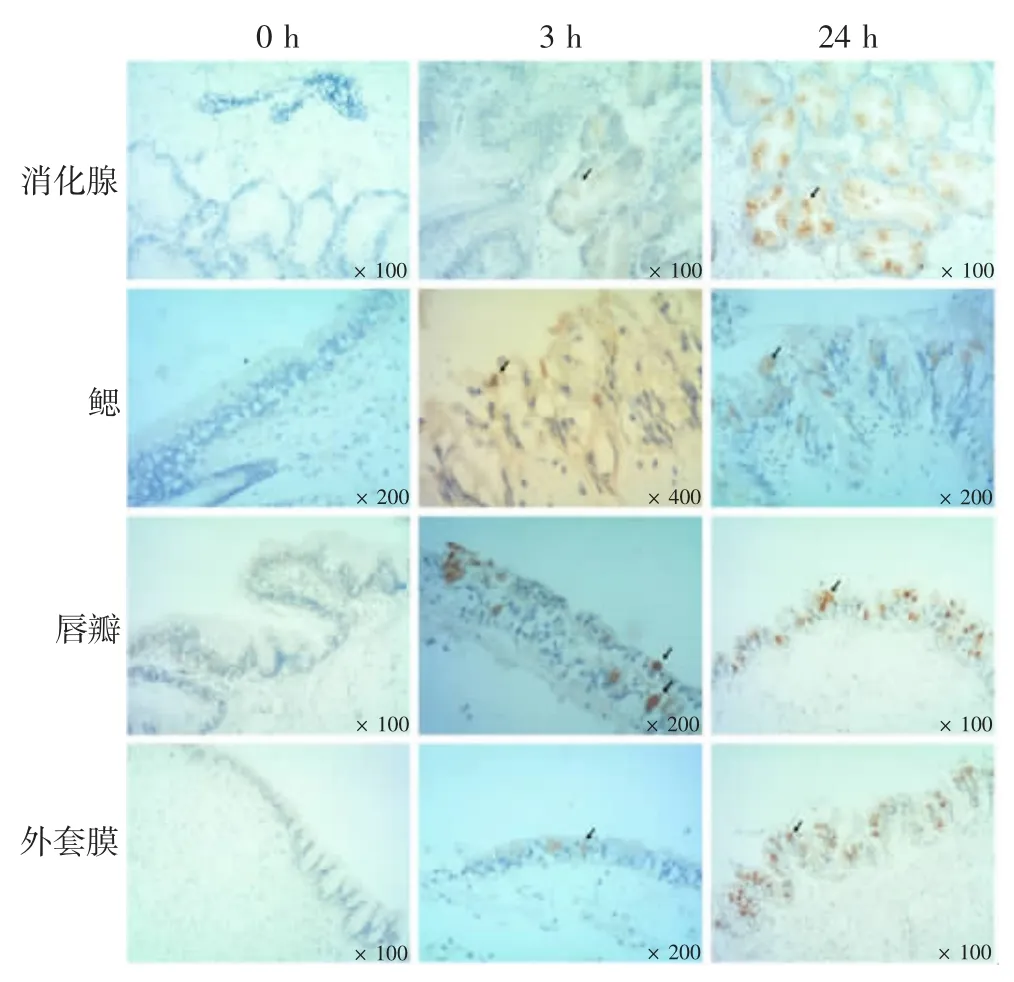
图6 HAV 在牡蛎不同组织的免疫组化时间动态改变Fig. 6 Immunohistochemical temporal dynamics of HAV in different tissues of oyster
3 讨 论
牡蛎又名生蚝、海蛎子,营养价值高,高蛋白低脂肪,含有人体必需的多种营养物质,具有食用价值和药用价值[14]。近年来,随着我国人民生活水平的不断提高,生鲜即食牡蛎越来越得到认可和普及[15]。由于牡蛎具有超强的海水过滤能力,可过滤和富集海水中的各类物质,如导致赤潮的氮和磷等有机物质等,被许多国家称为海水净化的天然能手[16],但这也使其成为HAV 等食源性病毒传播的主要载体[17]。加之近年来我国乃至全球的HAV 流行特征已逐渐发生变化,生鲜即食牡蛎等双壳贝类的食用安全问题越来越得到人们的关注[18]。但相关基础研究较少,特别是关于牡蛎中HAV 富集、衰减动态模型的研究,且多采用qRT-PCR 法检测总HAV,无法区分活病毒和死病毒,难以反映牡蛎中HAV 活力的动态变化,给贝类相关HAV 的监测、净化消减和灭活研究带来极大困惑。
HAV 活力检测是国际公认的食品中安全性监测和研究的难点,也是生物制品学研究和评价的难点。HAV 虽然可在2BS 等细胞上生长、复制,但生长缓慢、病毒滴度低、且不引起细胞病变作用或杀伤作用[19]。因此,在生物制品学研究中只能采用传统的2BS 细胞培养,结合HAV 抗原检测(ELISA)的方法进行活HAV 含量检测[20]。方法操作步骤繁杂、影响因素多、检测周期长(约1 个月)、细胞培养量大、定量准确性较低。而对于牡蛎等贝类食品,由于牡蛎中含有多种生物活性酶,且成分复杂,需要长时间细胞培养的活毒检测方法基本难以实现。2020年,卞莲莲等[13]利用PMA 可选择性进入失活病毒衣壳(及包膜),与病毒基因组共价结合,抑制其聚合酶链式反应的特点,建立了可区分活病毒与死病毒的PMA-qRT-PCR 方法。该方法不需要细胞培养、检测周期短(1 d)、定量准确、操作简便,经验证,可有效区分活病毒与死病毒,与经典的细胞培养法相比,具有良好的相关性,可应用于活HAV 的定量检测。
本研究分别采用qRT-PCR 和PMA-qRT-PCR方法同时检测牡蛎消化腺内总HAV 和活HAV 含量,并对养殖水体的总HAV 进行了检测。结果发现,攻毒后养殖水体的总HAV 从高水平缓慢下降,至 24 h 虽下降了 1. 116 Lgcopies / g,但净化养殖后,仍可在水体中持续检出低浓度的总HAV,直至第9 天(216 h)。在牡蛎消化腺中,总HAV 和活HAV含量均在染毒后3 h 显著升高,12 h 升至最高点,分别为 6. 440 Lgcopies / g 和 3. 929 LgCCID50/ g;此时,总HAV 为环境水体的29. 7 倍;净化养殖后,两者仍持续处于高水平,至72 h 出现缓慢下降,净化后10 d仍可检出 4. 251 Lgcopies / g 和 2. 678 LgCCID50/ g的总HAV 和活HAV,两者的富集和净化衰减动态趋势一致,表明HAV 在牡蛎体内不仅可有效富集,而且可长时间保持病毒活性,并对环境造成持续污染;经相关性分析,从染毒的3 ~264 h(总计11 d),总HAV 与活HAV 含量之间相关性良好(R2=0. 811 6),可通过牡蛎的总HAV 含量检测反映活HAV 含量。
消化腺是国际公认的贝类中HAV 等病原微生物的检测组织。除消化腺外,2019 年HYUNKYUNG等[21]研究显示,鳃中也可检出HAV。但由于牡蛎等贝类成分复杂,HAV 等的提取存在干扰强、回收率低、难度大等问题[22],使HAV 在不同组织的分布研究受到极大限制。本研究采用前期建立的HAV 磁珠免疫沉淀法提取病毒[11],结合qRT-PCR 检测不同组织中的总HAV[12]。结果显示,染毒后24 h,消化腺、鳃、唇瓣、外套膜和闭壳肌中均可检出不同含量的总HAV。其中,消化腺中含量最高,为6.086 Lgcopies/g,显著高于其他各组织(P < 0. 05);唇瓣中最低,为2. 965 Lgcopies / g。采用免疫组化进一步证实,染毒后3 h,唇瓣中首先可见强阳性HAV 颗粒,而消化腺、鳃、外套膜中呈弱阳性反应,至24 h,各组织中阳性反应均明显增强,再次证明消化腺、鳃、唇瓣、外套膜污染HAV 后,均可成为HAV 的病毒库。且在污染早期,唇瓣可能较消化腺更加敏感,可作为早期HAV 污染检测的靶组织予以关注。
综上所述,本研究采用人工暂养方式,对太平洋牡蛎受污染后,HAV 在牡蛎不同组织中的污染富集和净化衰减动态趋势进行分析,发现染毒后3 h,牡蛎消化腺中即可出现高水平HAV,至12 h 达峰值,为环境中的29. 7 倍。净化污染不能有效清除牡蛎体内的HAV,且污染牡蛎可持续排毒,对环境造成二次污染。本研究还首次通过活HAV 快速检测方法发现HAV 可在牡蛎消化腺内长时间保持良好的病毒活力,提出通过总HAV 检测可反映牡蛎中活HAV含量,10 CCID50/ g 活 HAV 约相当于 81 copies / g的总HAV。一方面为贝类等复杂基质中活HAV 的检测和评估提供了新的思路和新手段,另一方面提示我国应加强对牡蛎等可生食贝类的HAV 等肠道病毒的关注,进一步开展相关基础、方法学、病毒监测和管理策略研究,为应对HAV 后疫苗时代出现的HAV 流行和防控的新特点、新需求做好源头控制,更好地保障我国的食品安全。

