桑黄扩大培养活性成分变化规律*
刘 进,许 谦**,贾世杰,李秉恩,丁红振,孙宜秀,张慧敏,张 鑫,王莹菲
(1.菏泽学院农业与生物工程学院,山东菏泽,274015;2.青岛大学生命科学学院,山东青岛,266071)
桑黄菌(Phellinus igniarius) 自古以来就被用作药用真菌[1]。桑黄菌在生长初期表现为茶色,随后颜色渐渐变深;在生长中期逐渐变成马蹄形,往木质发展,越来越坚硬;到了生长末期,桑黄菌表面的皮质硬壳就会从自身脱落,颜色与菌体本身的色彩相同,坚硬,木质,上端逐渐变尖[2]。桑黄的应用历史十分悠久,“桑黄”一词最早出现在隋唐时期甄权的《药性论》中[3],药理作用最初记载在秦汉时期的《神农本草经》中,从古至今被广泛记录,具有止血、排毒、活血的功效[4],现代经过大量科研工作者的努力,研究出桑黄有抗氧化、免疫调节、抗炎、抗肿瘤等生物医学方面的作用[5-8]。桑黄的活性成分有很多,其中最主要的活性成分是多糖、黄酮和三萜类物质。多糖具有抗肿瘤、抗氧化等功效;黄酮具有降血脂血糖、抗衰老等功效;三萜具有抗菌、抗肿瘤等功效[2]。
桑黄在我国集中分布在黑龙江东部、西北地区陕西与甘肃交界的“子午岭”自然保护区、东北的长白山林区等地,国外主要分布在日本、韩国、朝鲜、俄罗斯等地[9]。桑黄的野生资源十分匮乏,产量有限,不足以满足庞大的市场需求,其最有效的解决方法是进行人工栽培和菌丝体发酵。但桑黄人工栽培的难度较大[10-11],且价格昂贵。然而菌丝体液体发酵技术却具有技术要求低、周期短、污染少等优点[12],采用液体发酵技术培养桑黄具有较好的应用前景。目前桑黄相关研究大多集中在培养以及其活性物质的提取和作用功效方面,对桑黄扩大培养过程中活性成分变化规律的研究较少,因此通过对桑黄扩大培养过程中活性成分变化规律进行研究,希望对桑黄的扩大培养以及活性成分的规模化生产提供帮助。
1 材料与方法
1.1 材料
1.1.1 供试菌株
试验的供试菌株为桑黄菌种SH-001,由菏泽学院E208实验室提供。
1.1.2 试验试剂
主要试剂的信息见表1。

表1 主要试剂Tab.1 The main reagents
多糖的测定[12-13]:葡萄糖,蒽酮-硫酸试剂(200 mg蒽酮迅速溶于100 mL 98%浓硫酸中,当天使用)。
黄酮的测定[14]:95%乙醇,98%芦丁,无水AlCl3。
三萜的测定[15-16]:齐墩果酸对照品,香草醛溶液(在10 mL冰醋酸中加入0.5 g香草醛使其溶解,当天使用),乙酸乙酯,高氯酸。
其余试剂为琼脂粉、玉米粉、KH2PO4、MgSO4、马铃薯提取液、豆面。
1.1.3 试验仪器
XY-YT液体菌种培养器,济南蕈源农业机械有限公司;UV-6100可见光分光光度计,上海元析仪器有限公司;MLS-3780高压蒸汽灭菌锅,三洋电机株式会社;ZQZY-C8震荡培养箱,上海知楚仪器有限公司;HR/T20M台式高速冷冻离心机,湖南赫西仪器装备有限公司;GL224I-1SCN电子天平,赛多利斯科学仪器(北京) 有限公司;YJVS-2双人垂直超净工作台,无锡一净净化设备有限公司;BCD-268STCV冰箱,青岛海尔股份有限公司;HH-W-420数显恒温水箱,金坛市江南仪器厂;电热鼓风干燥箱,上海博讯医疗生物仪器有限公司;MJ-250-1霉菌培养箱,上海一恒科学仪器有限公司。
1.2 试验方法
1.2.1 桑黄菌种活化
1)PDA培养基的制备[17]:马铃薯去皮切块,称取200 g,煮沸30 min,8层纱布过滤取滤液,加入20 g琼脂,搅拌至完全溶解,加入20 g葡萄糖混匀,温水定容至1 000 mL,pH自然,趁热分装至锥形瓶,121℃灭菌30 min,倒平板。
2)菌种活化:把桑黄菌种转接至PDA培养基上,28℃培养,每2天观察记录其生长形态。
1.2.2 液体培养
1) 液体培养基
液体培养基配方:玉米粉20 g·L-1、豆面10 g·L-1、KH2PO42.5 g·L-1、MgSO41 g·L-1,pH 自然。
液体培养基配制方法:玉米粉和豆面加适量蒸馏水煮沸30 min,加入KH2PO4和MgSO4,溶解后定容,pH自然。
2) 锥形瓶培养
处理1:250 mL锥形瓶中倒入150 mL液体培养基,8层纱布2层报纸封口,共25瓶,121℃灭菌30 min,冷却备用。从活化桑黄菌种的固体培养基上,用打孔器取直径1 cm圆形菌块接种到液体培养基,每瓶接种2个菌块,28℃、180 r·min-1摇床培养。
处理2:500 mL锥形瓶倒入300 mL液体培养基,8层纱布2层报纸封口,共45瓶,121℃灭菌30 min,冷却备用。从活化桑黄菌种的固体培养基上,用打孔器取直径1 cm圆形菌块接种到液体培养基,每瓶接种4个菌块,28℃、180 r·min-1摇床培养。
2个处理均每3天取样观察,测定并记录其3种活性物质的含量。
3) 发酵罐培养
发酵罐液体培养基:玉米粉20 g·L-1、豆面10 g·L-1,pH自然,接种量10%。
60 L发酵罐加35.8 L液体培养基,闭罐118℃高温灭菌1 h后冷却水循环冷却,取500 mL锥形瓶培养14 d的桑黄菌丝体14瓶,在无菌操作下倒入发酵罐中,温度设定为23℃,罐内气压为0.03 MPa~0.05 MPa,培养7 d,观察记录。
1.2.3 分离菌丝体
培养桑黄菌丝体的250 mL和500 mL锥形瓶各取3瓶,发酵罐取菌丝体时要严格按照操作规范进行无菌操作。各取20 mL培养液通过8层纱布过滤得到菌丝体和发酵液。发酵液放冰箱冷藏,用作胞外活性物质的测量,菌丝体用蒸馏水清洗3次,在60℃干燥箱中干燥至恒重,备用。
1.2.4 多糖含量测定
葡萄糖标准曲线绘制[13]:根据参考文献[13]的方法测定葡萄糖标准液,绘制标准曲线。
胞外多糖测定:取5 mL菌液10 000 r·min-1离心10 min,取1 mL上清液,加入3倍95%乙醇,振荡,4℃过夜,3 500 r·min-1离心15 min,收集沉淀,得到桑黄粗多糖。取桑黄粗多糖溶于10 mL热水,稀释10倍,取0.5 mL于试管中,加入蒽酮-硫酸试剂2 mL,立即摇匀,100℃水浴中显色10 min,取出,冰浴至室温,于波长620 nm处测定其吸光度值。
胞内多糖测定:取0.2 g桑黄干粉加水,料液比为 1 ∶45,100℃浸提 3.5 h,3 500 r·min-1离心 10 min,取上清液,加3倍95%乙醇,后续步骤与胞外多糖的测定方法相同。
1.2.5 黄酮含量测定
标准曲线的绘制、胞外和胞内黄酮含量的测量均按照参考文献[15]进行操作。
1.2.6 三萜含量测定
齐墩果酸标准曲线的绘制、胞内三萜含量的测量均按照参考文献[16]进行操作。
胞外三萜的测定:取1 mL桑黄培养液过滤液,加入95%乙醇3 mL,静置24 h,去沉淀,取上清液1 mL,100℃蒸馏去除乙醇,加入0.4 mL香草醛,1.6 mL高氯酸,70℃水浴15 min,加入4 mL乙酸乙酯摇匀,静置15 min,于波长551 nm处测定吸光度值。
2 结果与分析
2.1 桑黄菌丝体液体发酵
2.1.1 固体培养基菌种活化
PDA固体培养基上桑黄菌种活化过程中的菌丝体形态变化见图1。

图1 固体培养基上桑黄形态的变化Fig.1 Morphological changes of Phellinus igniarius on solid medium
在PDA固体培养基上桑黄菌种活化过程的生长情况详见表2。

表2 桑黄菌种活化过程生长情况记录Tab.2 Growth record of Phellinus igniarius during activation
2.1.2 锥形瓶液体培养
在300 mL液体培养基(处理2) 中桑黄的生长形态变化见图2。

图2 锥形瓶液体培养基中桑黄形态的变化Fig.2 Morphological changes of Phellinus igniarius in liquid medium of conical flask
桑黄在锥形瓶液体培养过程中,取20 mL培养液测定菌丝干重,其测定结果及生长情况记录详见表3。
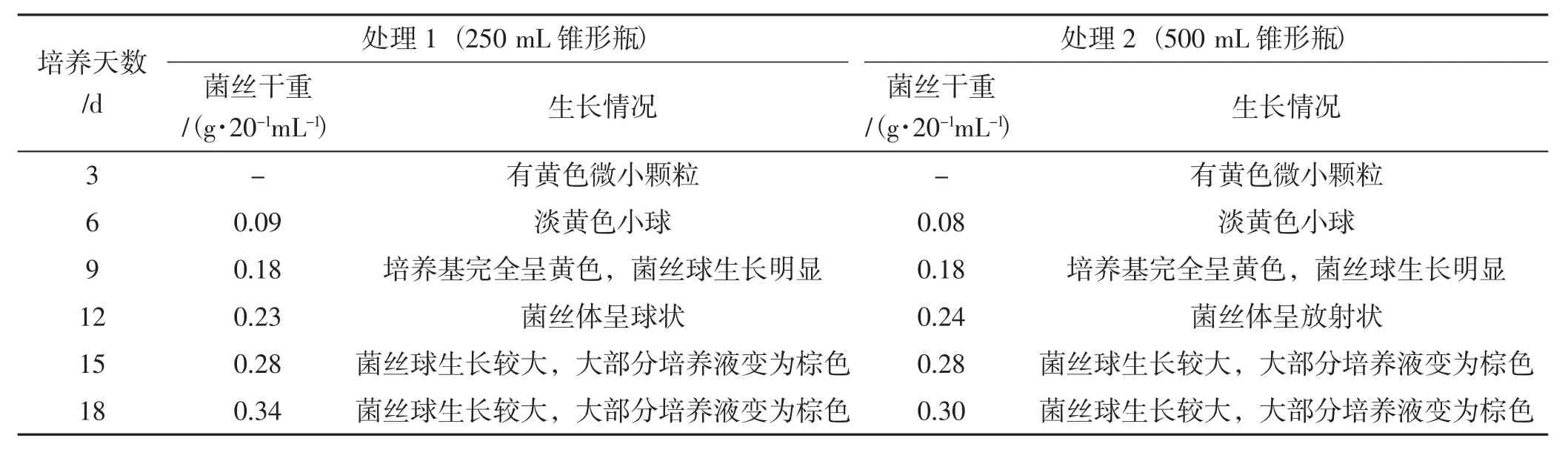
表3 桑黄菌种锥形瓶液体培养过程生长情况记录Tab.3 Growth record of Phellinus igniarius strain in liquid medium of conical flask
由表3可知,处理1与处理2培养的桑黄菌丝体干重基本相同,第6天~第9天菌丝体干重翻倍增加,之后稳步增加。但2个处理中菌丝体生长情况稍有不同,第12天时处理1的桑黄菌丝体呈球状,处理2的桑黄菌丝体呈放射状。
2.1.3 发酵罐液体培养
发酵罐液体培养桑黄的形态变化详见图3。

图3 发酵罐液体培养基中桑黄形态的变化Fig.3 Morphological changes of Phellinus igniarius in liquid medium of fermenter
发酵罐液体培养桑黄过程中取20 mL培养液测定菌丝干重,其测定结果及生长情况记录详见表4。

表4 桑黄菌种发酵罐液体培养过程生长情况记录表Tab.4 Growth record of Phellinus igniarius in liquid medium of fermenter
由表4可知,60 L发酵罐培养的桑黄菌丝体干重在第4天达到最大,第6天不变,第7天时减少0.01 g。证明在60 L发酵罐培养时,菌丝体最好的收获时间为4 d~6 d。
2.2 桑黄液体培养过程中的活性成分
2.2.1 标准曲线
1)多糖测定的标准曲线
在波长620 nm处测定葡萄糖标准液的吸光度值并绘制标准曲线,见图4。

图4 葡萄糖标准曲线Fig.4 Standard curve of glucose
如图4所示,葡萄糖标准曲线的线性回归方程为:

该回归方程的相关系数R2为0.999 8。
2)黄酮测定的标准曲线
通过AlCl3比色法在波长410 nm处测芦丁标准液吸光度值并绘制标准曲线,见图5。

图5 芦丁标准曲线Fig.5 Standard curve of rutin
如图5所示,芦丁标准曲线的线性回归方程为:

该回归方程的相关系数R2为0.999 8。
3)三萜测定的标准曲线
在波长551 nm处测定齐墩果酸标准液的吸光度值并绘制标准曲线,见图6。

图6 齐墩果酸标准曲线Fig.6 Standard curve of oleanolic acid
如图6所示,齐墩果酸标准曲线的线性回归方程为:
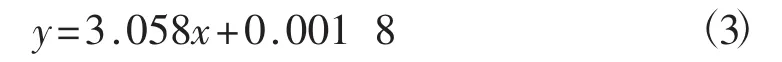
该回归方程的相关系数R2为0.999 7。
2.2.2 桑黄活性成分变化趋势
1) 多糖变化趋势
锥形瓶液体培养桑黄的胞外多糖含量变化趋势见图7。

图7 锥形瓶培养桑黄菌丝体的胞外多糖Fig.7 The extracellular polysaccharide from mycelium of Phellinus igniarius in conical flask
由图7可知,锥形瓶培养的桑黄菌丝体胞外多糖含量的变化趋势总体下降,2个培养规格均在第6天时菌丝体胞外多糖的含量最高,在第12天后快速降低。
锥形瓶液体培养桑黄的胞内多糖含量变化趋势见图8。

图8 锥形瓶培养桑黄菌丝体的胞内多糖Fig.8 The Intracellular polysaccharide from mycelium of Phellinus igniarius in conical flask
由图8可知,胞内多糖含量变化呈波浪形。处理1的桑黄菌丝体胞内多糖在第9天时含量最高,处理2的桑黄菌丝体胞内多糖在第6天含量最高,处理1比处理2的胞内多糖含量峰值延迟3 d出现。二者相比,处理2的培养条件更利于胞内多糖迅速产生。
发酵罐液体培养桑黄菌丝体的胞外多糖含量变化趋势见图9。

图9 发酵罐培养桑黄菌丝体的胞外多糖Fig.9 The extracellular polysaccharide from mycelium of Phellinus igniarius in fermenter
由图9可知,发酵罐培养的桑黄菌丝体胞外多糖含量先减少后增加,在第7天时最高。
发酵罐液体培养桑黄菌丝体的胞外多糖含量变化趋势见图10。

图10 发酵罐培养桑黄菌丝体的胞内多糖Fig.10 The Intracellular polysaccharide from mycelium of Phellinus igniarius in fermenter
由图10可知,发酵罐培养的桑黄菌丝体胞内多糖波动变化,含量先增加后减少再增加,在第7天达到峰值。
2) 黄酮变化趋势
锥形瓶液体培养桑黄菌丝体的胞外黄酮含量变化趋势见图11。

图11 锥形瓶培养桑黄菌丝体的胞外黄酮Fig.11 The extracellular flavonoids from mycelium of Phellinus igniarius in conical flask
由图11可知,相同培养时间下,处理1培养的桑黄菌丝体胞外黄酮含量均高于处理2,且都呈先高后低的趋势。处理1胞外黄酮含量在第12天时最高,处理2第9天含量最高,处理1峰值出现时间比处理2延迟3 d。
锥形瓶液体培养桑黄菌丝体的胞内黄酮含量变化趋势见图12。

图12 锥形瓶培养桑黄菌丝体的胞内黄酮Fig.12 The Intracellular flavonoids from mycelium of Phellinus igniarius in conical flask
由图12可知,除第9天以外,其他相同的培养时间下,处理1培养的桑黄菌丝体胞内黄酮含量都高于处理2,且都呈先高后低的趋势,并均于第12天达到峰值。
发酵罐液体培养桑黄菌丝体的胞外黄酮含量变化趋势见图13。

图13 发酵罐培养桑黄菌丝体的胞外黄酮Fig.13 The extracellular flavonoids from mycelium of Phellinus igniarius in fermenter
由图13可知,60 L发酵罐培养的桑黄菌丝体胞外黄酮含量先增加后减少再增加,第7天胞外黄酮的含量最高。
发酵罐液体培养桑黄菌丝体的胞内黄酮含量变化趋势见图14。

图14 发酵罐培养桑黄菌丝体的胞内黄酮Fig.14 The Intracellular flavonoids from mycelium of Phellinus igniarius in fermenter
由图14可知,60 L发酵罐培养的桑黄菌丝体胞内黄酮的含量先增加后降低,第6天胞内黄酮含量最高。
3) 三萜变化趋势
锥形瓶液体培养桑黄菌丝体的胞外三萜含量变化趋势见图15。
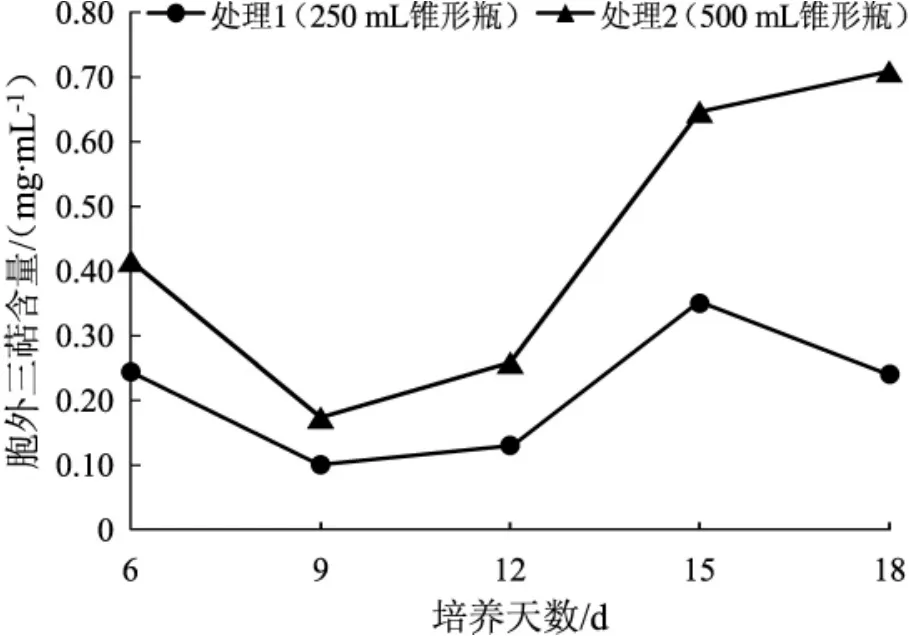
图15 锥形瓶培养桑黄菌丝体的胞外三萜Fig.15 The extracellular triterpenes from mycelium of Phellinus igniarius in conical flask
由图15可知,相同的培养时间下,处理2的桑黄菌丝体胞外三萜含量均大于处理1。处理1中胞外三萜含量先减少后增加又减少,第15天含量最高;处理2中胞外三萜含量先减少后增加,第18天含量最高。
锥形瓶液体培养桑黄菌丝体的胞内三萜含量变化趋势见图16。

图16 锥形瓶培养桑黄菌丝体的胞内三萜Fig.16 The Intracellular triterpenes from mycelium of Phellinus igniarius in conical flask
由图16可知,相同的培养时间下,处理2的桑黄菌丝体胞内三萜含量基本大于处理1。处理1中胞内三萜的含量先增加后减少再增加又减少,第15天含量最高;处理2中胞内三萜含量先增加后减少再增加,第9天含量最高。
发酵罐液体培养桑黄菌丝体的胞外三萜含量变化趋势见图17。

图17 发酵罐培养桑黄菌丝体的胞外三萜Fig.17 The extracellular triterpenes from mycelium of Phellinus igniarius in fermenter
由图17可知,60 L发酵罐培养的桑黄菌丝体胞外三萜含量先减少后增加,在第7天含量最高。
发酵罐液体培养桑黄菌丝体的胞内三萜含量变化趋势见图18。

图18 发酵罐培养桑黄菌丝体的胞内三萜Fig.18 The intracellular triterpenes from mycelium of Phellinus igniarius in fermenter
由图18可知,60 L发酵罐培养的桑黄菌丝体胞内三萜含量持续减少,在第2天含量最高。
3 讨论与结论
桑黄菌丝体在2种规格锥形瓶液体培养基和发酵罐的扩大培养过程中,3种活性物质的含量分别表现出不同的变化趋势。
在150 mL和300 mL液体培养基中胞外多糖都呈下降趋势;150 mL液体培养基培养的桑黄菌丝体胞内多糖峰值出现时间比300 mL液体培养基培养的延迟3 d,说明300 mL液体培养基培养条件下更利于胞内多糖的迅速产生。60 L发酵罐培养的桑黄胞外多糖呈上升趋势,而单位胞外胞内多糖的峰值产量低于锥形瓶培养胞内胞外多糖的峰值产量。
在150 mL和300 mL液体培养基中桑黄菌丝体胞外、胞内黄酮都呈先高后低的趋势。150 mL液体培养基中单位黄酮产量高于300 mL液体培养基中单位黄酮产量,二者相比,150 mL液体培养基的培养条件更利于胞外、胞内黄酮的高产。60 L发酵罐培养的桑黄菌丝体胞外、胞内黄酮都呈现先增长态势,胞外黄酮第7天达到峰值,胞内黄酮第6天达到峰值。发酵罐培养中单位胞外、胞内黄酮的峰值产量均低于锥形瓶培养中的峰值产量。
在150 mL和300 mL液体培养基中桑黄菌丝体胞外、胞内三萜都有相似的变化规律。其中,150 mL液体培养基中胞内、胞外三萜含量都在第15天达到峰值。300 mL液体培养基中单位三萜产量高于150 mL液体培养基,二者相比,300 mL液体培养基的培养条件更利于胞外、胞内三萜的生产。60 L发酵罐中单位胞外三萜的峰值产量高于锥形瓶胞外三萜的峰值产量,单位胞内三萜的峰值产量接近锥形瓶胞内三萜的峰值产量,说明胞外三萜更适合在大容量培养条件下获得。
通过比较2种规格锥形瓶桑黄菌丝体生长的情况,可以捕捉桑黄在扩大培养过程中菌丝球的变化特征及活性物质的变化规律,为规模化工业生产提供参考依据。同时,试验结果说明,如果进行桑黄菌丝体多糖及黄酮的规模化生产,培养条件还需要进一步优化。如果进行桑黄三萜的规模化培养,目前培养条件基本能够达到量化生产需求。这为确定桑黄规模化培养条件、适时收获桑黄菌丝体及其多糖、黄酮、三萜等活性物质具有重要的指导意义。

