高血压病气虚血瘀证患者血清对CRL-1730线粒体细胞色素C凋亡途径的影响∗
胡小勤,蒙 丹,付 蓉,郝二伟,2,段慧明,曾学文,3△
1广西中医药大学,广西 南宁 530022;2广西中药药效研究重点实验室;3金华高等研究院
高血压病是临床常见的一种心血管疾病[1],气虚血瘀证是高血压病的常见中医证型[2],高血压病[3]及气虚血瘀证[4]的形成都与血管内皮细胞损伤存在密切的关系,也都具有细胞凋亡的病理生理学特征。在前期研究中,采用流式细胞仪检测了高血压病气虚血瘀证患者的血清作用于内皮细胞后的细胞凋亡率,发现高血压病气虚血瘀证组细胞凋亡率明显升高;并发现透射电镜下细胞线粒体肿胀或空泡变,管网状结构碎裂,嵴消失,证实了高血压病气虚血瘀证患者血清可以诱导血管内皮细胞凋亡[5],但诱导凋亡的具体机制尚不明确。有研究表明[6],线粒体在细胞凋亡中起着中心调控作用,细胞色素C(cytochrome-c,Cyt-C)是线粒体介导的细胞凋亡途径中不可缺少的重要因子,在凋亡过程中起着关键作用。线粒体Cyt-C途径主要由Bcl-2、Bax、Cyt-C、Apaf-1、Caspase-9、Caspase-3等分子组成[7]。本实验以体外培养的人脐静脉血管内皮细胞株(CRL-1730)为观察对象,主要观察高血压病气虚血瘀证患者的血清对内皮细胞线粒体Cyt-C途径的影响,进一步阐明高血压病气虚血瘀证患者血清诱导血管内皮细胞凋亡的机制。
1 材料与方法
1.1 实验材料人脐静脉内皮细胞株CRL-1730,由复旦生物医学研究院细胞资源中心提供,批号:CP-H082。
1.2 实验动物60只SPF级SD大鼠,雌雄各30只,体质量180~210 g,由广西医科大学实验动物中心提供,实验动物生产许可证号:SCXK(桂)2014-0002。饲养条件:大鼠每天喂养一次饲料,两天更换一次垫料与水。
1.3 实验试剂胎牛血清(fetal bovine serum,WS500T)、青霉素(penicillin,I9532-10MG)、链霉素(streptomycin,批 号:57-92-1);高 糖DMEM(Gibco,批号:PM150210);0.25%胰酶-0.02%EDTA(北京索莱宝,批号:03-050-1A/B);一抗Cyt-C(Sant Cruz,YT154)、Apaf-1(Sant Cruz,EK-R38301)、Caspase-9(Sant Cruz,批号:BS6444);二抗Cy-3羊抗鼠(Abgree,批号:BHR102);正常熔点琼脂糖(normal melting point agarose,NMA)、低熔点琼脂糖(low melting point agarose,LMA)(TAKARA,批号:6132-04-3);Cyt-C、Apaf-1、Caspase-9引物(上海康成生物科技有限公司,批号:HZ-2654);溴化乙锭(ethidium bromide,EB)(Sigma,批号:1239-45-8);三(羟甲基)胺基甲烷[tris(hydroxymethyl)amine methane,Tris](南京凯基,批号:KGF019-1);RIPA组织细胞快速裂解液(Boster,批号:08J15B02);乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium,Na2EDTA)(上海前尖生物科技有限公司,批号:13254-36-4)。
1.4 实验仪器1000 μL移液器(Eppendorf公司);TGL型台式低温离心机、CO2培养箱(Thermo公司);DYY-6C型电泳仪水平、XCell SureLock Mini-Cell型电泳槽(美国BIO-RAD公司);MA-688型实时荧光定量PCR仪(Thermo Fisher Scientific公司)。
1.5 实验方法
1.5.1 临床资料 选择2016年7月至2017年1月在广西中医药大学附属瑞康医院心血管内科就诊的高血压病[8]患者80例,分为高血压气虚血瘀证[9-10]组和高血压非气虚血瘀证组,每组40例;健康体检者20例为健康对照组。3组基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.5.2 人血清采集 空腹状态下,取每人外周血约8 mL,放入带帽无菌不抗凝试管,自凝后,以4℃,离心半径10 cm,3000 r/min离心15 min,取上清液置于无菌EP管,混合均匀,灭活,过滤除菌,置于-80℃,备用。每组血清混合后用于细胞学实验。
1.5.3 动物分组及处理1)将60只SD大鼠随机分为空白对照组(30只)和补阳还五汤高、中、低剂量组(各10只)。2)补阳还五汤原方剂量进行水煎提取(生黄芪120 g,当归尾6 g,赤芍5 g,地龙3 g,川芎3 g,红花3 g,桃仁3 g)。按照体表面积换算用药量,补阳还五汤高、中、低剂量组大鼠分别用等效剂量的24、12、6 g/(kg·d)灌胃,每日2次,两次间隔12 h,连续3天。空白对照组以等体积的生理盐水灌胃。
1.5.4 动物血清采集1)含药血清:于末次灌胃1 h后颈动脉放血,自凝后以4℃,离心半径10 cm,3000 r/min离心15 min,取上清,将同组血清混合,放入无菌EP管,混匀,灭活,过滤除菌,-80℃冻存备用。2)空白血清:空白对照组以同法取血清。
1.5.5 混合血清培养液制备 各组混合血清培养液制备:高血压病气虚血瘀证组、高血压病非气虚血瘀证组、健康对照组分别以各组10%血清+10%空白血清+80%的高糖DMEM培养基,补阳还五汤各剂量组分别以10%补阳还五汤高、中、低剂量含药血清+10%高血压病气虚血瘀证患者血清+80%高糖DMEM培养基。
1.5.6 细胞培养 取对数生长期内皮细胞,消化、传代后,按1×105/mL密度,接种于25 mL培养瓶,4 mL/瓶,每组6瓶,共36瓶,每2瓶为一个样品。先用含10%胎牛血清的高糖DMEM培养基培养24 h后,在再换无血清培养液同步化以后,分为6组,继续培养24 h。
1.6 观察指标
1.6.1 激光共聚焦显微镜检测内皮细胞Cyt-C蛋白的表达和分布 取生长良好的人脐静脉内皮细胞对数生长期细胞,消化、传代,以3×105/mL接种于6孔板,按上述实验分组分为6组,每组设置6个复孔,每孔2 mL的培养液,培养24 h后,换无血培养液使细胞同步化24 h,再用混合血清培养液培养24 h。再进行以下操作:弃细胞上清液;PBS洗2次;每孔加入4%多聚甲醛,室温固定细胞,10 min;PBS洗5 min,3次;TritonX-100(0.3%)通透细胞,20 min;PBS洗5 min,3次;每孔加2%BSA封闭液,37℃30 min;加一抗:4℃孵育过夜;PBS洗5 min,3次;加二抗:37℃避光孵育60 min;PBS洗5 min,3次;甘油:PBS=1∶1封片,避光,上机检测。
1.6.2 蛋白免疫印迹法(Western Blot)检测内皮细胞Cyt-C、Apaf-1、Caspase-9蛋白的表达 细胞接种于25 mL培养瓶中,按上述分组和处理,随机分为6组,每组3瓶。弃培养液,冰上裂解10 min(裂解液∶NaF∶PMSF=100∶5∶1);细胞刮离并收集细胞;4℃,离心半径10 cm,12 000 r/min离心15 min,多功能酶标仪测定总蛋白含量,调整上样孔浓度为80 μg进行电泳。电泳完备后转膜;50 g/L脱脂牛奶封闭1 h;各蛋白单抗和β-actin 4℃孵育过夜;5 g/L TritonX-100洗 膜3次;IRDyeTM 800标记的山羊抗小鼠二抗(1∶2000)孵育2 h;1 g/L Tween-20洗膜3次;Odyssey双红外成像系统扫描成像,即可获得结果图像。各蛋白条带灰度值与β-actin灰度值相比作为各蛋白相对表达量。
1.6.3 酶联免疫法(ELISA)检测内皮细胞Cyt-C、Apaf-1、Caspase-9细胞培养上清液蛋白的含量 取生长良好的对数生长期CRL-1730,消化、传代以1×105/mL种24孔板,共分6组,每组设置6孔,每孔各500 uL的培养液,培养24 h后,换无血培养液使细胞同步化24 h,最后再用混合血清培养液培养24 h,再换无血培养液使细胞同步化24 h,然后取细胞培养上清液于4℃,离心半径10 cm,1000 r/min离心15 min,取上清液,冻存待测。按ELISA试剂盒说明检测细胞培养上清液蛋白含量。
1.7 统计学方法采用SPSS 24.0软件进行数据统计分析,计量资料以±s表示,采用t检验,多组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 激光共聚焦显微镜检测内皮细胞Cyt-C蛋白表达和分布情况高血压病气虚血瘀证组及高血压病非气虚血瘀证组与健康组比较,Cyt-C的表达均明显升高(P<0.01);补阳还五汤各剂量组明与高血压病气虚血瘀证组比较,Cyt-C的表达显降低(P<0.01或P<0.05)。见图1、表1。
表1 激光共聚焦显微镜下各组内皮细胞Cyt-C蛋白表达比较(±s)
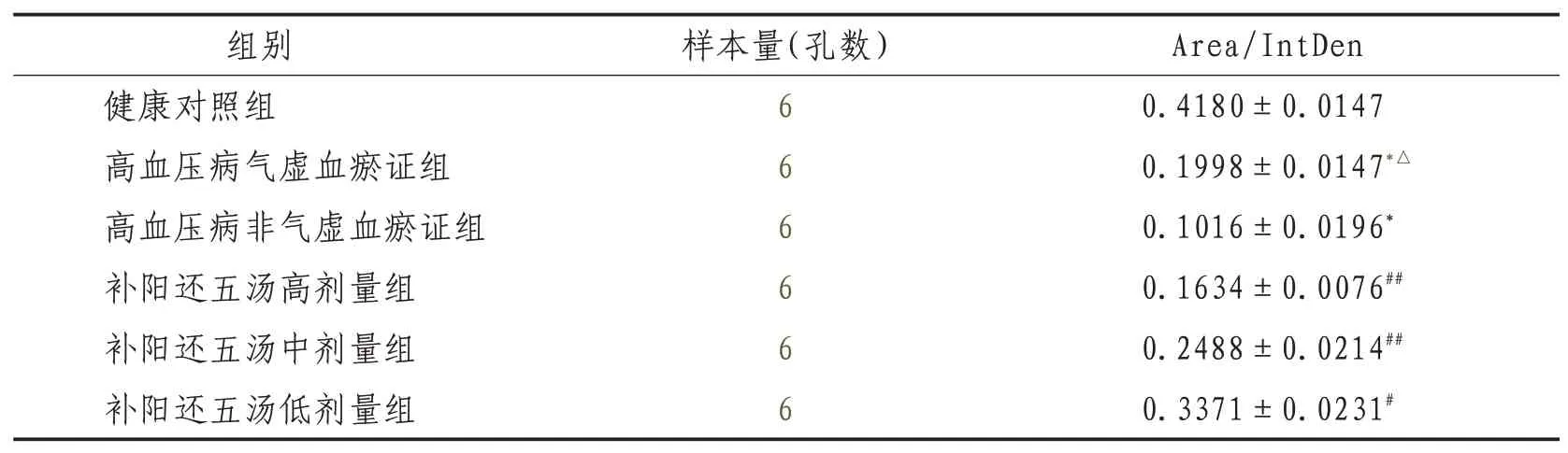
表1 激光共聚焦显微镜下各组内皮细胞Cyt-C蛋白表达比较(±s)
注:与健康对照组比较,*表示P<0.01;与高血压病非气虚血瘀证组比较,△表示P<0.05;与高血压病气虚血瘀证组比较,#表示P<0.05,##表示P<0.01
?

图1 激光共聚焦显微镜观察各组Cyt-C的分布(×400)
2.2 Western Blot检测内皮细胞Cyt-C、Apaf-1、Caspase-9相关蛋白表达高血压病气虚血瘀证组及高血压病非气虚血瘀证组与健康组比较,Cyt-C、Apaf-1、Caspase-9的表达均明显升高(P<0.01或P<0.05);补阳还五汤各剂量组与高血压病气虚血瘀证组比较,Cyt-C、Apaf-1、Cas-pase-9的表达明显下降(P<0.01或P<0.05)。见表2、图2。
表2 Western Blot检测各组内皮细胞Cyt-C、Apaf-1、Caspase9蛋白表达量比较(±s)
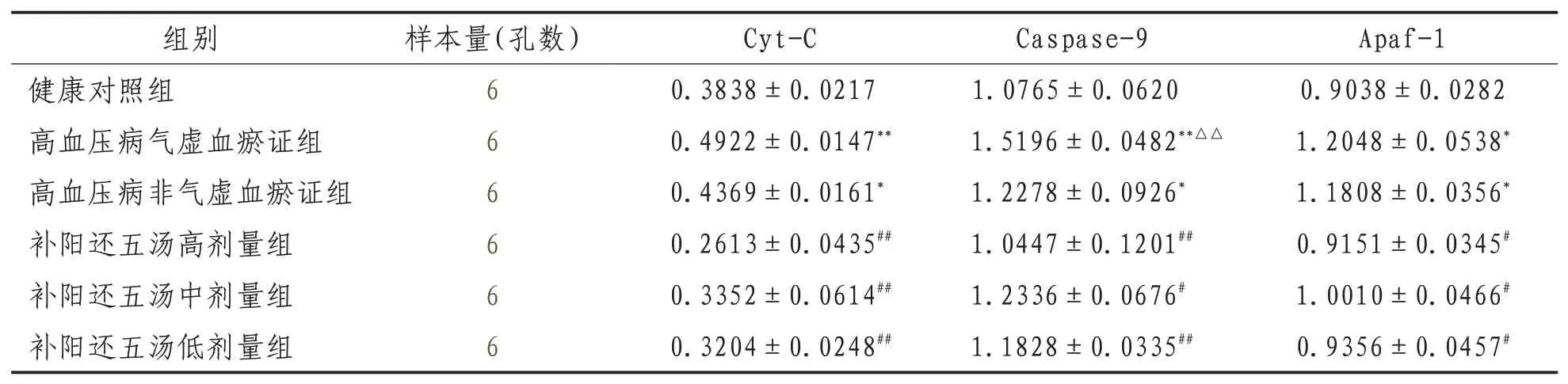
表2 Western Blot检测各组内皮细胞Cyt-C、Apaf-1、Caspase9蛋白表达量比较(±s)
注:与健康对照组比较,*表示P<0.05,**表示P<0.01;与高血压病非气虚血瘀证组比较,△表示P<0.05,△△表示P<0.01;与高血压病气虚血瘀证组比较,#表示P<0.05,##表示P<0.01
?
2.3 ELISA检测内皮细胞Cyt-C、Apaf-1、Caspase-9细胞培养上清液中蛋白表达高血压病气虚血瘀证组及高血压病非气虚血瘀证组与健康组比较,Cas-pase-9、Apaf-1、Cyt-C表达均明显升高(P<0.01或P<0.05);高血压病气虚血瘀证组与高血压病非气虚血瘀证组比较,表达明显升高(P<0.01或P<0.05);补阳还五汤各剂量组与高血压病气虚血瘀证组比较,表达明显降低 (P<0.01或P<0.05)。见表3。??
表3 ELISA检测各组细胞培养上清液中Cyt-C、Apaf-1、Caspase9蛋白含量比较(±s)
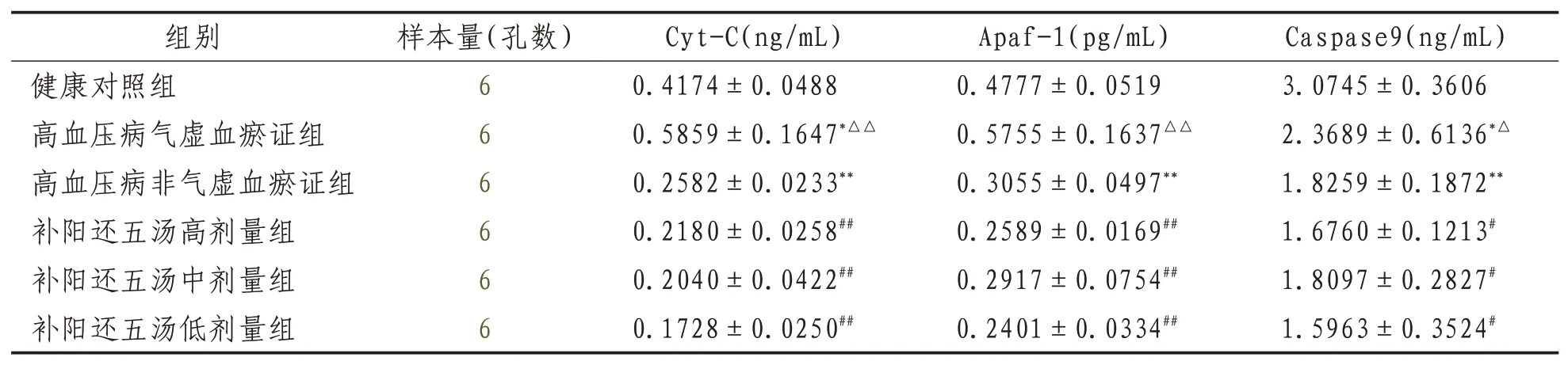
表3 ELISA检测各组细胞培养上清液中Cyt-C、Apaf-1、Caspase9蛋白含量比较(±s)
注:与健康对照组比较,*表示P<0.05;**表示P<0.01;与高血压病非气虚血瘀证组比较,△表示P<0.05,△△表示P<0.01;与高血压病气虚血瘀证组比较,#表示P<0.05,##表示P<0.01
?
3 讨论
细胞凋亡通过细胞内的遗传机制使细胞走向死亡,最终整个细胞的成分被消化降解[11]。经典的细胞凋亡途径有两条,分别为细胞表面死亡受体途径(或称细胞外途径)和线粒体引发途径(或称细胞内途径)[12]。
在细胞凋亡过程中,线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)过度开放,线粒体跨膜电位降低,导致一些相关的促凋亡因子,如细胞色素C(Cytochrome C)、凋亡诱导因子(apoptosis inducing factor,AIF)等从线粒体释放到细胞质中[13]。目前,Cyt-C和Caspase-9是线粒体凋亡信号通路的关键调节因子已得到证实[14]。实验研究表明,Cyt-C不仅可以直接介导细胞凋亡,还可以通过干扰呼吸链电子传递的运输、促进活性氧自由基的产生、阻断能量合成等方式间接参与细胞凋亡过程[15-16],确定细胞色素C是线粒体启动凋亡程序的关键物质[17]。此外,以Caspase-9为核心的线粒体凋亡途径是WNT通路下游的一个凋亡通路,Caspase-9是线粒体凋亡信号通路的关键调节因子也已得到证实[14]。
凋亡蛋白酶活化因子1(apoptosis protease activating factor-1,Apaf-1)是细胞质中的一种蛋白质,其氨基端有半胱氨酸蛋白酶募集域,可促进多个Caspase家族成员前体活化[18]。有研究表明,细胞线粒体中的细胞色素C通过线粒体外膜,大量释放到胞液中,与Apaf-1在ATP作用下促使Apaf-1激活,活化的Apaf-1依次激活Caspase-9和Caspase-3,最终导致细胞凋亡的发生[19]。说明Apaf-1是线粒体凋亡信号通路中关键调节因子。
目前,对Cyt-C释放后作用的机制已经较为清楚[20],线粒体释放Cyt-C分两步,即先从呼吸链上游离出来,而后才被释放入胞浆。入胞浆的Cyt-C与Apaf-1羧基端的WD重复序列结合,诱导Apaf-1变构并进一步结合Caspase-9前体,使Caspase-9复合体自发激活。Cyt-C、Apaf-1与Caspase-9复合物就是凋亡体,凋亡体继续激活下游的Caspase-3,引发级联反应,从而导致凋亡。
实验结果表明,与健康组比较,高血压病气虚血瘀证组及高血压病非气虚血瘀证组Cyt-C、Apaf-1、Caspase-9蛋白表达均明显升高;与高血压气虚血瘀证组比较,补阳还五汤各剂量组Cyt-C、Apaf-1、Caspase-9蛋白表达明显降低。
结合前期实验结果及本次的实验结果,我们认为:高血压病气虚血瘀证患者血清存在细胞凋亡,且凋亡过程中Caspase-3、Bax、Cyt-C、Apaf-1、Caspase-9的表达量均升高。说明高血压病气虚血瘀证患者血清诱导内皮细胞凋亡的机理与线粒体Cyt-C途径密切相关。本课题对凋亡机制的研究现停留在蛋白层次,下一步拟从mRNA及非编码RNA层次开展研究。

