结核分枝杆菌膜蛋白MmpS5-MmpL5的表达及功能研究
李东硕 王彬 陆宇 徐建
贝达喹啉(bedaquiline,Bdq)能够抑制结核分枝杆菌(Mycobacteriumtuberculosis,MTB)的三磷酸腺苷(adenosine triphosphate,ATP)合成酶,有着重要的灭菌活性,是缩短结核病疗程和治疗耐药结核病的关键新药[1]。2018年,世界卫生组织(World Health Organization,WHO)将Bdq列为治疗耐多药结核病(MDR-TB)或利福平耐药结核病(RR-TB)的A组药物[2]。Bdq的临床耐药株很快出现[3-4],迫切需要对其耐药机制进行深入研究,以便在临床大规模使用该药品时,能够合理用药,降低耐药率的发生。
尽管编码ATP合成酶的atpE基因突变与Bdq耐药相关,但在Bdq治疗的临床患者中分离的很少。临床上首先发现且报道最多的是Rv0678基因突变[3-5]。笔者前期研究也在中国MDR-TB患者中分离到了Bdq和氯法齐明的原发耐药株,发现MTB的Rv0678突变会导致其对Bdq与氯法齐明的交叉耐药[6]。Rv0678基因是MmpS5-MmpL5系统的转录抑制因子,Rv0678基因突变会引起外排泵基因mmpS5及mmpL5的过表达。
MmpL5是多重跨膜的膜蛋白,其蛋白结构尚无解析,MmpS5-MmpL5的功能尚不清楚。膜蛋白的表达与纯化一直是研究膜蛋白功能的技术难题。笔者前期在大肠杆菌中多次尝试表达但结果仍不理想。考虑到耻垢分枝杆菌基因组与MTB高度同源,耻垢分枝杆菌属快生长分枝杆菌且具有无致病性及传染性等优点,笔者采用耻垢分枝杆菌作为模式菌研究,对pMV261载体进行改造,在载体上插入用于调控乙酰胺酶表达的可诱导型启动子,构建了MmpL5和MmpS5-MmpL5蛋白在耻垢分枝杆菌中的表达体系,并对其功能进行了研究,以期为后续蛋白纯化并研究Bdq的转运机制奠定基础。
材料和方法
一、实验菌株
MTB标准株H37Rv(ATCC 27294)和耻垢分枝杆菌MycobacteriumsmegmatisMC2155(ATCC 700084)由首都医科大学附属北京胸科医院/北京市耐药结核病重点实验室保存并提供。
二、实验药物
Bdq(上海瀚香生物科技公司;批号:20200518;纯度≥98%)、异烟肼(美国Sigma公司;批号:MKBV9475V;纯度≥99%)。
三、 仪器与试剂
1.仪器:Nuaire701二氧化碳恒温培养箱(美国Nuaire公司)、Infinite 200多功能酶标仪(瑞士Tecan 公司)、GENEPRO多功能基因扩增仪(杭州博日科技股份有限公司)、Amersham Imager 600蛋白成像仪(美国GE公司)、Max-Q8000低温摇床(美国赛默飞世尔科技公司)、DS-11FX超微量分光光度计(美国DeNovix公司)、Tanon-4200全自动数码凝胶成像系统(上海天能科技有限公司)。
2.试剂:pMV261质粒为本实验室保存;KpnⅠ(R0142V)、BamHⅠ(R0136V)、EcoRⅠ(R0101V)、HpaⅠ(R0105V)、HindⅢ(R0104V)均购自美国纽英伦生物技术公司;E.coliDH5α购自宝生物工程(大连)有限公司(批号:R2015V);pLB零背景快速连接试剂盒购自天根生化科技(北京)有限公司(批号:VT205);ATP检测试剂盒(S0026)、特超敏ECL化学发光试剂盒(P0018AS)、苯甲基磺酰氟(PMSF;ST506)、细胞膜蛋白与细胞浆蛋白提取试剂盒(P0033)均购自上海碧云天生物技术有限公司。
四、构建带有组氨酸标签的乙酰胺诱导型载体pMV261s
采用PCR的方法从耻垢分枝杆菌中扩增乙酰胺酶基因,引物序列如下:AI-F:5′-ctaggtaccagtgacgcggtctcaagcg-3′(KpnⅠ),AI-R:5′-ctaggatcc-aaaactacctcgggcatgtgg-3′(BamHⅠ),下划线处为酶切位点。PCR反应后目的基因与pLB克隆载体连接,目的片段经琼脂糖凝胶电泳回收与pMV261载体双酶切后连接。设计一段在N端含有6×His组氨酸标签的序列,并引入BamHⅠ及HpaⅠ的酶切位点黏性末端,序列如下:261-F:5′-gatcctcaccaccaccaccaccacactagtcagctgcagaattcatatgcatcgatggtt-3′(斜体标示序列为6×His组氨酸标签序列);261-R:5′-aaccatcgatgcatatgaattctgcagctgactagtgtggtgg-tggtggtggtgag-3′,将上述质粒经BamHⅠ及HpaⅠ双酶切后,与此序列连接,构建带有组氨酸标签的乙酰胺诱导型载体,命名为pMV261s。
五、目的基因与pMV261s的连接及转化
根据NCBI中MTB标准株H37Rv的mmpS5及mmpL5的基因序列设计引物,引物序列如下:mmpS5-F:5′-ccggaattcgatgattggaactctcaagc-3′和mmpL5-F:5′-ccggaattcgatgatcgtgcaaaggac-3′ (EcoRⅠ);mmpL5-R:5′-ccggttaactcagaccaaggcgaagg-3′(HpaⅠ);构建mmpS5-mmpL5全长基因,前引物为mmpS5-F,后引物直接为mmpL5-R。PCR扩增,琼脂糖凝胶电泳,切胶回收,pLB载体过夜连接提取目的基因。EcoRⅠ及HpaⅠ双酶切的目的基因与pMV261s载体连接,转化连接产物至E.coliDH5α大肠杆菌感受态细胞,挑取阳性克隆并测序验证。
将测序验证正确的含mmpL5及mmpS5-mmpL5基因的质粒及空质粒电转入耻垢分枝杆菌感受态细胞,电转条件为电压2500 V、电容25 μF,电阻1000 Ω,电转化杯厚度2 mm。转化后于含10% OADC添加剂的7H9培养基中37 ℃恒温摇床继续培养4 h,吸取一定体积涂布在含终浓度为50 μg/ml的卡那霉素的LB平板上,挑取单克隆于7H9+10% OADC+50 μg/ml卡那霉素培养基培养。
六、MmpL5及MmpS5-MmpL5蛋白的表达
待菌液培养至波长600 nm处吸光度值(A600值)等于0.8,加入终浓度为0.2%的乙酰胺溶液诱导蛋白表达,37 ℃条件下继续培养20 h,收集诱导表达后的菌液,离心后弃上清,菌沉淀用预冷的磷酸盐缓冲液(PBS)重悬,离心弃上清,菌沉淀加入细胞膜蛋白与细胞浆蛋白抽提试剂A和PMSF,悬浮后冰浴10~15 min,高压破碎仪破碎菌体,4 ℃ 1200×g离心10 min,收集上清液,继续14 000×g离心30 min,吸除上清,沉淀加入膜蛋白抽提试剂B,振荡后冰浴,14 000×g离心5 min,抽提膜蛋白。
七、蛋白免疫印迹分析
提取的蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转移至聚偏氟乙烯(PVDF)膜,用含5%脱脂奶粉的TBST缓冲液封闭2 h,加入1∶2000的抗组氨酸鼠源IgG单克隆抗体一抗,TBST缓冲液洗去一抗,加入1∶5000的羊抗鼠IgG二抗孵育,TBST缓冲液洗去二抗,加入辣根过氧化物酶显色剂孵育后,进行化学显色检测。
八、生长曲线的测定
为了验证外源基因表达对耻垢分枝杆菌生长的影响,测定了空质粒、表达MmpL5及MmpS5-MmpL5的菌株的生长曲线。将这3种细菌培养至对数生长期后,调整A600值一致,之后按1%接种在含0.05%吐温-80的7H9+10%OADC培养基中,37 ℃恒温摇床继续培养,每隔5 h测定1次A600值,每个样品设置2个生物学重复,绘制生长曲线。
九、检测抗菌药物对耻垢分枝杆菌的最小抑菌浓度(minimal inhibitory concentration,MIC)
将3种细菌培养至对数生长期,用7H9+10%OADC培养基将菌液稀释至终浓度为1×105CFU/ml。取96孔黑色培养板,依次将异烟肼及Bdq倍比稀释。37 ℃培养3 d后,各孔加入20 μl的阿尔玛蓝和12.5 μl的20%吐温-80,37 ℃继续培养24 h,记录各孔颜色,蓝色表示菌株无生长,红色表示有菌生长,MIC表示由蓝色变为红色的的最低药物浓度。
十、耻垢分枝杆菌对溴化乙锭(ethidium bromide,EtBr)的积累实验
MmpS5-MmpL5蛋白属于RND超家族外排泵,EtBr常被用作测试药物外排泵活性的通用型底物。离心收集培养至对数生长期的3种细菌,并用PBS重悬洗涤菌体2次,调节各菌A600值为0.4,吸取198 μl重悬菌液,加入2 μl浓度为100 μg/ml的EtBr至终浓度为1 μg/ml,混匀,立即用Infinite M200多功能酶标仪检测荧光值,设置激发波长为545 nm,发射波长为590 nm,每隔5 min检测1次,共检测60 min,设置3个生物学重复。
十一、耻垢分枝杆菌ATP含量测定
取培养至对数生长期的3种细菌,用7H9培养基调节A600值为0.4,向菌液中加入终浓度为1/2 MIC(0.125 μg/ml)的Bdq,孵育24 h,离心收集等体积的3种细菌,离心后弃上清,菌沉淀加入裂解液,振荡混匀。96孔黑色培养板中加入100 μl裂解菌液和100 μl稀释后的ATP检测液,酶标仪测定相对光单位(relative light unit,RLU)值,根据标准曲线及测定的RLU值计算出各菌液中的ATP含量。
十二、统计学处理
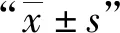
结 果
一、带有组氨酸标签的乙酰胺诱导型载体pMV261s的构建
通过改造pMV261穿梭载体,添加乙酰胺酶启动子基因(pACE),并添加组氨酸标签便于重组蛋白的验证及纯化,建立带有组氨酸标签的乙酰胺可诱导型表达载体pMV261s。对耻垢分枝杆菌乙酰胺酶启动子基因进行PCR扩增,片段长度为2618 bp(图1),连接pLB克隆载体成pLB-pACE,KpnⅠ及BamHⅠ双酶切后目的条带大小正确(图2),在乙酰胺酶启动子基因上有HindⅢ酶切位点,在含组氨酸标签的序列上有EcoRⅠ酶切位点,双酶切后片段长度为1584 bp(图3)。由此证明组氨酸标签连接成功,同时测序验证正确,pMV261s载体构建成功。

注 泳道M为DL 5000 DNA Marker;图1中泳道1和2均为pACE基因;图2中泳道1为pLB-pACE载体单酶切,泳道2和3均为pLB-pACE载体双酶切验证;图3中泳道1为pMV261s载体单酶切,泳道2和3均为pMV261s载体双酶切验证图1~3 带有组氨酸标签的乙酰胺诱导型pMV261s载体的构建

注 泳道M为DL 5000 DNA Marker;图4中泳道1和2均为mmpL5基因;泳道3和4均为mmpS5-mmpL5基因。图5中泳道1为pMV261s-mmpL5载体单酶切;泳道2为pMV261s-mmpL5载体双酶切。图6中泳道1为pMV261s-mmpS5-mmpL5单酶切;泳道2为pMV261s-mmpS5-mmpL5双酶切图4~6 目的基因与pMV261s载体的连接与验证
二、pMV261s-mmpL5和pMV261s-mmpS5-mmpL5表达载体的构建
PCR方法扩增MTB的mmpL5及mmpS5-mmpL5基因,mmpL5片段长度为2895 bp,mmpS5-mmpL5片段长度为3320 bp,目的基因条带大小正确(图4),EcoRⅠ和HpaⅠ双酶切目的基因及pMV261s表达载体,双酶切条带大小正确(图5,6),测序结果无突变。
三、MmpS5-MmpL5及MmpL5蛋白在耻垢分枝杆菌中的表达

注 泳道1为pMV261s-mmpS5-mmpL5重组菌株;泳道2为pMV261s-mmpL5重组菌株;泳道3为pMV261s菌株;泳道M为蛋白质相对分子质量标准图7 蛋白免疫印迹分析重组耻垢分枝杆菌的MmpS5-MmpL5和MmpL5蛋白
对经乙酰胺诱导的pMV261s-mmpL5、pMV261s-mmpS5-mmpL5重组菌株及pMV261s空质粒菌株进行蛋白免疫印迹分析,MmpL5蛋白相对分子质量为104 800,MmpS5-MmpL5蛋白相对分子质量为120 100,加上6×His组氨酸标签组成的重组蛋白,在相对分子质量为110 000~130 000处出现目的条带,而空质粒菌株没有条带(图7),表明MmpL5及MmpS5-MmpL5蛋白在耻垢分枝杆菌中成功表达。
四、MmpL5和MmpS5-MmpL5蛋白的表达对耻垢分枝杆菌生长无影响
为考察MmpL5和MmpS5-MmpL5蛋白的表达是否影响耻垢分枝杆菌的生长特性,比较3种细菌的生长曲线,发现表达mmpL5及mmpS5-mmpL5基因的耻垢分枝杆菌与携带pMV261s空质粒的耻垢分枝杆菌,均在15 h之后进入对数生长期,25 h达到平台期,三者生长特性没有明显差异(图8)。

图8 不同重组的耻垢分枝杆菌的生长曲线
五、Bdq对表达MmpS5-MmpL5蛋白的耻垢分枝杆菌的敏感性降低
异烟肼对表达MmpL5及MmpS5-MmpL5蛋白的重组耻垢分枝杆菌及携带空质粒的耻垢分枝杆菌的MIC均为1 μg/ml,表明异烟肼不是MmpS5-MmpL5蛋白外排系统的底物。Bdq对表达MmpL5蛋白及带有空质粒的耻垢分枝杆菌的MIC值为0.25 μg/ml,而对表达MmpS5-MmpL5蛋白的耻垢分枝杆菌的MIC为2 μg/ml,MIC值提高了8倍。由此证明,MmpL5与MmpS5蛋白共表达才能发挥作用,且MmpS5-MmpL5蛋白的表达导致Bdq的耐药。
六、表达MmpS5-MmpL5蛋白的耻垢分枝杆菌外排能力增强
检测重组耻垢分枝杆菌对EtBr的积累,发现表达MmpL5蛋白与携带有pMV261s空质粒的耻垢分枝杆菌对EtBr的积累大致相同(△荧光强度值分别为655和642),而表达MmpS5-MmpL5蛋白的耻垢分枝杆菌对EtBr的积累(△荧光强度值为395)较MmpL5组和pMV261s空质粒组减少约40%(表1),说明MmpS5-MmpL5蛋白具有外排能力,而没有MmpS5的MmpL5蛋白不能形成外排泵。

表1 不同重组的耻垢分枝杆菌对溴化乙锭的积累影响
七、Bdq对表达MmpS5-MmpL5蛋白的耻垢分枝杆菌体内ATP含量影响较小
使用1/2 MIC浓度的Bdq作用24 h后,比较药物作用前后菌体内ATP含量的变化。Bdq作用前表达MmpL5蛋白组菌体ATP水平[(0.193±0.028) μmol/L)]、表达MmpS5-MmpL5蛋白组菌体ATP水平[(0.197±0.018) μmol/L]与携带pMV261s质粒组菌体ATP水平[(0.181±0.013) μmol/L]相比,差异无统计学意义(F=0.539,P=0.609)。Bdq作用后,表达MmpL5蛋白组菌体ATP水平[(0.056±0.009) μmol/L]与pMV261s空质粒组菌体内ATP水平[(0.055±0.008) μmol/L]相比,差异无统计学意义(F=62.914,P=0.929)。药物作用后,表达MmpS5-MmpL5蛋白的重组耻垢分枝杆菌内ATP水平[(0.125±0.010) μmol/L]降低36.49%,而表达MmpL5蛋白组菌体ATP水平降低71.21%,空质粒组菌体ATP水平降低69.49%,表达MmpS5-MmpL5蛋白组菌体ATP水平明显高于表达MmpL5蛋白组和空质粒组,差异有统计学意义(F=5.172,P=0.049)。这提示MmpS5与MmpL5蛋白作为复合体导致菌体外排Bdq能力增加,使Bdq作用于ATP合成酶的量减少,从而使菌体内ATP水平下降较少。
讨 论
外排泵能够将菌体内药物泵出,外排泵过表达使得菌体内药物浓度不能有效抑制分枝杆菌生长,是MTB耐药的重要原因之一。MmpL是分枝杆菌基因组编码的一组膜蛋白,属于外排泵RND蛋白超家族,在脂质、聚合物和免疫调节剂的运输过程中发挥重要作用[7]。笔者团队前期研究发现,Bdq和氯法齐明对Rv0678突变的MTB交叉耐药[6, 8-9],Rv0678突变导致mmpL5和mmpS5表达的上调[5, 10]。近年研究表明,MmpS5-MmpL5系统也可以转运分枝菌素[11]。MTB编码13种MmpL蛋白,其中,MmpL5蛋白(Rv0676c基因编码)由964个氨基酸组成,理论相对分子质量为104 800,由12个跨膜结构域及2个周质结构域组成[12]。附属蛋白MmpS5(Rv0677c基因编码)由142个氨基酸组成,理论相对分子质量为15 200。mmpL5在转录上与mmpS5基因相偶联,二者位于同一操纵子内,受下游的转录抑制因子Rv0678的调控[13]。Andries 等[5]在MTB中单独过表达MmpS5蛋白没有改变Bdq对其的MIC值,提示单一的MmpS5蛋白对药物外排无影响,因此,本研究中没有单独构建MmpS5蛋白。
膜蛋白的表达与纯化一直是蛋白研究的技术难题,笔者课题组前期在BL21plys大肠杆菌及C43大肠杆菌中多次尝试表达膜蛋白MmpL5蛋白都未能获得理想结果,可能是外源膜蛋白在大肠杆菌中的毒性、错误折叠、聚集等导致表达量低。MTB的MmpL5与耻垢分枝杆菌同源MSMEG_1382的序列相似性为62.96%,表明MmpL5蛋白表达相应的条件在耻垢分枝杆菌可能具备。耻垢分枝杆菌无传染性和致病性,生长较快、操作较为容易[14]。这些特点都是耻垢分枝杆菌作为表达宿主菌的优势。乙酰胺酶启动子是一种强启动子,在耻垢分枝杆菌中受到严谨调控, 诱导后高水平表达[14]。Zhang等[15]利用乙酰胺酶启动子构建了MmpL3表达载体,成功实现了在耻垢分枝杆菌中表达和纯化。本研究通过改造pMV261穿梭载体,建立了带有组氨酸标签的乙酰胺诱导型表达载体pMV261s-mmpL5和pMV261s-mmpS5-mmpL5,蛋白免疫印迹验证了蛋白在耻垢分枝杆菌的成功表达。
本研究通过Bdq对3种重组菌株的药物敏感性试验发现,共表达MmpS5-MmpL5蛋白的耻垢分枝杆菌会降低Bdq对其的活性,而仅表达MmpL5蛋白的重组耻垢分枝杆菌对Bdq的药物敏感性无影响。这与Yamamoto 等[16]发现MmpS5促使MmpL5蛋白单聚体组装成三聚体发挥功能的结果一致。EtBr是一种荧光染料,是多数外排泵的转运底物,通常被用作测试药物外排泵活性的通用型底物[17]。重组耻垢分枝杆菌对EtBr的积累实验表明,MmpS5-MmpL5蛋白表达比MmpL5蛋白单独表达和空质粒组对EtBr的积累量较少,其外排能力增加。单独MmpL5蛋白表达与空质粒相比没有差异,进一步说明MmpS5和MmpL5蛋白共表达形成外排泵,发挥生物学功能。贝达喹啉的作用靶点是ATP合成酶,进而导致菌体内的ATP合成减少而发挥抗菌作用。为了考察Bdq通过MmpS5-MmpL5蛋白外排影响菌体内ATP水平,笔者在1/2 MIC浓度的Bdq作用下,发现共表达MmpS5-MmpL5蛋白的耻垢分枝杆菌菌体内ATP含量较表达MmpL5蛋白和携带空质粒组变化小。结合MmpS5-MmpL5蛋白共表达导致的外排能力增强,表明MmpS5-MmpL5蛋白外排系统以Bdq为底物,通过增加Bdq的外排量使菌体内Bdq的含量降低,进而使Bdq抑制靶点ATP合成酶的量减少,导致菌体内ATP水平的变化较少。
综上所述,笔者构建了MTB的膜蛋白MmpL5及外排泵MmpS5-MmpL5在耻垢分枝杆菌中的表达体系。功能实验也表明了MmpS5-MmpL5蛋白共表达形成外排泵发挥作用,降低Bdq的药物敏感性。本研究深化了对Bdq耐药机制的理解,而膜蛋白表达体系的建立为蛋白的纯化和进一步研究Bdq的转运机制奠定了基础。
——一道江苏高考题的奥秘解读和拓展

