基于TaqMan MGB探针的可可花瘿病菌快速检测方法
吕 燕, 郭立新, 段维军*
(1. 宁波检验检疫科学技术研究院, 宁波 315012; 2. 宁波中盛产品检测有限公司, 宁波 315012;3. 宁波海关, 宁波 315012)
可可花瘿病菌Albonectriarigidiuscula(Berk. & Broome) Rossman & Samuels属真菌界Fungi子囊菌门Ascomycota粪壳菌纲Sordariomycetes肉座菌目Hypocreales丛赤壳科Nectriaceae白壳属Albonectria,其无性阶段也被称作多隔镰刀菌FusariumdecemcellulareBrick。目前,该病菌主要分布在亚洲的印度、印度尼西亚、伊朗、马来西亚、菲律宾、斯里兰卡;非洲的喀麦隆、中非、刚果、科特迪瓦、加纳、马达加斯加、尼日利亚、塞拉利昂;北美洲的伯利兹、哥斯达黎加、古巴、多米尼克、多米尼加、格林纳达、危地马拉、洪都拉斯、牙买加、墨西哥、尼加拉瓜、巴拿马、波多黎各(美)、特立尼达和多巴哥、美国;大洋洲的美属萨摩亚、法属波利尼西亚、密克罗尼西亚、新喀里多尼亚(法)、巴布亚新几内亚;南美洲的阿根廷、巴西、哥伦比亚、厄瓜多尔、圭亚那、秘鲁、苏里南、委内瑞拉;我国局部地区有发生危害报道[1-2]。可可花瘿病菌寄主范围十分广泛,包括可可Theobromacacao、芒果Mangiferaindica、毛叶枣Ziziphusmauritiana、罗汉松Podocarpusmacrophyllus、番荔枝Annonasquamosa、腰果树Anacardiumoccidentale、中粒咖啡Coffeacanephora等多种植物[1-9]。可可花瘿病菌可造成多种病害,如在印度该病菌危害可可,严重时造成可可绝收[9],在多米尼加该病菌能造成芒果树癌肿,发病率可达到10%~50%[4],在我国四川省攀枝花市该病菌危害芒果树,造成3个芒果园内树木枯死[10]。该病菌也是《中华人民共和国进境植物检疫性有害生物名录》中的一种检疫性真菌[11]。
目前,口岸植物检疫对可可花瘿病菌的检疫鉴定主要是按照出入境检验检疫行业标准《可可花瘿病菌检疫鉴定方法》(SN/T 3284-2012)进行[1],即通过对病健交界处进行组织分离培养,观察病原菌形态及培养性状,并将病菌接种到寄主植物观察致病性,整个过程费时费力,且难以区分近似种,无法满足口岸快速检测通关需要。随着分子生物学技术的发展,国内外已有大量应用实时荧光PCR技术检测植物病原真菌的报道[12-15],为准确、快速检测病原菌提供了重要参考。但是关于可可花瘿病菌的分子检测技术研究相对较少,段维军等[8]通过rDNA ITS、28S、EF1α和TUB基因序列比对分析,发现可可花瘿病菌及其近似种的ITS、28S序列差异较小,难以有效区分,而EF1α和TUB序列能够进一步对该病菌进行有效划分。迄今,尚未有利用TaqMan 实时荧光PCR方法对可可花瘿病菌进行检测的报道。本研究中,我们对可可花瘿病菌及其近似种的EF1α基因序列进行了比较分析,设计了1对特异性引物和1条探针,建立了可可花瘿病菌实时荧光PCR检测方法,以期为口岸检疫和该病菌防控提供参考。
1 材料与方法
1.1 菌株
本研究所用菌株共计34株,包括7株可可花瘿病菌,其中5株由本实验室从日本进境罗汉松上分离鉴定获得[8],2株来源于福州海关技术中心实验室,以及一些其他种属植物真菌27株(表1)。以上菌株均保存于盛有无菌水的冻存管中(4℃)备用。
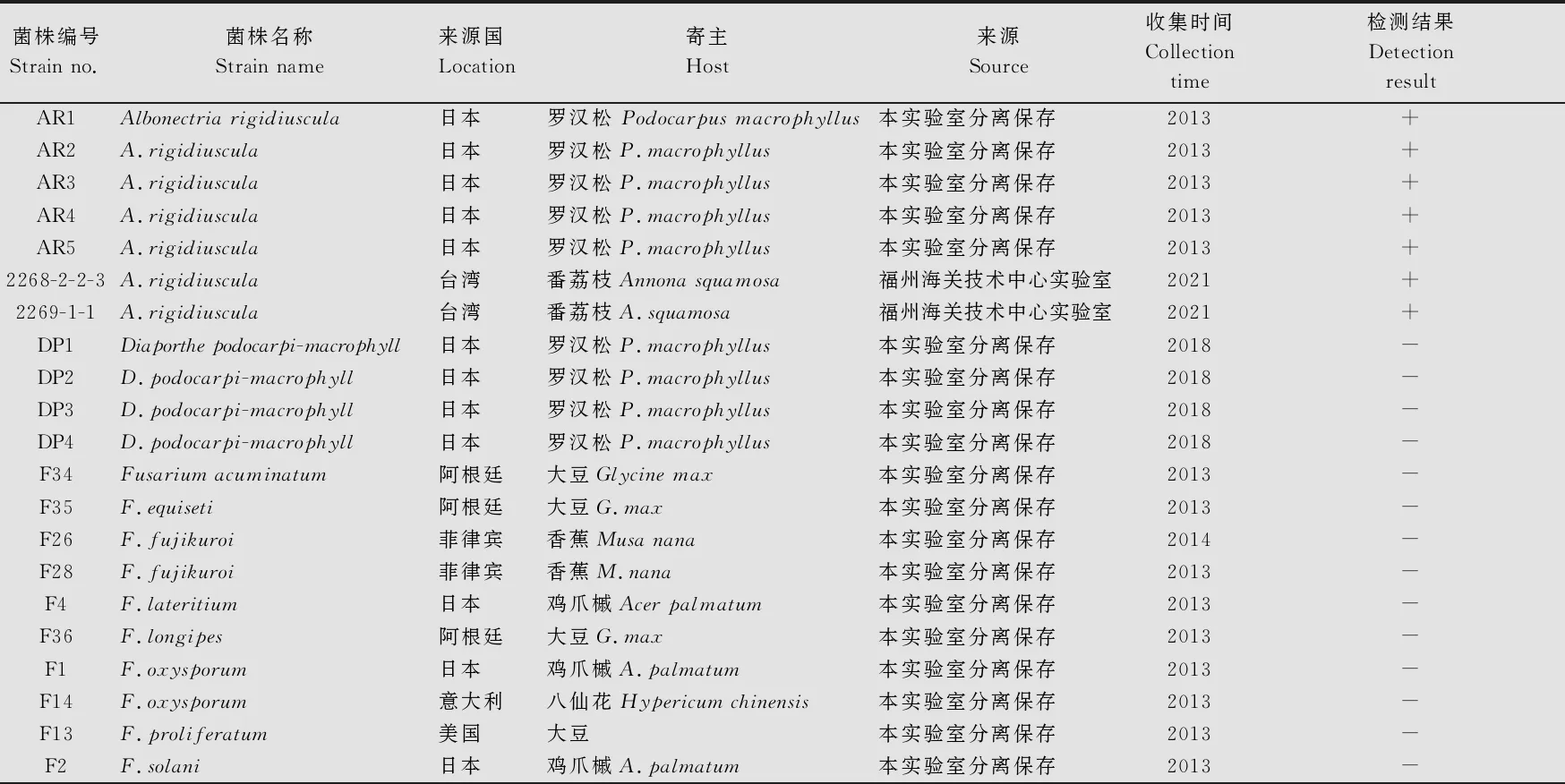
表1 供试菌株信息1)

续表1 Table 1(Continued)
1.2 试剂和仪器
TaqMan®Universal PCR Master Mix 购自英潍捷基(上海)贸易有限公司、TANbead®Plant DNA Auto Kit购自台湾奈米技术开发有限公司、全自动核酸提取仪Kingfisher mL(美国Thermo Fisher)、实时荧光PCR仪ABI Prism 7900(美国ABI)、超微量分光光度计NanoDrop 2000C(美国Thermo Fisher)、生化培养箱Friocell 222(德国3M公司)。
1.3 DNA提取
用灭菌枪头刮取在PDA平板上培养2周左右的菌丝,按照TANBead®Plant DNA Auto Kit说明书提取DNA,DNA经过浓度检测后保存于-20℃冰箱备用。
1.4 引物和探针的设计与合成
根据GenBank公布的可可花瘿病菌EF1α基因(登录号:KJ648617)的保守区域,利用BioEdit软件进行序列比对分析,应用软件 Primer Express 3.0设计正向引物NR-F(5′-GAGCGACGTTGGCACAATG-3′),反向引物NR-R(5′-GGTTCGGAACACGTGACGAT-3′),探针NR-P(5′-CCTGGCCCCTGCAC-3′),扩增目的片段大小为 78 bp(图1)。探针5′端标记FAM荧光报告基团,3′端标记非荧光猝灭基团和MGB。上述引物和探针由英潍捷基(上海)贸易有限公司合成。

图1 可可花瘿病菌及其近似种EF1α序列比对Fig.1 EF1α sequence comparison among Albonectria rigidiuscula and closely related species
1.5 特异性试验
以表1中供试菌株DNA为模板,无菌水为空白对照,进行实时荧光PCR反应,在20 μL反应体系中加入10 μL 2×TaqMan®Universal PCR Master Mix,0.5 μL引物NR-F(10 μmol/L),0.5 μL引物NR-R(10 μmol/L),0.5 μL探针NR-P(10 μmol/L),1 μL DNA,ddH2O补足至20 μL。反应条件为:50℃ 2 min;95℃ 10 min;然后95℃ 15 s,60℃ 1 min,共40个循环。
1.6 实时荧光PCR反应体系的优化
1.6.1引物浓度优化
以AR1 菌株DNA为模板,参照1.5中反应体系,其他成分保持不变,将NR-F/NR-R正反向引物浓度设置为0.1 μmol/L至1.0 μmol/L,以0.1 μmol/L递增。
1.6.2探针浓度优化
以AR1 菌株DNA为模板,参照1.5中反应体系,其他成分保持不变,选用1.6.1中优化后的NR-F/NR-R引物浓度,将NR-P探针浓度设置为0.1 μmol/L 至1.0 μmol/L,以0.1 μmol/L递增。
1.7 灵敏度试验
为确定可可花瘿病菌实时荧光PCR的检测限度,将AR1 菌株的DNA用无菌水进行10倍梯度稀释,共7个梯度,每个梯度做3次重复。在20 μL反应体系中,DNA含量分别为0.01 pg、0.1 pg、1 pg、10 pg、100 pg、1 ng、10 ng,利用优化后的反应体系进行实时荧光PCR反应,测定灵敏度并建立标准曲线。
1.8 重复性试验
以AR1 菌株DNA为模板进行重复性试验,在同一个试验中,每个浓度重复3次,分析组内差异;在不同时间段进行3次独立试验,进行组间差异分析。根据获得的Ct值计算平均Ct值、标准偏差(standard deviation, SD)和变异系数(coefficient of variation, CV),来评价该方法的重复性。
1.9 接种试验及接种样品的检测
选用健康的罗汉松幼苗,参照段维军等[8]的方法进行接种试验。取PDA平板上培养好的AR1菌株的菌丝块接种到幼苗伤口上,共接种3个幼芽,分别编号为S1、S2、S3,作为试验组;取无菌的PDA培养基块接种1个幼芽,编号为S0,作为对照组。接种后的幼苗在25℃条件下进行隔离培养,2周后提取试验组和对照组幼芽处DNA进行检测,以AR1菌株DNA为阳性对照,DP1菌株DNA为阴性对照,H2O为空白对照。
2 结果与分析
2.1 特异性分析
对表1所列34个供试菌株进行实时荧光PCR检测,结果显示,7株可可花瘿病菌均为阳性,有明显的扩增曲线生成,而其他27个供试菌株均为阴性,表明本研究设计的NR-F/NR-R引物和NR-P探针具有较强的特异性(图2)。

图2 可可花瘿病菌实时荧光PCR的特异性扩增试验Fig.2 Specific amplification of the real-time fluorescence PCR assay for Albonectria rigidiuscula
2.2 实时荧光PCR反应体系优化
2.2.1引物浓度优化
由图3可知,当引物浓度为0.2 μmol/L时,ΔRn值最大、Ct值最小。经过3次重复试验后,最终确定0.2 μmol/L为最佳引物浓度。

图3 NR-F/NR-R引物浓度的优化Fig.3 Optimization of NR-F/NR-R primer concentration
2.2.2探针浓度优化
由图4可知,当探针浓度为0.6 μmol/L时,ΔRn值最大、Ct值最小。经过3次重复试验后,最终确定0.6 μmol/L为最佳探针浓度。
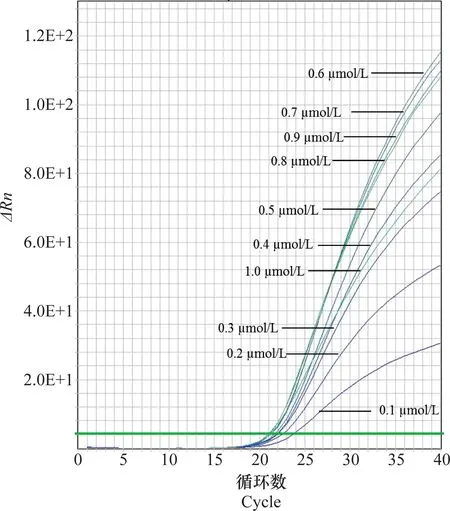
图4 NR-R探针浓度的优化Fig.4 Optimization of NR-R probe concentration
2.2.3优化后的反应体系
通过引物浓度和探针浓度优化试验,确定实时荧光PCR的最佳反应体系,即20 μL反应体系中加入10 μL 2×TaqMan®Universal PCR Master Mix,0.4 μL NR-F引物(10 μmol/L),0.4 μL NR-R引物(10 μmol/L),1.2 μL NR-P探针(10 μmol/L),1 μL DNA,ddH2O补足至20 μL。
2.3 灵敏度试验及标准曲线的构建
对不同浓度DNA进行实时荧光PCR检测,结果显示当可可花瘿病菌DNA含量为1 pg时,3次重复试验中只有一条扩增曲线,且荧光信号很弱,Ct值大于36;而DNA含量为10 pg时,有明显的扩增曲线,说明本研究所建立的可可花瘿病菌实时荧光PCR方法的最低检测限是10 pg(图5)。
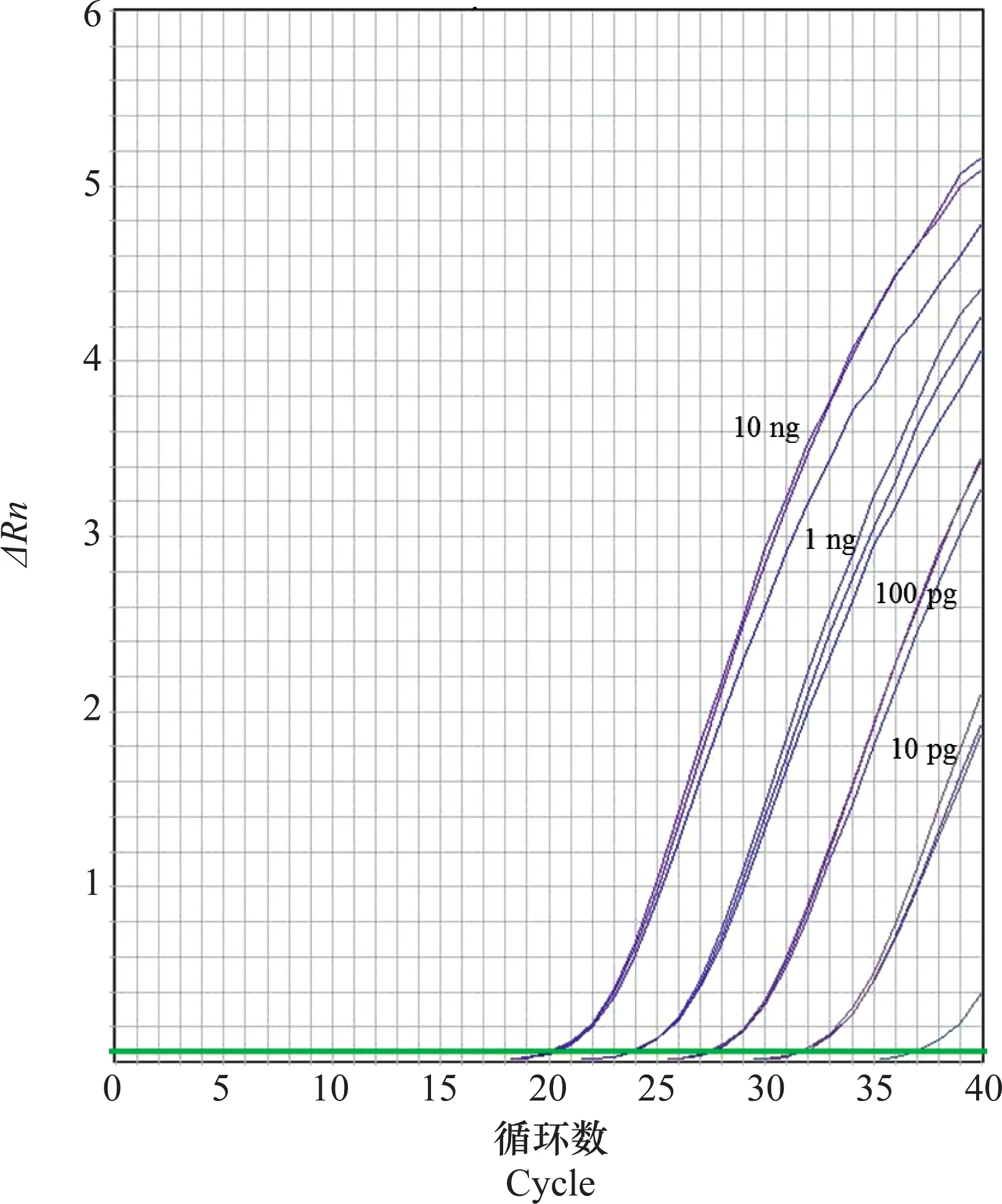
图5 可可花瘿病菌实时荧光PCR的灵敏度检测Fig.5 Relative sensitivity of the real-time fluorescence PCR assays for Albonectria rigidiuscula
通过对已知浓度的DNA进行实时荧光PCR检测发现,DNA含量越高,Ct值越小,即DNA含量与可检测到的荧光信号的循环数呈负相关,标准曲线y=-3.99x+23.97(R2=0.993 4)(图6)。

图6 可可花瘿病菌实时荧光PCR检测的标准曲线Fig.6 Standard curve of the real-time fluorescence PCR assays for Albonectria rigidiuscula
2.4 重复性分析
以AR1菌株4个浓度的DNA(0.01、0.1、1、10 ng)进行3次组内及3次组间重复测定。从表2可知,组内重复CV值在0.35%~0.83%之间,组间重复CV值在0.21%~0.90%之间,二者的CV值均小于1%,说明本研究所建立的可可花瘿病菌TaqMan MGB荧光PCR检测方法的重复性和稳定性良好。
2.5 接种样品检测结果
对试验组和对照组样品DNA进行实时荧光PCR检测,结果显示试验组样品S1、S2、S3 及阳性对照AR1的DNA扩增后有明显的扩增曲线生成,而对照组样品S0、阴性对照DP1及空白对照H2O均无扩增(图7)。以上结果表明该方法能快速、准确检出可可花瘿病菌。
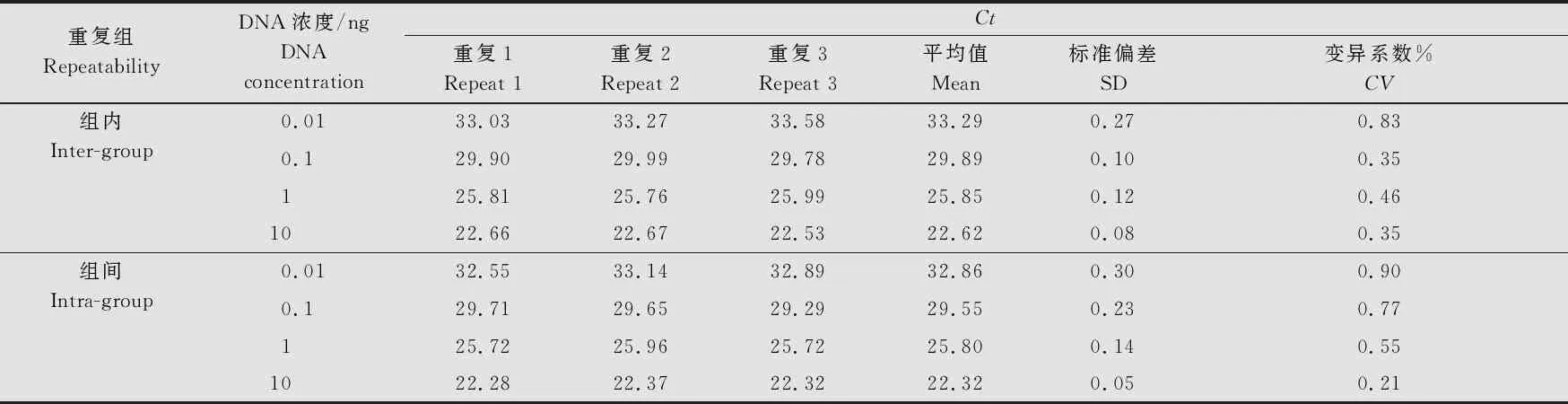
表2 可可花瘿病菌实时荧光PCR的重复性试验
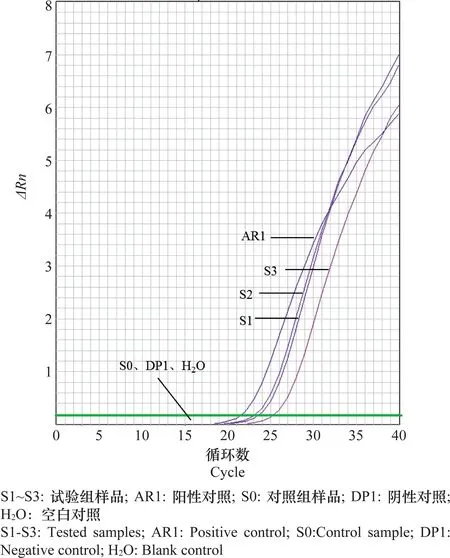
图7 接种样品的可可花瘿病菌实时荧光PCR检测结果Fig.7 Detection of Albonectria rigidiuscula by real-time fluorescence PCR assays from inoculated samples
3 讨论
可可花瘿病菌是一种重要的检疫性真菌,该病菌寄主种类较多,能够引起植物花序枯萎和维管束坏死,在花芽、茎基和枝条等侵染部位可形成癌肿,造成植物萎蔫、畸形或顶枯[5, 7, 16]。种苗、水果、粮谷等植物产品是植物病害远距离传播的重要载体,是病害初次侵染的重要来源。目前,全球范围内由可可花瘿病菌在不同地理区域不同寄主上造成的植物病害种类在不断增加,为避免该病菌在我国传播扩散,亟须建立特异、准确的检测方法,以满足口岸快速检测的需求,防止携带该病菌的植物产品的传入。
目前,我国口岸已多次截获可可花瘿病菌,2013年宁波口岸首次从日本进境罗汉松种苗上截获该病菌[8];2017年重庆口岸从越南的番荔枝上截获该病菌;2021年福建口岸从台湾的番荔枝上也截获该病菌[17]。其截获率不高的原因可能在于传统分离培养方法检测效率较低、灵敏度不够等。国内外现有关于可可花瘿病菌的研究主要集中在新病害发现报道、检疫鉴定和防控等方面[5-7, 10, 16, 18],但未有该病菌的快速检测技术研究的相关报道。结合早期研究我们发现,EF1α基因序列能够准确鉴定可可花瘿病菌[5, 8, 10, 19]。本研究在收集了可可花瘿病菌及其近似种的基础上,根据它们的EF1α序列差异设计特异性引物和探针,建立了该病菌的实时荧光PCR检测方法。研究结果表明,该方法能有效地扩增可可花瘿病菌目的基因(EF1α)片段,具有良好的特异性、重复性和稳定性;同时该方法具有实用性,可用于疑似携带可可花瘿病菌样品的检测与初筛。另外,根据灵敏度试验结果,确定了在20 μL反应体系中,该方法能够检测到可可花瘿病菌的最低DNA含量为10 pg。段丽君等[20]建立了杜鹃花枯萎病菌的实时荧光PCR检测方法,10 μL反应体系中能够检出该病菌的最低DNA含量为0.25 pg;段维军等[21]建立了向日葵黑茎病菌的实时荧光PCR检测方法,20 μL反应体系中能够检出该病菌的最低DNA含量为0.1 pg,以上2种检测方法的灵敏度均较高,原因在于它们的特异性引物和探针是根据ITS基因序列设计的,而ITS基因在整个基因组DNA中串联重复,含量较高。本文建立的检测方法灵敏度相对较低,可能原因是EF1α基因在基因组中含量较低所致。尽管本文所建立的可可花瘿病菌实时荧光PCR检测方法灵敏度较低,但在实际检测工作中可满足使用需求。可可花瘿病菌已在口岸多次检出[8, 17],该方法能够解决可可花瘿病菌以往检测方法中存在的不足之处,缩短检测周期,建议尽快修订《可可花瘿病菌检疫鉴定方法》(SN/T 3284-2012)标准,增加分子生物学检测方法,以提高该病菌检出率。

