皮质抑素通过p38 MAPK信号通路抑制急性心肌梗死后心力衰竭大鼠氧化应激及心肌细胞凋亡
顾 峥,王顾浩,刘 恋
目前,世界范围内心力衰竭(heart failure,HF)病人已超过2300万例,其发病率仍在持续上升。虽然近30年来心力衰竭的治疗取得了很大进步,但心力衰竭病人5年死亡率仍高达50%[1]。心力衰竭的一个常见原因是急性心肌梗死(acuate myocardial infarction,AMI)。AMI通常预示着心功能不全的开始,由于心肌损伤、反复缺血、心肌顿抑和冬眠、心室重塑和慢性神经内分泌刺激等原因,AMI最终可能发展为心力衰竭[2]。据统计,急性心肌梗死住院病人的心力衰竭发病率介于14%~36%[3]。因此,开发关于心力衰竭新的治疗药物对于改善急性心肌梗死后心力衰竭(post-acuate myocardial infarction heart failure,HF-AMI)疾病现状有重要意义。皮质抑素(cortistatin,CST)是一种含有FWKT (Phe-Trp-Lys-Thr)四聚体的小分子生物活性肽,广泛分布于神经、免疫和内分泌系统。皮质抑素及其受体也广泛分布于心血管系统,如主动脉、冠状动脉和心脏。许多研究表明,皮质抑素具有调节睡眠、学习记忆、诱导免疫耐受、抑制炎症反应、调节内分泌代谢等多种生物学效应[4]。近年来,越来越多的研究表明皮质抑素在心血管疾病的发生发展中起着重要作用,如皮质抑素通过阻断细胞外调节蛋白激酶(ERK)1/2信号通路抑制腹主动脉瘤小鼠巨噬细胞浸润,抑制细胞凋亡,从而抑制腹主动脉瘤的产生[5]; 皮质抑素可减少颈动脉、心脏、主动脉弓和主动脉中动脉粥样硬化斑块的数量和大小,抑制Th1/Th17诱导的炎症反应,从而抑制小鼠动脉粥样硬化[6]。此外,已有研究表明,伊伐布雷定通过抑制p38丝裂原活化蛋白激酶(p38 MAPK)信号通路介导的炎症反应和心肌细胞凋亡,改善糖尿病心肌病小鼠心功能障碍[7]。目前,关于皮质抑素对HF-AMI的作用机制尚不明确。因此,本研究旨在探究皮质抑素对HF-AMI后心脏的保护作用,并明确其心脏保护机制是否与p38 MAPK信号通路和心肌细胞凋亡有关。
1 材料与方法
1.1 主要材料与仪器 40只雄性清洁级Sprague-Dawley(SD)大鼠,体质量为220~250 g,购自苏州大学实验动物中心;大鼠皮质抑素-14肽购自美国Phoenix Pharmaceuticals Inc公司;总超氧化物歧化酶(T-SOD)测试盒(羟胺法)、活性氧(ROS)测定试剂盒和丙二醛(MDA)测定试剂盒(TBA法)购自南京建成生物工程研究所;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)凋亡检测试剂盒购自德国Roche;二喹啉甲酸(BCA)试剂盒购自北京普利莱基因技术有限公司;B淋巴细胞瘤-2(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体、3-磷酸甘油醛脱氢酶(GAPDH)抗体和辣根过氧化物酶(HRP)标记二抗购自英国Abcam公司;磷酸化丝裂原活化蛋白激酶激酶-6(p-MKK6)抗体、丝裂原活化蛋白激酶激酶-6(MKK6)抗体、磷酸化p38 MAPK(p-p38 MAPK)抗体购自美国Cell Signaling Technology;二维M型和B型超声诊断仪购自加拿大Visual Sonics;PowerLab ML880系统购自澳大利亚AD公司;荧光酶标仪购自美国Biotek。
1.2 HF-AMI动物模型制备[8]及给药处理 40只SD大鼠饲养于标准动物房,提供充足的饮水及饲料,待大鼠适应环境1周后,将大鼠随机分为假手术组、模型组、皮质抑素高剂量组(CST-H组)和皮质抑素低剂量组(CST-L组),每组10只。1%戊巴比妥钠麻醉大鼠,剂量为50 mg/kg,仰卧位,气管插管,连接呼吸机、麻醉剂及心电监护仪。模型组、CST-H组和CST-L组大鼠无创性结扎冠状动脉左前降支,随后可见结扎线下方心肌颜色发白、心电图出现ST-T及Q波,此时HF-AMI动物模型建立成功。假手术组大鼠进行穿线,但不结扎。CST-H组和CST-L组大鼠腹膜内分别注射皮质抑素175.0 mg/(kg·d)和87.5 mg/(kg·d) ,假手术组和模型组大鼠腹膜内注射等量生理盐水,持续给药1周。
1.3 超声心动图 1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,通过二维M型和B型超声心动图评估左心室功能,监测左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室舒张末期容积(LVEDV)、左室收缩末期容积(LVESV)、射血分数(EF)、收缩分数(FS)。
1.4 血流动力学测量 超声心动图检查后,进行血流动力学测量以评估左心室(LV)功能。 使用PowerLab ML880系统记录平均血压(MBP)、左心室压力的最大升高速率(+dp/dtmax)和左室压力的最大降低速率(-dp/dtmax)。
1.5 苏木素-伊红(HE) 染色 戊巴比妥钠麻醉大鼠后,取出心脏,用4%多聚甲醛固定左心室组织72 h,梯度乙醇脱水,二甲苯透明。石蜡包埋、切片。石蜡切片常规二甲苯、乙醇脱蜡至水,苏木素染色10 min,0.7%盐酸乙醇分化数秒,流水洗涤后,伊红液浸染3 min。梯度乙醇脱水,二甲苯透明,中性树胶封片。切片于光学显微镜下观察分析。
1.6 ROS、超氧化物歧化酶(SOD)和MDA检测 ROS检测:大鼠持续给药1周后,取出心脏。剪碎心脏后,0.25%胰酶消化心脏组织,1 000 r/min离心5 min,弃上清。含20%胎牛血清(FBS)的DMEM终止消化,1 000 r/min离心5 min,弃上清,加入新鲜含20%FBS的DMEM,静置10 min后,离心弃上清。含20%FBS的DMEM重悬细胞,过100目筛网,离心弃上清。2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)重悬细胞,调整细胞密度至5×106个/mL。根据ROS测定试剂盒说明书检测组织ROS含量。
SOD和MDA的检测:大鼠持续给药1周后,收集大鼠腹主动脉血液样本,3 000 r/min离心10 min,收集血清,根据T-SOD测试盒和MDA测定试剂盒说明书,检测大鼠血清中SOD和MDA含量。
1.7 TUNEL染色 按照方法1.5进行心脏取材及石蜡切片制备。心肌石蜡切片常规脱蜡至水,磷酸盐缓冲液(PBS)漂洗后,3%过氧化氢(H2O2)浸洗10 min,加入蛋白酶K工作液,37 ℃反应20 min,PBS漂洗后,滴加TUNEL反应混合液,湿盒中37 ℃孵育1 h。PBS漂洗,加入转化剂,湿盒中37 ℃孵育20 min。PBS漂洗,3,3′-二氨基联苯胺(DAB)显色。中性树胶封片。切片于光学显微镜下进行观察分析。
1.8 蛋白质印迹(Western Blot)法 戊巴比妥钠麻醉大鼠后,取出心脏,把心脏组织剪切成细小的碎片,RIPA裂解液裂解组织,离心取上清,BCA法测定蛋白浓度。取20 μg蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,随后转至聚偏氟乙烯(PVDF)膜上。10%脱脂奶粉封闭,随后加入Bcl-2(1∶2 000)抗体、Bax(1∶2 000)抗体、p-MKK6(1∶5 000)抗体、MKK6(1∶3 000)抗体、p-p38 MAPK(1∶2 500)抗体、p38 MAPK(1∶2 500)抗体和3-磷酸甘油醛脱氢酶(GAPDH)(1∶5 000)抗体,4 ℃条件下过夜孵育。加入辣根过氧化物酶(HRP)标记二抗(1∶5 000稀释)室温孵育1 h后,滴加BeyoECL Star工作液到膜上,化学发光成像仪检测。

2 结 果
2.1 皮质抑素对HF-AMI大鼠心功能及血流动力学的影响 超声心动图检测各组大鼠心功能,结果见图1A。与假手术组相比,模型组大鼠LVEDD和LVESD明显升高(P<0.05),EF和FS明显降低(P<0.05),MBP、+dp/dtmax和-dp/dtmax值明显降低(P<0.05);与模型组相比,CST-H组和CST-L组大鼠LVESD明显降低(P<0.05),EF和FS明显升高(P<0.05),MBP、+dp/dtmax和-dp/dtmax值明显升高(P<0.05),其中CST-H组大鼠变化更为显著。详见图1B、图1C。
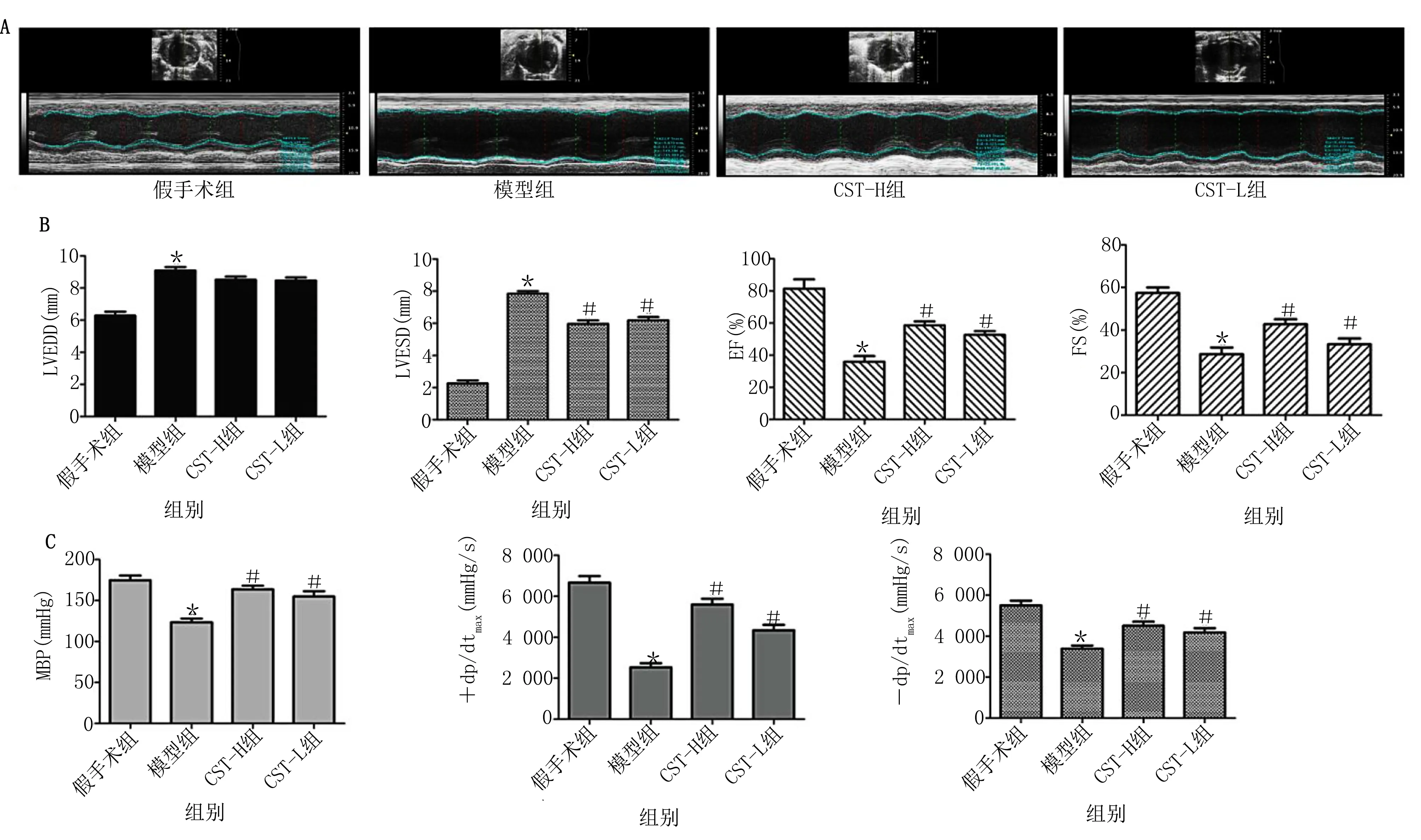
注:1 mmHg=0.133 kPa;与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
2.2 皮质抑素对HF-AMI大鼠心肌病理组织学变化的影响 HE染色结果显示,假手术组大鼠心肌排列整齐,无明显炎性细胞浸润,模型组大鼠心肌排列紊乱,心肌组织大面积坏死并伴有炎性细胞浸润;与模型组相比,CST-H组和CST-L组大鼠心肌排列趋于整齐,其中CST-H组大鼠变化更明显。详见图2。
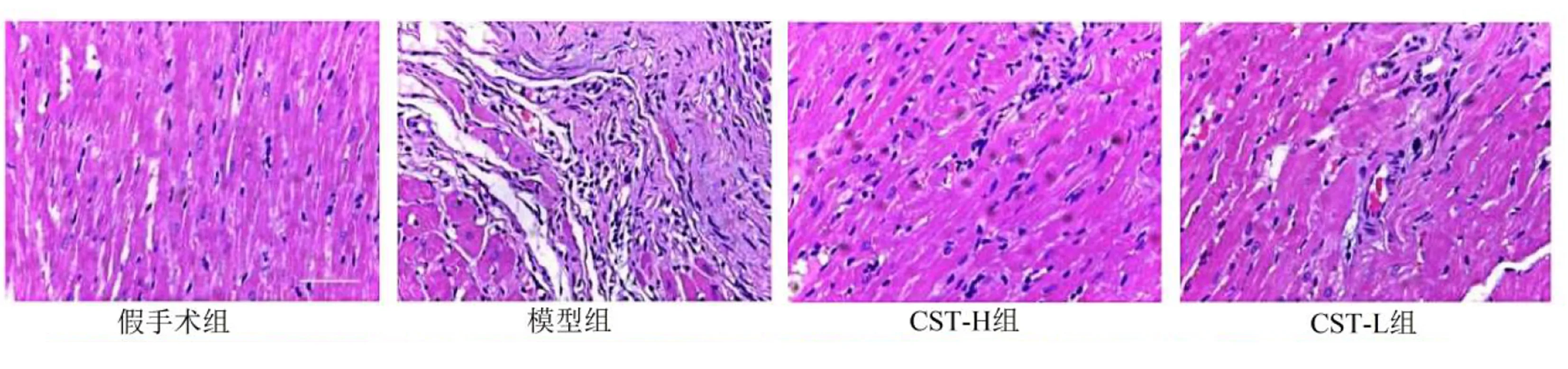
图2 各组HF-AMI大鼠心肌病理组织学变化(×400)
2.3 皮质抑素对HF-AMI大鼠ROS、SOD和MDA水平的影响 ELISA检测结果显示,与假手术组相比,模型组大鼠MDA和ROS含量明显升高(P<0.05),SOD含量明显降低(P<0.05);与模型组相比,CST-H组和CST-L组MDA和ROS含量明显降低(P<0.05),SOD含量明显升高(P<0.05),其中,CST-H组变化更明显。详见图3。
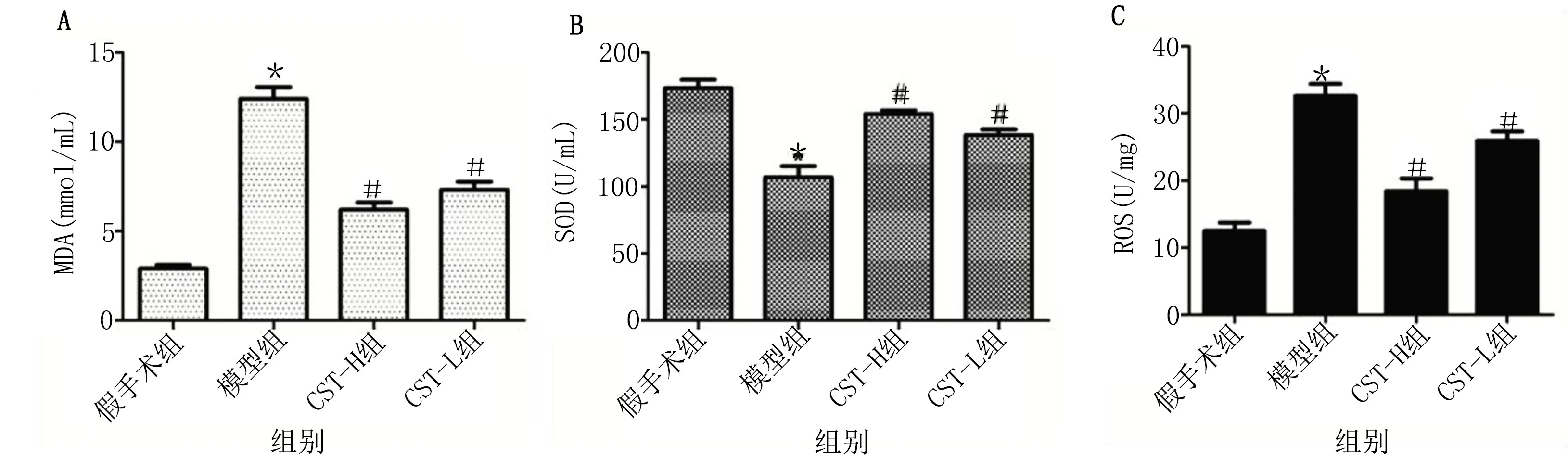
与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
2.4 皮质抑素抑制HF-AMI大鼠心肌细胞凋亡 TUNEL染色和Western Blot实验结果显示,与假手术组相比,模型组大鼠心肌细胞凋亡率和Bax蛋白表达明显升高(P<0.05),Bcl-2表达明显降低(P<0.05);与模型组相比,CST-H组和CST-L组大鼠心肌细胞凋亡率和Bax蛋白表达明显降低(P<0.05),Bcl-2表达明显升高(P<0.05),其中CST-H组大鼠变化更明显。详见图4。
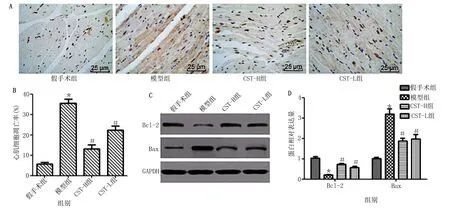
与假手术组比较,* P<0.05;与模型组比较,# P<0.05。
2.5 皮质抑素可抑制HF-AMI大鼠p38 MAPK通路 Western Blot结果显示,与假手术组相比,模型组大鼠p-MKK6/MKK6和p-p38 MAPK/p38 MAPK表达明显升高(P<0.05);与模型组相比,CST-H组和CST-L组大鼠p-MKK6/MKK6和p-p38 MAPK/p38 MAPK表达明显降低(P<0.05),其中CST-H组变化更明显。详见图5。
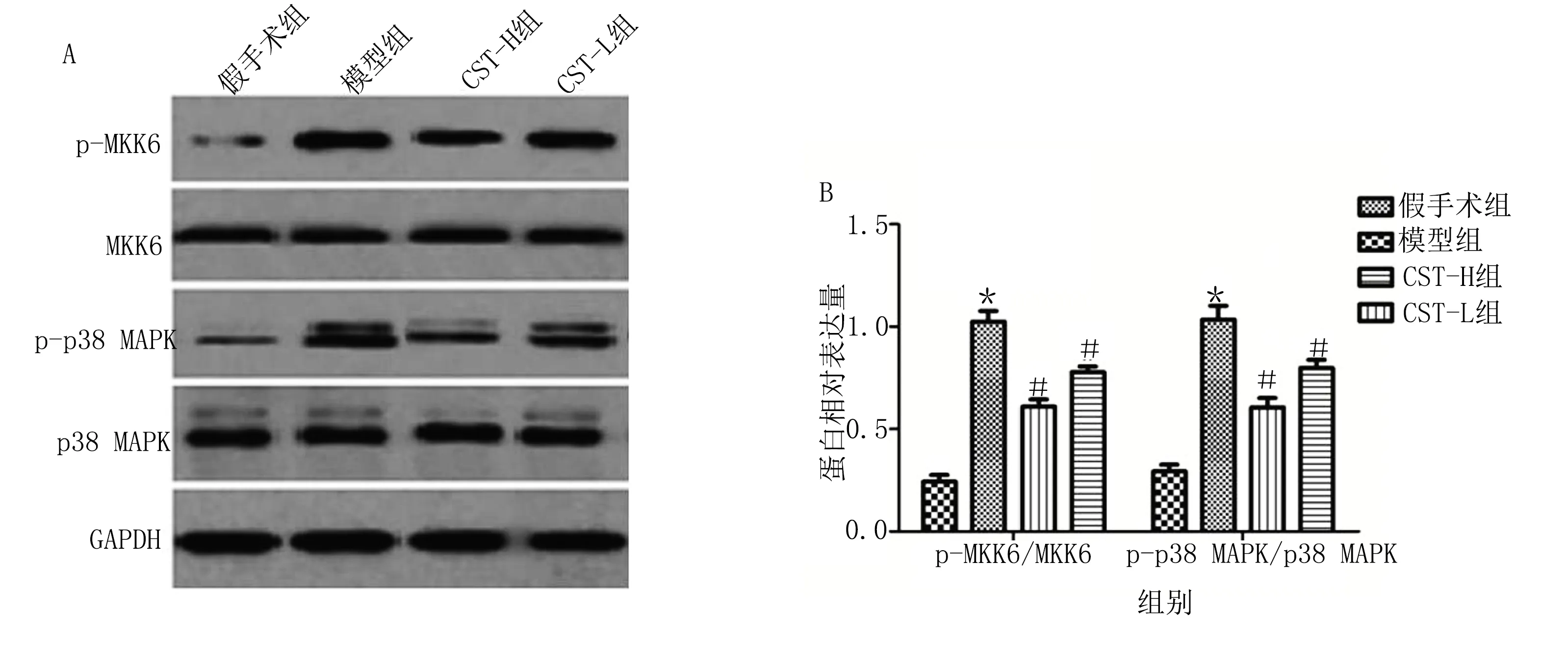
与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨 论
HF-AMI是一种全身性疾病。挪威心血管病项目的数据显示,2001年—2009年共有86 771例首次AMI病人,其中18.7%的病人在住院期间出现或发生心力衰竭,心力衰竭的发生率随年龄增长而增加[9]。研究表明,细胞凋亡在AMI后的心功能不全和结构改变中起重要作用,并参与左室重构和心功能不全的发展过程,直至出现症状性心力衰竭[10]。因此,抗凋亡被认为是一种改善心力衰竭的可能方式。近年来,生物活性肽在预防和治疗心血管疾病方面引起了越来越多的关注。内皮抑素作为一种小分子生物活性肽,具有调节睡眠与学习记忆、诱导免疫耐受、抑制炎症反应、调节内分泌代谢等多种生物学效应。此外,内皮抑素在心血管疾病的发生发展中起着重要作用[4]。因此,本研究旨在探究内皮抑素对HF-AMI的作用及对心肌细胞凋亡的影响,以期为明确内皮抑素在HF-AMI的作用机制及开发新的治疗药物提供理论依据。
有研究在探究内皮抑素与主动脉钙化的关系及其机制时发现,内皮抑素可能通过糖原合成酶激酶-3β(GSK3β)/β-连环蛋白(β-catenin)和蛋白激酶C(PKC)信号通路抑制血管平滑肌细胞钙化和大鼠动脉钙化[11]。有证据显示,外源性内皮抑素通过抑制内质网应激和心肌细胞凋亡,改善大鼠急性心肌梗死后心功能,具有明显的心肌保护作用[12]。内皮抑素可抑制环孢素诱导的大鼠心肌细胞凋亡,从而发挥对心肌细胞的保护作用[13]。另有研究表明,内皮抑素可抑制腹主动脉瘤小鼠的ROS水平[5]。本研究显示,内皮抑素可改善HF-AMI大鼠心功能和血流动力学障碍,改善心肌组织病理学变化,抑制心肌细胞凋亡和氧化应激。
p38 MAPK通路参与心脏疾病的发生发展,研究表明,心肌肥厚大鼠p38 MAPK磷酸化水平与正常大鼠相比上调;环维黄杨星D通过抑制p38 MAPK磷酸化水平,减轻心肌肥厚大鼠左室肥厚,改善组织病理学、血流动力学和心功能[14]。银杏叶提取物通过抑制p38 MAPK通路抑制心肌细胞凋亡和炎症,减少AMI小鼠梗死面积[15]。近年来,研究表明,血管平滑肌细胞的增殖和迁移参与了动脉粥样硬化、再狭窄和移植性血管病等血管疾病的发生发展[16]。内皮抑素通过抑制细胞外调节蛋白激酶(ERK)1/2、p38 MAPK、c-Jun氨基末端激酶(JNK)和ERK5信号通路在血管紧张素Ⅱ刺激的血管平滑肌细胞中发挥抗增殖和抗迁移作用[17]。以上研究结果说明,内皮抑素可能通过抑制p38 MAPK通路,在心血管疾病中发挥作用。本研究显示,HF-AMI大鼠p38 MAPK磷酸化水平与正常大鼠相比明显上调,而内皮抑素可下调HF-AMI大鼠p38 MAPK磷酸化水平,该结果表明内皮抑素通过抑制p38 MAPK通路活化在HF-AMI中发挥保护作用。
综上所述,内皮抑素通过抑制p38 MAPK通路抑制HF-AMI大鼠氧化应激及细胞凋亡,从而在HF-AMI中发挥保护作用。本研究为探明内皮抑素在HF-AMI中的作用机制及开发新的HF-AMI治疗药物提供了新的科学依据。

