趋化因子在冠心病心房颤动中的研究进展
陈 婷,胡元会,褚瑜光,贾秋蕾,袁果真,柴若宁,杨亦含,杜宜航
心房颤动(atrial fibrillation,AF)是临床常见的心律失常疾病,其主要特征是心电活动的不协调性。数据表明,目前全球心房颤动病人约3 700多万例,其中55岁以上病人约880万例,我国女性心房颤动患病率为0.63%~2.87%,男性患病率为0.91%~5.66%,且发病率和患病率正逐年增加[1]。临床中关于心房颤动早发现、早诊断、早治疗极其重要,可大大降低其并发症如脑卒中、痴呆等疾病的发生,提高心房颤动病人生活质量[2]。2020年欧洲心房颤动指南将心房颤动按照持续时间主要分为阵发性心房颤动(paroxysmal atrial fibrillation,PaAF)、持续性心房颤动(persistent atrial fibrillation,PeAF)、永久性心房颤动(permanent atrial fibrillation,PmAF)。研究显示,40%~70%的PaAF及30%的PeAF和PmAF病人临床症状不显著,早期诊断率低,若不及早采取干预措施,约90%的病人会持续进展[3-5]。冠状动脉粥样硬化性心脏病(coronaryatherosclerotic heart disease,CHD)简称冠心病,是冠状动脉血管发生动脉粥样硬化病变而引起血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏病。调查显示,冠心病心房颤动的发病率正逐年增加,22%~49%的心房颤动病人合并冠心病,冠心病心房颤动病人更易发生不良心脑血管事件,更容易合并其他疾病,远期预后差[6-8]。因此,研究冠心病心房颤动具有重大意义。冠心病心房颤动是多种机制共同作用的结果,近年来,随着对心房颤动发病机制(如电重构、结构重构、局灶驱动和折返机制等)的深入研究,已逐步深入到细胞分子层面。其中,趋化因子在冠心病心房颤动的发生发展中扮演着重要角色。
1 趋化因子研究概括
1.1 趋化因子分类 趋化因子是一种小型可溶性信号蛋白,需要借助浓度梯度,且与细胞表面趋化因子受体相互结合发挥作用,负责体内各种细胞的迁移、趋化,具有诱导附近反应细胞定向趋化的能力[9]。趋化因子根据分子中N-末端半胱氨酸的不同位置主要分为4个亚家族,包括CXC、CC、XC和CX3C[10],对应的就有4种不同的受体:CXCR、CCR、XCR、CX3CR,趋化因子受体是最大膜蛋白家族——G蛋白偶联受体(G protein-coupled receptor,GPCR)超家族中的重要成员。每个趋化因子家族趋化不同类型的细胞。详见图1。
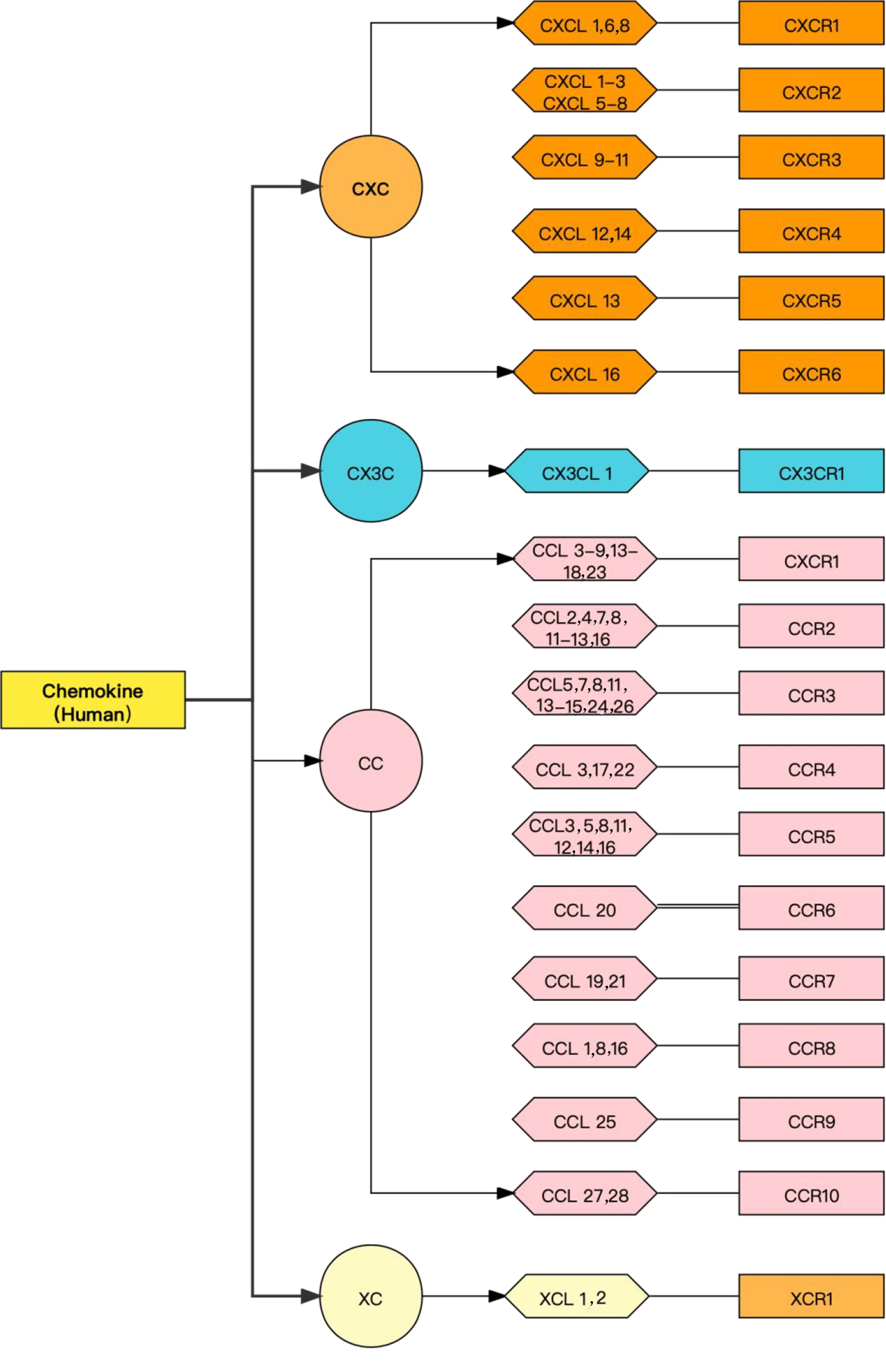
图1 趋化因子配体及结合趋化因子受体汇总
1.2 趋化因子作用 首先,趋化因子根据其在免疫系统和炎症反应中的功能主要可以分为促炎、稳态或双重功能,促炎趋化因子的主要功能是在炎症和体内平衡过程中管理白细胞向各自位置的迁移;相比之下,促炎趋化因子是在病理条件下形成的,是由组织和迁移的白细胞对细菌毒素和促炎细胞因子,如白细胞介素(IL)-1或是肿瘤坏死因子α(TNF-α)产生的[11]。趋化因子通常结合其特定的趋化因子受体或非典型受体发挥作用,对体内各种重要生理功能的实现以及疾病的发生进程不可或缺,如造血作用、淋巴组织发育、炎症反应、白细胞迁移、过敏、伤口修复、新血管生成、癌症发生和肿瘤迁移等[12-13]。
2 血清趋化因子在冠心病心房颤动中的研究进展
2.1 CXC型趋化因子在冠心病心房颤动中的研究进展 心脏重塑是心房颤动发生的重要机制,由趋化因子介导的单核细胞浸润致心脏受损是炎症的第一步。Wang等[14]在研究CXC型趋化因子配体(CXCL)1及其受体(CXCR)2在血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)诱导的心脏重构机制中发现,CXCL1是模型小鼠上调最高的趋化因子;在CXCR2缺陷小鼠中通过体外试验进一步证实,CXCR2的缺失通过多种信号通路抑制巨噬细胞的迁移和激活,并减弱Ang Ⅱ诱导的心肌细胞肥大和成纤维细胞分化;推测Ang Ⅱ诱导的心脏单核细胞浸润主要是由CXCL1-CXCR2信号介导的,可启动并加速心脏重塑的过程;相反,抑制CXCL1-CXCR2信号介导通路或可延缓这一进程,这对心房颤动的防治具有重要意义。
CXCL5能够招募中性粒细胞,并促进血管生成和结缔组织重塑[15-16]。一项对65岁以上冠心病人群中CXCL5表达水平与动脉粥样硬化关系及严重程度评估的临床研究表明,血浆CXCL5水平和冠心病严重程度成反比关系,CXCL5随着动脉粥样硬化的发生而增加,但是若进一步增加则或可具有动脉粥样硬化保护作用[17]。但具体的机制有待验证。
CXCL8又称IL-8,具有强大的中性粒细胞招募趋化功能,涉及肿瘤、呼吸系统、心血管疾病等多领域疾病[18-19]。目前CXCL8与心房颤动的相关研究多集中在心脏相关术后并发心房颤动等方面,即术后心房颤动(postoperative atrial fibrillation,POAF)。最新研究表明,冠状动脉搭桥术后病人发生心房颤动的概率达10%~40%,冠状动脉旁路移植术(coronary artery bypass grafting,CABG)病人术后发生心房颤动的概率高达50%~60%,由此导致血流动力学不稳定,容易诱发心力衰竭、脑卒中、血栓事件等发生[20-21]。Wu等[22]研究表明,冠状动脉搭桥术后并发心房颤动病人血清CXCL8水平升高,主要是由缺血心肌再灌注之后诱发的炎症改变所导致,且PmAF病人CXCL8水平高于PaAF病人。Weymann等[23]研究表明,CXCL8、IL-6和IL-10在心脏手术期间和术后水平明显升高,可作为心脏组织生理变化敏感的炎性标志物,从而影响心房颤动的发生。
CXCL9、CXCL10 CXCL11均通过自分泌和旁分泌的方式与其共同的细胞受体CXCR3结合,表达在不同类型的细胞如上皮细胞、内皮细胞、B淋巴细胞、T淋巴细胞、巨噬细胞、自然杀伤细胞和树突细胞等[24-25]。Qi等[26]通过探究成纤维细胞生长因子(fibroblast growth factor,FGF)信号通路时发现,FGF信号可通过诱导血管平滑肌细胞(vascular smooth muscle cells,VSMCs)释放CXCL9、CXCL10、CXCL11,从而参与白细胞浸润、斑块形成等过程,导致动脉粥样硬化。其中CXCL10与心房颤动的发生密切相关。
心房纤维化的进展与心肌成纤维细胞分化密不可分。心房颤动病人血清源性细胞外囊泡(extracellular vesicles,EVs)中含有丰富的MIAT表达。MIAT是一种长链非编码RNA,研究表明,MIAT作为肌成纤维细胞分化的一个强有力中介[27-28],高糖诱导的MIAT在心房颤动病人外周血白细胞中显著增加,可导致心肌纤维化、心肌细胞产生炎症;此外,MIAT下调可显著减轻心房颤动,增加心房有效不应期,减少心房颤动持续时间[29-30]。Chen等[31]通过测定心房颤动病人血清中EVs中MIAT的表达,结果表明,心房颤动病人血清中MIAT上调,CXCL10表达升高,揭示血清源性EVs可能携带MIAT与miR-485-5结合,减弱靶点CXCL10的抑制作用,产生炎症反应和氧化应激,促进心房纤维化,从而促进心房重构进程发生心房颤动。
CXCL12和其受体CXCR4形成的CXCL12/CXCR4轴已被证实参与炎症反应、组织修复、免疫细胞迁移,通常被看作是各种心脏疾病和非心脏疾病的有效治疗靶点[32-34]。临床数据表明,心房颤动病人血浆或心房组织中CXCL12和其受体CXCR4表达上调,直接影响了心房内部过度重构[35]。Liu等[36]通过心房颤动与窦性心律病人相比,PeAF病人血浆中CXCL12水平明显升高。Liu等[37]发现在心房颤动病人和尾静脉注射乙酰胆碱-氯化钙(Ach-CaCl2)诱发的心房颤动模型小鼠中均存在CXCL12/CXCR4轴的过度激活,并与心房炎症和纤维化的增加有关;此外,使用CXCR4特异性拮抗剂——ADMD3100阻断CXCL12/CXCR4轴,可通过一定的机制来抑制心房结构重构和心房颤动的发生。提示CXCL12/CXCR4轴可能是心房颤动潜在的治疗靶点。
CXCL13与其趋化因子受体CXCR5(CXCL13/CXCR5)轴参与各种疾病的炎症反应, 有研究证实了CXCL13/CXCR5轴在动脉粥样硬化中发挥着促动脉粥样硬化的作用[38]。已有研究表明,CXCL13或CXCL13/CXCR5轴参与间质性肺病、系统性硬化症(systemic sclerosis,SSc)、肝硬化等疾病,尤其是在组织纤维化、血管病变等机制方面扮演着重要角色[39-41]。CXCL14作为一种趋化剂,特别是对单核细胞,并诱导树突状细胞(dendritic cells,DCs)的成熟和迁移。有研究通过免疫组化检测发现CXCL14在动脉粥样硬化的泡沫细胞标本中呈高表达,证实核转录因子-1(activator protein-1,AP-1)与CXCL14启动子结合并上调CXCL14 mRNA表达,促进动脉粥样硬化形成[42]。CXCL16被称为氧化脂蛋白清除受体(oxidized lipoprotein,SR-PSOX),通常以跨膜和可溶性的形式表达,结合其趋化因子受体CXCR6,即CXCL16/CXCR6轴,诱导活化的T细胞迁移到炎症组织,参与组织损伤和纤维化过程[43]。目前已知CXCL16参与癌症、动脉粥样硬化、肾脏纤维化和非酒精脂肪肝等疾病的发展过程[44]。Huang等[45]认为CXCL16水平升高是心血管死亡风险增加的独立危险因素,CXCL16或参与了促进心脏成纤维细胞增殖和胶原合成受损,促进细胞外基质重构,从而加速了心房结构重构的进程。CXCL17是一种黏液趋化因子,近期研究发现,CXCL17与心血管疾病密切相关[46-49]。Gong等[50]研究表明不稳定型心绞痛病人血清CXCL17水平显著上调,而稳定型心绞痛病人血清CXCL17水平与对照组比较差异无统计学意义;此外,CXCL17与超敏C反应蛋白(hs-CRP)水平呈正相关,表明CXCL17与炎症活动以及动脉粥样硬化斑块的不稳定性有关,由此CXCL17可看作为不稳定型心绞痛的独立危险因素,CXCL17水平升高或可作为区分及排除急性心肌梗死后稳定型和不稳定型心绞痛的潜在生物标志物。
2.2 CC型趋化因子在冠心病心房颤动中的研究进展 CC型趋化因子配体(CCL)4来源于各种血管和血细胞的分泌,如活化的白细胞、淋巴细胞、血管内皮细胞和肺血管平滑肌细胞[51-53]。研究显示,CCL4可在动脉粥样硬化斑块中的T细胞、平滑肌细胞和巨噬细胞中检测到,并在易损斑块上调明显;此外CCL4与趋化因子受体(CCR)5可能参与动脉粥样硬化相关的炎症过程[54]。Chang等[55]对CCL4在体内动脉粥样硬化中的作用机制进行研究,结果发现,在活体动脉粥样硬化实验模型中,CCL4可抑制血管炎症,减少粥样硬化的斑块面积,促进斑块的相对稳定性。关于CCL4在心血管疾病中发挥的作用有待于进一步验证。
CCL5参与T淋巴细胞的激活和增殖,被认为是参与急性和慢性炎症主要的趋化因子[56]。Tereshchenko等[56]研究表明CCL5在动脉粥样硬化晚期病变中表达CCL5基因的功能多态性可能参与了冠状动脉疾病的发病机制。Jongstra-Bilen等[57]研究发现在高胆固醇饮食诱导3周后的高胆固醇血症小鼠主动脉内膜中CCL5 mRNA和CCR5受体的其他配体(CCL3和CCL4)表达上调,免疫染色显示CCL5蛋白表达也上调;阻断CCR5显著减少了单核细胞对病变的募集,推测造血细胞来源的CCL5在单核细胞募集和巨噬细胞丰度中发挥关键作用。
CCL18被认为是一种具有促纤维化作用机制的标志物[58-62],目前CCL18已被证明与缺血性冠状动脉疾病(coronary artery disease,CAD)病人的心血管事件相关[63]。De Sutter等[63]研究表明,CCL18水平是评估心血管事件发生的独立预测指标。Versteylen等[64]通过冠状动脉钙化评分和受累评分结果显示,CCL18显示出与冠心病程度明显的单变量相关性,CCL18或可作为急性心肌梗死及不稳定型心绞痛事件后发生继发性心血管事件的独立预测因子。此外,有研究表明CCL18在损伤愈合中可以激活成纤维细胞并增加胶原蛋白的合成,具有纤维化作用[65-66]。Huang等[45]在研究趋化因子在心房颤动病人中的预后价值时发现,心房颤动病人外周血高水平的CCL18(>166.90 ng/mL)是心房颤动病人发生脑卒中的独立危险因素。
CCL21主要表达于淋巴结高内皮小静脉上[67],与其趋化因子受体CCR7相结合发挥趋化作用。研究显示,目前CCL21或CCL21/CCR7轴参与类风湿性关节炎血管生成[68]、炎症性肠病[67]、骨关节炎[69]等疾病,在心血管疾病中研究主要集中在动脉粥样硬化相关疾病[70]。Akhavanpoor等[70]研究发现CCL19和CCL21表达在不稳定的动脉粥样硬化病变及导致心肌梗死的冠状动脉病变中显著增加,这提示趋化因子CCL19和CCL21在斑块进展、斑块的不稳定性及斑块破裂中起关键作用,与动脉粥样硬化病变的进展有关。Cai等[71]证实了CCL19/CCL21/CCR7在体外通过单核细胞黏附和迁移直接促进动脉粥样硬化发生,使用阿托伐他汀抑制了CCL19/CCL21诱导的单核细胞黏附和迁移,结果显示CCL19/CCL21/CCR7表达下调,提示他汀类药物可能抑制CCL19和CCL21的致动脉粥样硬化作用及起到抑制炎症的作用。
CCL23主要在肺、肝和胰腺中的巨噬细胞内表达[72],在T淋巴细胞、单核细胞和中性粒细胞中具有趋化活性,并与CCR1结合。Huang等[45]通过使用Bio-plex ProTMxMAP阵列测量299例非瓣膜性心房颤动病人的基线血浆趋化因子水平,得出外周血中趋化因子配体CCL23是非瓣膜性心房颤动病人脑卒中风险的独立危险因素,高水平的CCL23与心房颤动病人心血管病死亡风险独立相关。
CCL25与CCR9结合,在T淋巴细胞发育和组织特异性归巢中发挥关键作用[73]。目前CCR9/CCL25信号轴涉及的疾病主要包括心血管疾病[74]、肝炎[75]、关节炎[76]、炎症性肠病[77]等。有研究使用敲除CCR9的小鼠来探究CCR9/CCL25轴在心血管疾病中的作用,结果表明CCR9/CCL25轴可能参与并调控心肌梗死后的心肌结构重构和电重构。
2.3 CX3C型趋化因子在冠心病心房颤动中的研究进展 趋化因子(C-X3-C基序)配体1 (CX3CL1)具有黏附分子和化学引诱剂的双重功能,在内皮细胞、成纤维细胞、成骨细胞和神经元等非造血细胞中表达[78]。目前关于CX3CL1在心血管领域研究较少,Guo等[79]研究表明,血浆CX3CL1水平与心房颤动病人发生心血管事件的风险之间存在独立关联,CX3CL1水平与心房颤动心血管风险(CHADS2评分)之间存在线性相关,因此,认为CX3CL1在完善心房颤动病人风险分层方面具有一定价值。
3 小 结
趋化因子参与冠心病心房颤动涉及多方面机制。首先,趋化因子通过促炎作用参与心房颤动的发生发展。其次,趋化因子或与心房颤动病人心房内部结构重构密切相关。此外,炎症反应与冠状动脉粥样硬化斑块形成、发展、破裂密切相关,是影响斑块稳定性的重要因素[80]。而斑块的不稳定性与斑块破裂、脱落、血栓形成密切相关,是加重心肌缺血甚至猝死的重要机制[81]。虽然参与冠心病和心房颤动的趋化因子有所不同,但其在促炎、促纤维化、促动脉粥样硬化等机制中发挥的作用或具有一致性、协同性,共同加重疾病的进展,这有待进一步验证。探究趋化因子表达水平以及重点相关冠心病心房颤动发病机制的趋化因子种类对临床具有重要意义。

