基于“雅解理论”探讨雅解益栽(心)方药物血清对CSE诱导VEC-304细胞损伤的影响
骆始华 李易 赵丽娟 陶希睿 刘中勇 段小花 田慧 张超

基金项目:
云南省科技厅基础研究专项-面上项目(202101AT070250);中国民族医药学会科研项目(2021Z1331-361001);云南省科技厅中医联合专项-面上项目(202101AZ070001-231);云南中医药大学第一附属医院“卓越青年人才计划(复合型)”项目(编号:云中附党字[2022]3号);云南省科技厅中医联合项目-青年项目(202001AZ070001-094);云南省傣医药与彝医药重点实验室开放课题项目(2021K002);云南省傣医药与彝医药重点实验室开放课题项目(202210ZD2211)。
作者简介:
骆始华(1984—),男,彝族,博士,副主任医师,研究方向为民族医药及心血管疾病临床及基础研究。E-mail:luotuozlj@163.com
通信作者:
張超(1959—),男,汉族,研究生,教授,研究方向为民族医药临床及实验研究。E-mail:1055705389@qq.com
【摘 要】
目的:观察香烟提取物(CSE)诱导血管内皮(VEC)-304的存活率、细胞增殖抑制率的变化,测定细胞裂解液的抗氧化能力,检测细胞相关凋亡蛋白的表达,探讨雅解益栽(心)方药物血清对CSE诱导的VEC-304细胞损伤的影响。方法:采用CSE复制VEC-304细胞损伤模型,雅解益栽(心)方含药血清倍比稀释后分为3个剂量干预组(体积分数10%),采用MTT、TUNEL、DNA ladder、免疫组化以及Western Blot等方法,检测雅解益栽(心)方药物血清对CSE诱导的(VEC)-304细胞损伤的影响。结果:CSE可诱导细胞凋亡,其机制与其引发细胞氧化应激反应有关;诱发细胞Caspase-3、Bax、NF-κb表达上调,Bcl-2、p53下调,而致细胞凋亡。雅解益栽(心)方干预组细胞SOD、GSH-px、GSH含量比空白对照组高,MDA及NOS比空白对照组低;而Caspase-3、Bax、NF-κb表达下调,Bcl-2、p53表达上调。并有一定的量效依赖关系。结论:CSE能诱导VEC-304细胞凋亡,雅解益栽(心)方药物血清有明显的抗氧化作用,能抑制细胞凋亡,从而具有解烟毒作用。
【关键词】
香烟提取物(CSE);VEC-304细胞;细胞凋亡;雅解益栽(心)方;抗氧化
【中图分类号】 【文献标志码】 A 【文章编号】1007-8517(2023)24-0014-08
DOI:10.3969/j.issn.1007-8517.2023.24.zgmzmjyyzz202324004
Effect of Yajie Yizai (Xin) Prescription Drug Serum on CSE Induced VEC-304 Cell njury Based on the “Yajie Theory”
LUO Shihua1 LI Yi2 ZHAO Lijuan2 TAO Xirui3 LIU Zhongyong4 DUAN Xiaohua1 TIAN Hui1 ZHANG Chao1*
1. Yunnan University of Chinese Medicine, Kunming 650500,China;
2.The Affiliated Hospital of Yunnan university of Chinese Medicine, Kunming 650021,China;
3. Chinese Journal of Ethnomedicine and Ethnopharmacy Magazine, Kunming 650021,China;
4.The Affiliated Hospital of Jiangxi University of Traditional Chinese Medicine,Nanchang 330006,China
Abstract:
Objective To observe the changes of survival rate and cell proliferation inhibition rate of vascular endothelial (VEC)-304 induced by cigarette extract (CSE), determine the antioxidant capacity of cell lysate, detect the expression of apoptosis protein, and explore the effect of Yajie Yizai (Xin) drug serum on CSE-induced VEC-304 cell injury.Method Vec-304 cell damage model was replicated by CSE, and Yajie Yizai (Xin) drug-containing serum was diluted at multiple ratio and divided into 3 dose intervention groups (10% by volume fraction). MTT, TUNEL, DNAladder, immunohistochemistry and WesternBlot were used.The effect of Yajie Yizai (Xin) drug serum on CSE-induced (VEC)-304 cell damage was detected.Results CSE can induce cell apoptosis, and its mechanism is related to the oxidative stress response of cells.The expression of caspase-3, Bax, NF-κ B was up-regulated, and the expression of Bcl-2, p53 was down-regulated, resulting in apoptosis.2. The contents of SOD, GSH-Px and GSH in Yajie Yizai (Xin) intervention group were higher than those in blank control group, while MDA and NOS were lower than those in blank control group.The expressions of Caspase-3, Bax and NF-κ B were down-regulated, while the expressions of Bcl-2 and p53 were up-regulated.And there is a certain dose-effect dependence.Conclusion CSE can induce apoptosis in VEC-304 cells, and Yajie Yizai (Xin) drug serum has a significant antioxidant effect, which can inhibit cell apoptosis and thus have a detoxifying effect.
Keywords:
Cigarette extract (CSE);VEC-304cell;Apoptosis; Yajie Yizai (Xin); Prescription
傣医理论认为动脉粥样硬化是人们过量饮食导致的“食物毒”。傣医“雅解”理论最具特色,其核心内容包括“未病先解,先解后治,同解同治”及系列“雅解”方药,而解“食物毒”是“雅解”理论的重要组成部分。雅解学说中的“毒”不仅是一个具有物质属性的概念,同时也是一个具有病理学属性的概念[1]。其内涵具有广义与狭义之分。狭义的毒,乃为一类特殊的致病因素,如烟毒、食毒、虫毒等。广义的毒则具有病因和病机双重属性,其实质强调在病因作用下,疾病发生和发展骤然变化,出现功能破坏和形质受损。笔者认为傣医的“雅解”理论体现了傣医超前而朴素的医学思想,“雅解”(解药)方药有着千百年临床应用的历史经验的积淀,其临床功效虽然是多方面的,但主要集中体现在对有害物质或毒素(包括有毒物质、过剩的营养物质、酒精、药物等)的排泄或解除上[2]。傣医“雅解”方药所解之“毒”其内涵非常丰富,除包括了毒性物质、机体代谢产物、过剩的营养物质,以及食物中的有害物质、酒精、烟草、药物等毒性或毒副作用外,也包含了有害物质(毒素)所引起的疾病或临床症候群。因此其“解毒”作用当然也包含有非特异“解毒”作用,以及特定的“酒毒”“烟毒”“食物毒”的“解毒”作用的两个方面[3]。吸烟是导致冠心病的危险因素之一,这是因为烟草燃烧时释放的烟雾中含有多种已知的化学物质,其中包括一氧化碳、尼古丁等,这些化学物质有多种生物学作用,对人体造成多种危害[4]。血管内皮细胞通常指衬于心、血管和淋巴管内表面的单层扁平上皮,它形成血管的内壁,它们具有吞噬异物、细菌、坏死和衰老的组织,还参与集体免疫活动功能。近年有研究发现香烟烟雾提取物(cigarette smoke extrat,CSE)中含有丰富的氧化剂和自由基,可导致细胞凋亡。有研究表明,傣医雅解益栽(心)方(以下简称YJYXF)除具有降脂作用外,还有抗氧化作用。故本研究采用体外细胞培养方法,培养血管内皮(VEC)-304细胞,雅解益栽(心)方(YJYXF)药物干预CSE诱导的VEC-304细胞,检测其抗氧化能力,探讨YJYXF药物血清对CSE诱导的VEC-304细胞损伤的影响,阐述其解烟毒可能机制,并筛选其最佳抗氧化剂量。
1 材料与仪器
1.1 材料 香烟提取物(CSE):参照香烟烟雾标准采气速率法,用50 mL注射器抽吸,每2 s抽气30 mL,间隔58 s抽气1次。连续抽取5支香烟,使香烟提取物的浓度为1支/mL。以5 mLDMEM为吸收液在使用前30min制备。最后用0.22 μL孔径的滤膜过滤形成CSE原液,将悬液调至pH 7.4备用,将收集的混合液定义为100% CSE。YJYXF饮片由云南中医药大学第一附属医院中药房提供,取水煎液,终浓度为2 g生药/mL;VEC-304细胞购自中山大学实验動物中心。
1.2 主要试剂 胎牛血清、DMEM培养基(美国Invitrogen公司)、胰蛋白酶、Quick-g DNAminiprep试剂盒(ZYMO公司)、MTT试剂盒(杭州碧云天生物科技有限公司)、TUNEL检测试剂盒(美国sigma公司)、超氧化物歧化酶(SOD)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)检测试剂盒、一氧化氮合酶(NOS)检测试剂盒、丙二醛(MDA)检测试剂盒(南京建成生物科技有限公司)、NF-Kb p65 antibody、BAX antibody、Caspase-3 antibody、P53 antibody(Santa cruz)。
1.3 仪器及设备 生物显微镜(olympus);荧光定量PCR仪(美国Invitrogen公司);PCR仪(美国thermo公司);TY-80B脱色摇床(江苏金坛市莱华仪器制造有限公司);酶标仪(美国biotek公司);DYY7C型电泳仪电源(北京市六一仪器厂);电泳槽、湿转转膜仪(Tanon公司)。
2 方法
2.1 含药血清的制备 以人临床等效剂量5倍剂量给大鼠灌胃,每天2次,连续7 d,正常对照组给予等量生理盐水。于末次给药后1 h(灌药前禁食不禁水12 h)颈动脉取血,分离血清,56℃灭活30 min,0~22的微孔滤膜过滤除菌,密封后置-20℃冰箱保存备用。
2.2 细胞分组及处理 细胞株培养于含10%新生胎牛血清、1%PS的DMEM培养基中,培养条件为37℃、CO2体积分数5%的饱和湿度环境。细胞呈单层贴壁生长。待细胞生长达90%左右时传代,约2 d消化传代1次(0.25%胰酶含EDTA0.02%),细胞计数板计数,重复3次,取对数生长期细胞为实验对象,细胞分装传代,倒置显微镜下观察细胞生长情况,待细胞单层长满时开始干预。
2.3 细胞分组及干预方法 取对数生长期细胞进行实验,调整细胞密度为1×105 /L。按照1∶[KG-*3/5]1比例用空白血清将含药血清稀释为高、中、低3个浓度,然后将含药血清和条件培养基混合,控制比例为含药血清10%。实验共分为5组:正常对照组(条件培基),空白血清对照组(条件培基中给予5%CSE刺激+空白血清10%),含药血清高、中、低剂量组(条件培基中给予5%CSE刺激+含药血清10%),含药血清中剂量组,含药血清低剂量组。
2.4 DNA ladder 收集各组细胞上清液及细胞,刮下贴壁细胞,重悬,室温静置5~10min;移裂解液至放在收集管上的ZYMO-spin column中,10000 g,1min,弃收集管(含Ft);ZYMO-spin column 移至新的收集管上,加200 μLDNA Pre-Wash Buffer,10000 g,1min;加500 μLg-DNA Wash Buffer,10000 g,1min;ZYMO-spin column 移至新的1.5 mLEP管上,加50 μLDNA Elution Buffer或水,室温孵育2~5min,13000 g,30 s,做好标记,测浓度并保存至-20℃。
2.5 电泳 配制1%琼脂糖凝胶,置入1×TAE缓冲液的电泳槽中;上样:取DNA样品10 μL上样,电压80 V电泳,根据指示剂的迁移情况终止电泳。染色剂染色后在紫外分析仪下观察,拍照。
2.6 MTT法检测细胞抑制率 取对数期生长的VEC-304细胞经胰蛋白酶消化,制备细胞悬液,每孔细胞悬液200 μL接种于96孔细胞板,在37℃下,二氧化碳培养箱培养。培养24 h后,弃去上清液,PBS冲洗2次,每孔加入20 μLMTT溶液,在37℃下,二氧化碳培养箱培养4 h,弃去MTT液,每孔再加入200 μLDMSO,室温下振荡1min,至MTT完全溶解,于酶标仪上490 nm波长处读取各孔光吸收OD值,求出平均值。以公式计算细胞存活率(细胞存活率=处理组OD值/正常对照组OD值×100%)。
2.7 TUNEL法检测细胞凋亡 收集VEC-304细胞,脱蜡、水化、浸洗、固定、处理组用1 μLrTdT+1 μL 生物素标记的dUTP+98 μL平衡液混匀;而阴性对照组不加rTdT,改为三蒸水;阳性对照组先加入100 μL DNase 1 缓冲液孵育5min,甩掉液体后再加100 μL DNase 1(10 U/mL)酶切10min,用去离子水冲洗4次,PBS浸洗5min,加100 μLTUNEL反应混合液于标本上,加100 μLstreptavidin标记HRP(按1∶[KG-*3/5]500 PBS稀释)30min;DAB显色(避光)、用苏木素复染,梯度酒精脱水,中性树胶封片。在显微镜下观察,并记录细胞凋亡情况。
2.8 氧化物及抗氧化系统的检测 将收集各组细胞用洗两次后,采用细胞超声裂解仪制成细胞裂解液,采用试剂盒检测超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)、一氧化氮合酶(NOS)及丙二醛(MDA)含量。
2.9 免疫组化分析 将已消毒的20 mm盖玻片置于90 mm培养皿中,按2×104/mL的细胞密度将细胞接种于培养皿中进行细胞爬片,5 d后进行免疫细胞组织化学染色鉴定。PBS溶液冲洗3min×3次。甲醛固定15min;空气干燥5min。PBS清洗标本3次各2min,DPBS配孵育1次20min。PBS清洗标本3次各2min。3%H2O2孵育15min。PBS清洗标本3次各2min,封闭血清孵育(5%正常二抗血清DPBS液)20min。一抗孵育(PBS配,滴度1∶[KG-*3/5]200,湿盒)4℃过夜。抗体情况见表1。
PBS清洗标本3次各5min。二抗工作液孵育pv6001(湿盒)37℃30min。PBS清洗标本5次各2min。DAB显色(避光,镜下观察至棕色)约10~15min。蒸馏水或自来水洗1次5min。(可放六孔板內,再将孔板放在饭盒等内,自来水下冲洗),苏木素复染10min。自来水洗5min。树胶封片。生物显微镜阅片。
2.10 Western Blot分析法检测细胞相关蛋白表达情况 加入 RIPA 裂解液提取总蛋白,15min 后使用 BCA 试剂盒检测总蛋白浓度。取蛋白 40 μg 进行 SDS—PAGE 电泳分离蛋白,结束后转膜并使 用脱脂奶粉封闭 1 h; 加入 NF-Kb p65、SC-372、Santa Cruz Biotechnology、1∶[KG-*3/5]50,BAX、5023S、celling Signaling technology、1∶[KG-*3/5]100,Caspase-3、SC-7148、Santa Cruz Biotechnology、1∶[KG-*3/5]50,p53、SC-47698、Santa Cruz Biotechnology、1∶[KG-*3/5]50 一抗试剂,4℃过夜,次日加入辣根过氧化物酶标记的二抗试 剂 (1∶[KG-*3/5]6000) 在室温下孵育 50min,PBST 清洗后200~300 μLECL 曝光,用TBST洗膜5遍,每次5min,准备曝光。并进行曝光和显影及灰度值分析。
3 结果
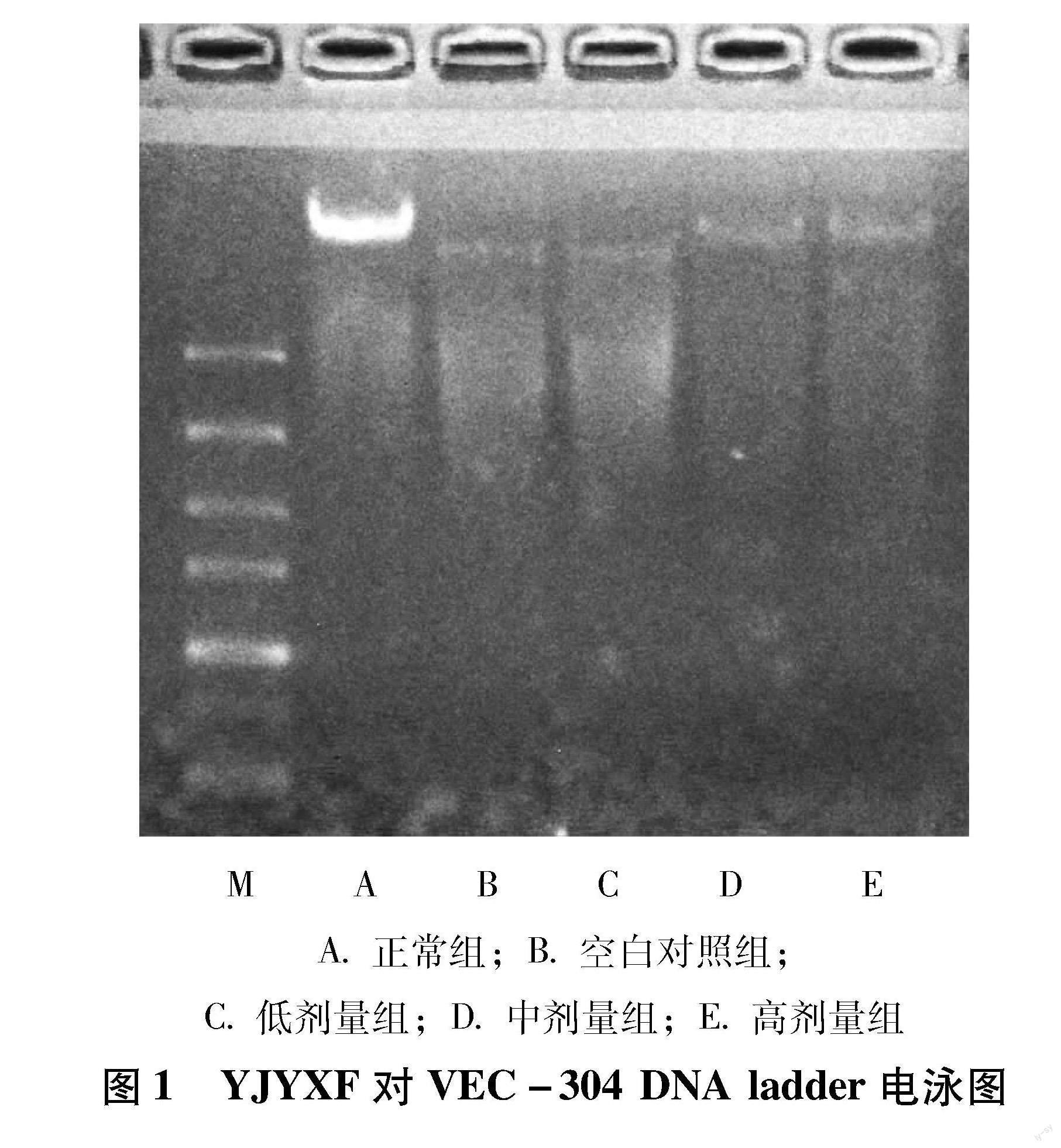
3.1 YJYXF对VEC-304细胞凋亡的影响 DNA ladder电泳图检测结果显示,正常组基因组DNA聚集在一条带上,说明没有发现DNA凋亡降解,空白对照组和低剂量组DNA电泳成弥散状,在中剂量和高剂量组,弥散状基本消失,说明干预对DNA的凋亡降解有保护作用。如图1所示。
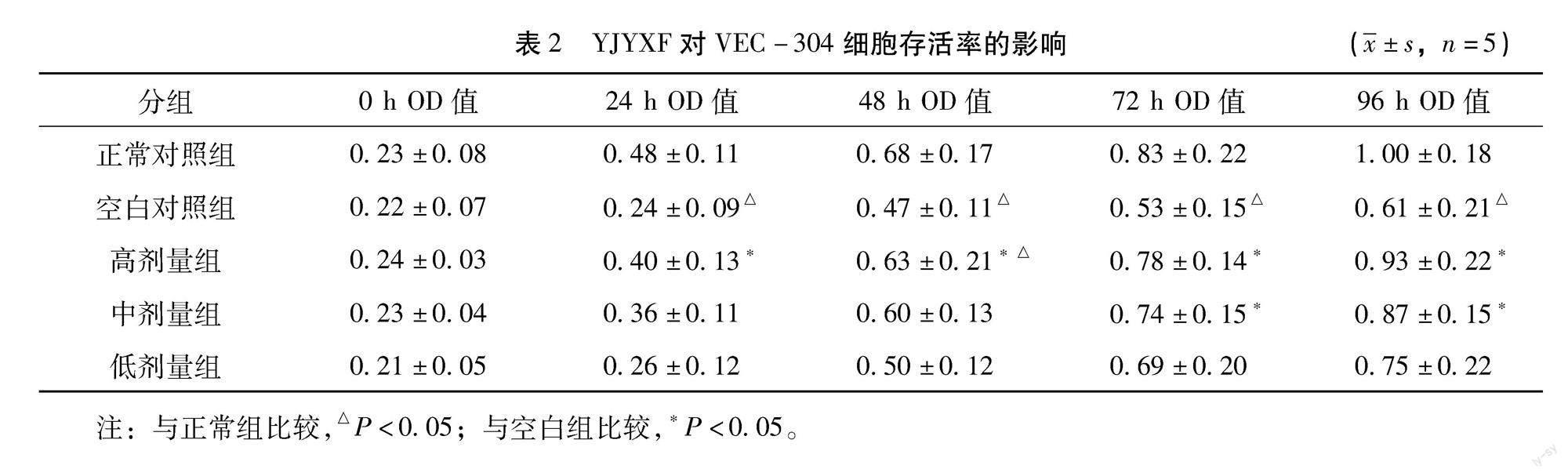
MTT检测结果显示,各组细胞的存活率以空白对照组最低。24 h后与空白对照组比较,正常对照组及高、中剂量组均有明显差异,且随时间延长差异更明显(P<0.05);空白对照组凋亡率明显高于正常对照组及高、中、低剂量组。提示YJYXF可明显提高CSE诱导内皮细胞存活率,抑制细胞凋亡。见表2,如图2所示。
TUNEL法结果检测结果显示(如图3所示), 空白对照组中图片可见细胞发生典型的凋亡,在正常细胞组见散在的凋亡细胞,干预组与空白对照组比较,高剂量凋亡细胞少见。
空白对照组凋亡率明显高于对照组及高低剂量组,二者差异具有统计学意义(P<0.05)。结果如图4所示。两实验组细胞凋亡率均低于空白对照组(P<0.05)。提示YJYXF可抑制细胞凋亡。见表1,如图1、图2所示。
3.2 YJYXF对各组细胞SOD、GSH-Px、GSH、NOS、MDA的影响 结果见表3,如图5所示,空白对照组SOD、GSH-px、GSH含量均比正常对照组低,而MDA及NOS均比正常对照组高,差异具有统计学意义(P<0.05);高、中、低剂量组 SOD、GSH-px、GSH含量比空白对照组高,MDA及NOS比空白对照组低,差异具有统计学意义(P<0.05),尤其以高剂量组更明显(P<0.01),提示YJYXF药物血清有明显的抗氧化能力,且有一定的量效关系。
2.3 YJYXF对CSE诱导内皮细胞凋亡蛋白影响 结果如图6和图3 Western Blot分析。与空白对照组比较,Caspase-3、 NF-κb(p65)、Bax的阳性条带与GAPDH比值降低(P<0.05)。p53的阳性条带与GAPDH比值升高(P<0.05)。表明YJYXF能够抑制Caspase-3、NF-κb、Bax,促进p53表达来保护内皮细胞。提示YJYXF对CSE诱导的ECV304细胞相关凋亡基因的异常表达有调控作用。
4 讨论
傣医学是傣族人民在两千多年的生活和医疗实践中形成的以“四塔”“五蕴”为基础理论的核心,“三盘”学说、“雅解”学说为理论特色的一门医学学科;其中,傣医“雅解”理论最具特色,其核心内容包括“未病先解、先解后治,同解同治”及系列“雅解”方药,而解“食物毒”是“雅解”理论的重要组成部分。“雅解”为傣语,意译为解药,指能解除体内各种毒素,平衡和协调“四塔五蕴”以及脏腑功能的一类傣医方药的统称。雅解理论和雅解(解药)方药在疾病的防治中起了重要的作用。傣医认为人体要保持健康必须常服用雅解(解药)以排出人体内小毒并以此创立了解药,在傣族民间家家都备有不同的解药,有解食物毒、酒毒、烟毒、毒虫毒、热毒、火毒等,傣医的雅解理论和雅解(解药)方药的临床适应症较为广泛,特别是对心血管疾病、代谢性疾病、消化系统疾病等均有肯定的疗效。
傣医认为当人体发病后应先服用“解药”,用来由于过食而产生“食物毒”,通过服用“解药”以解除烟毒产生的毒副作用,以解除人体的毒素,从而调节人体生理功能,保持体内“四塔”(风、火、水、土)、“五蕴”(色、识、受、想、行)功能的平衡和协调[1]。“雅解益栽(心)方”是从傣医临床文献资料中收集整理的民族有效验方,该方具有调节体内“四塔、五蕴”功能[4],可解除人体毒素,保护脏腑功能。“雅解益栽(心)方”的药物组成中[5],雅解先打(傣百解)、文尚海(百样解)性凉,入风、火、水、土塔,调四塔,解酒毒、热毒和其他毒,护脏腑为主药;嘿涛罕(大黄藤)性寒凉,入四塔,有调四塔,解百毒之作用。蟑螂味咸,入土、水塔,解毒健脾之功;咪多领性溫,补火塔,理气止痛;毫命(姜黄)味苦、微辣,有臭气,性平偏热,入水、土、风塔。具活血止痛、清火解毒之功。管底(三叶蔓荆)根味苦、性凉,入风、水、土塔,清火解毒,治疮疖肿痛等组成。全方合用具有调补四塔、清火解毒之作用,可达调补气血,解热毒、酒毒、食物中毒及保护心肝肾之目的。全方合用具有调补四塔、清火解毒之作用,可达调补气血,解热毒、酒毒、食物毒及保护心肝肾之目的。
4.1 香烟与动脉粥样硬化 香烟中的CO使血液中的氧气含量减少是造成心血管疾病的主要原因。吸烟可致冠状动脉血管收缩,导致血液供应不足、心肌缺血。长期的刺激可造成血管内皮改变[5]。进而影响血液循环,导致心脑血管及呼吸系统等多种疾病。吸烟过程中还易产生自由基,损伤血管内皮致多种慢炎症性疾病。CO经呼吸可穿透肺泡进入肺组织间隙,随着循环系统扩散至微血管作用于血管内皮。受损的内皮细胞在氧化应激和炎症刺激下可吸附单核细胞,吞噬脂质成为成泡沫细胞,形成脂质斑块,使动脉管腔狭窄,管壁失去弹性形成动脉粥样硬化[6]。
4.2 氧化应激损伤与动脉粥样硬化 氧化和抗氧化系统之间的平衡是维持内皮细胞功能的关键因素[7-11]。超氧化物歧化酶(superoxide dismutase,SOD)是细胞内的抗氧化酶,可通过清除超氧阴离子减轻活性氧(reactive oxygen species,ROS)损害从而保护内皮细胞,SOD活性的高低可反映机体抗氧化损伤能力。脂质在自由基作用下可发生过氧化反应,其不饱和脂肪酸氧化终产物为丙二醛(malonaldehyde,MDA),可引起核酸及蛋白质等生命大分子交联聚合,产生细胞毒性,MDA含量的高低可反映内皮细胞氧化损伤的严重程度。乳酸脱氢酶(lactic dehydrogenase, LDH)存在于内皮细胞,当细胞受损时细胞膜结构和细胞质内氧依赖性酶受到影响,细胞膜通透性增加,细胞外液LDH漏出量相应增加,因此LDH含量的高低可反映内皮细胞损伤程度[7-13]。
NOX (nadph oxidase)首先发现于中性粒细胞和巨噬细胞,在炎症反应时这两种细胞发生“氧化爆发”产生大量ROS而构成机体抵抗病原体的第一防线。ROS不再是有氧代谢的副产物,而是具有信号转导、免疫功能、激素生物合成功能的活性产物。NOX和DUOX(dual oxidase)是公认的能够调节ROS产生的特殊功能酶,与吞噬细胞中NADPH氧化酶所制造的ROS不同,NOX和DUOX所产生的ROS不主要起细胞防御功能,而是作为第二信使,参与细胞分化、增殖、凋亡的调节[3]。研究[4]表明氧化的低密度脂蛋白能够激活人冠状动脉内皮细胞中的NOX4而促进ROS的生成。活化的NADPH氧化酶生成过多的ROS又能够氧化低密度脂蛋白,而氧化的低密度脂蛋白又能促進NADPH氧化酶的活化,进而形成恶性循环,促进动脉粥样硬化的形成[14-15]。
本研究结果表明,运用YJYXF与CSE干预内皮细胞后MDA含量、NOS活性及细胞凋亡率明显降低,SOD及GSH-px活性、GSH含量及细胞存活率明显升高,表现出了很好的抗氧化应激作用。提示YJYXF对血管内皮细胞保护的作用机理可能是与其能提高抗氧化能力有关[16]。
NF-κB(nuclear factor kappa B)蛋白是进化上高度保守的一种免疫反应介质,不同的细胞外刺激信号都可激活该转录因子,从而参与细胞的生长、分化、发育、凋亡、粘附及炎症反应。炎症因子水平上调一直被认为是促进动脉粥样硬化性损伤的原因,许多炎症因子,诸如IL-6,C-反应蛋白CRP都与动脉粥样硬化及其他心血管病有关。而NF-kB又是炎症反应中的关键因子[5-6]。抑制NF-κB通路活化则有助于缓解动脉粥样硬化[17]。
Bcl-2家族蛋白對细胞凋亡的调控起了重要作用,其成员包括促凋亡蛋白Bax及抑凋亡蛋白Bcl-2等亚家族,Bax/Bcl-2比值的高低对细胞凋亡起了直接的调控作用[2]。
DNA ladder及MTT检测结果显示,YJYXF干预对DNA的凋亡降解有保护作用。研究表明,空白对照组Caspase-3、NF-κb(p65)、Bax明显上调,Bcl-2、p53明显下调,而应用YJYXF干预后,Caspase-3、NF-κb(p65)、Bax表达明显下调,Bcl-2、p53明显上调,从而抑制细胞的凋亡,对内皮细胞有保护作用,且具有解烟毒作用。
5 结论
YJYXF对CSE作为氧化应激源诱导的内皮细胞损伤及凋亡具有保护作用,其机制可能与调节内皮细胞相关凋亡基因的异常表达有关。从而达到抗氧化功能、保护内皮的作用,且二者有一定的量效关系,该研究阐述雅解学说中“毒”的狭义的烟毒,YJYXF解烟毒可能机制是调节内皮细胞相关凋亡基因的异常表达,从而达到抗氧化、保护内皮的作用,为傣医学YJYXF解烟毒是通过保护血管内皮,从而具有抗动脉粥样硬化的作用提供理论依据。
参考文献
[1]
李琼超. 基于食物过敏的傣药“雅解沙把”解“食物毒”作用机制研究[D]. 北京:北京中医药大学, 2017.
[2]李琼超, 郑进, 程颖, 等. 试论傣医特色雅解理论解食物毒内涵[J]. 云南中医中药杂志, 2017,38(7):68-69.
[3]AHMAD U, MCCURRY K R. Commentary: Living-donor lobar lung transplantation—An elegant solution to organ shortage[J]. The Journal of Thoracic and Cardiovascular Surgery, 2020,159(1):e91-e92.
[4]王磊, 段小花, 殷红, 等. 傣药雅解沙把对高脂血症小鼠降脂作用研究[J]. 中国民族民间医药, 2015,24(4):21-23.
[5]HORINOUCHI T, MAZAKI Y, TERADA K, et al. Cigarette Smoke Extract and Its Cytotoxic Factor Acrolein Inhibit Nitric Oxide Production in Human Vascular Endothelial Cells[J]. Biol Pharm Bull, 2020,43(11):1804-1809.
[6]TATSUTA M, KAN-O K, ISHII Y, et al. Effects of cigarette smoke on barrier function and tight junction proteins in the bronchial epithelium: protective role of cathelicidin LL-37[J]. Respir Res, 2019,20(1):251-263.
[7]IGARI K, KELLY M J, YAMANOUCHI D. Cigarette Smoke Extract Activates Tartrate-Resistant Acid Phosphatase-Positive Macrophage[J]. J Vasc Res, 2019,56(3):139-151.
[8]RAYNER R E, MAKENA P, PRASAD G L, et al. Cigarette and ENDS preparations differentially regulate ion channels and mucociliary clearance in primary normal human bronchial 3D cultures[J]. Am J Physiol Lung Cell Mol Physiol, 2019,317(2):L295-L302.
[9]ISKANDAR A R, ZANETTI F, MARESCOTTI D, et al. Application of a multi-layer systems toxicology framework for in vitro assessment of the biological effects of Classic Tobacco e-liquid and its corresponding aerosol using an e-cigarette device with MESH technology[J]. Arch Toxicol, 2019,93(11):3229-3247.
[10]LALLIER T E, MOYLAN J T, MATURIN E. Greater Sensitivity of Oral Fibroblasts to Smoked Versus Smokeless Tobacco[J]. J Periodontol, 2017,88(12):1356-1365.
[11]HAN S, JEROME J A, GREGORY A D, et al. Cigarette smoke destabilizes NLRP3 protein by promoting its ubiquitination[J]. Respir Res, 2017,18(1):2-9.
[12]HOLOWNIA A, WIELGAT P, RYSIAK E, et al. Intracellular and Extracellular Cytokines in A549 Cells and THP1 Cells Exposed to Cigarette Smoke[J]. Adv Exp Med Biol, 2016(910):39-45.
[13]ANDERSON C, MAJESTE A, HANUS J, et al. E-Cigarette Aerosol Exposure Induces Reactive Oxygen Species, DNA Damage, and Cell Death in Vascular Endothelial Cells[J]. Toxicol Sci, 2016,154(2):332-340.
[14]BISWAS S, DAS H, DAS U, et al. Smokeless tobacco induces toxicity and apoptosis in neuronal cells: a mechanistic evaluation[J]. Free Radic Res, 2020,54(7):477-496.
[15]SON E S, PARK J W, KIM Y J, et al. Effects of antioxidants on oxidative stress and inflammatory responses of human bronchial epithelial cells exposed to particulate matter and cigarette smoke extract[J]. Toxicol In Vitro, 2020(67):1-11.
[16]WANG L, LIU X, CHEN L, et al. Harmful chemicals of heat not burn product and its induced oxidative stress of macrophages at air-liquid interface: Comparison with ultra-light cigarette[J]. Toxicol Lett, 2020(331):200-207.
[17]MA L, JIANG M, ZHAO X, et al. Cigarette and IL-17A synergistically induce bronchial epithelial-mesenchymal transition via activating IL-17R/NF-kappaB signaling[J]. BMC Pulm Med, 2020,20(1):2-7.
(收稿日期:2023-04-01 編辑:刘 斌)

