紫草素抑制PI3K/Akt/mTOR通路逆转人胃癌细胞奥沙利铂耐药
张 欣 霍浩然 秦瑞峰 胡建奇 袁增江
奥沙利铂是胃癌化疗一线用药,但胃癌细胞获得性耐药所致化疗敏感度降低是导致治疗失败的重要原因[1]。因此,寻找高效低毒的奥沙利铂耐药逆转剂对改善胃癌患者预后具有重要意义。磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphatidylinositol 3-kinase/protein kinase B/mammalian target of rapamycin,PI3K/Akt/mTOR)是调控细胞凋亡和自噬的关键信号通路,抑制PI3K/Akt/mTOR通路能够逆转肺腺癌顺铂耐药、乳腺癌他莫昔芬耐药、结肠癌氟尿嘧啶耐药[2~4]。紫草素是紫草的主要活性成分,有研究发现紫草素通过抑制PI3K/Akt/mTOR通路促进人结肠癌细胞、宫颈癌细胞等凋亡和自噬[5,6]。但紫草素能否通过抑制PI3K/Akt/mTOR通路逆转胃癌细胞奥沙利铂耐药尚鲜见报道,本研究以人胃癌奥沙利铂耐药细胞(MGC803/L-OHP)做为受试细胞,探讨紫草素对人胃癌细胞奥沙利铂耐药的影响及其机制。
材料与方法
1.材料:(1)细胞:MGC803/L-OHP细胞购自中国科学院细胞库(上海)。(2)药物与试剂:紫草素(纯度≥98%)购自中国药品生物制品检定所;奥沙利铂购自浙江海正药业股份有限公司;IGF-1(PI3K激活剂)购自美国Cell Signaling公司;CCK-8试剂盒、BCA 法蛋白定量试剂盒购自上海碧云天生物技术有限公司;RPMI1640培养基购自美国Sigma公司;GFP-LC3质粒、Lipofectamine 2000转染试剂购自南京谨庭生物有限公司;Annexin V-FITC/PI试剂盒购自美国Invitrogen公司;p-PI3K、p-Akt、p-mTOR、caspase-3、cleaved caspase-3抗体购自美国Cell Signaling公司;LC3、Beclin1、β-actin抗体购自英国Abcam公司。
2.细胞培养:MGC803/L-OHP细胞株经解冻复苏后,接种于含10%胎牛血清、1%青链霉素的RPMI1640培养基,置于细胞培养箱(37℃、5% CO2、饱和湿度)中培养,隔天换液1次,细胞融合至80%~90%时按1∶4传代培养。
3.CCK-8法检测不同浓度紫草素对MGC803/L-OHP细胞增殖抑制率及半抑制浓度(IC50):取对数生长期MGC803/L-OHP细胞,0.25%胰酶消化后制备单细胞悬液,1×104个/孔接种于96孔板,设0、2.5、5.0、10.0、20.0、40.0μmol/L紫草素组,各10个复孔。常规培养24h后,各组分别更换含有相应浓度药物的培养基继续培养24h,20微升/孔加入CCK-8试剂,避光孵育4h,通过酶标仪检测450nm处吸光度值(A),增殖抑制率(%)=(A空白对照组-A药物组)/A空白对照组×100%,计算IC50,重复3次实验取平均值。计算IC50为9.58μmol/L,后续实验紫草素浓度设定为10μmol/L。
4.分组与给药:取对数生长期MGC803/L-OHP细胞,1×104个/孔接种于96孔板和1×105个/孔接种于6孔板,设空白对照组、奥沙利铂(25μmol/L)组、紫草素+奥沙利铂(10μmol/L+25μmol/L)组、紫草素+奥沙利铂+IGF-1(10μmol/L+25μmol/L+10μmol/L)组[7,8]。培养24h后,各组分别更换含药培养基(空白对照组更换无药培养基)继续培养24h。
5.CCK-8法检测细胞增殖抑制率:每组随机取10孔(96孔板)药物干预24h后的MGC803/L-OHP细胞,通过CCK-8法检测细胞增殖抑制率。重复3次实验取平均值。
6.流式细胞术检测细胞凋亡:每组随机取10孔(6孔板)药物干预24h后的MGC803/L-OHP细胞,不含EDTA的0.25%胰蛋白酶消化后收集细胞,按照试剂盒操作说明,5微升/孔加入Annexin V-FITC染液、5微升/孔加入PI染液混匀后,避光孵育15min,通过流式细胞仪检测细胞凋亡状况。重复3次实验取平均值。
7.GFP-LC3质粒转染后观察自噬小体:取GFP-LC3质粒4μg加入RPMI1640培养基250μl,取Lipofectamine 2000转染试剂10μl加入RPMI1640培养基250μl,然后将二者加在一起轻轻混匀。每组随机取10孔(6孔板)药物干预24h后的MGC803/L-OHP细胞,2毫升/孔更换新培养基,500微升/孔逐滴加入GFP-LC3质粒/Lipofectamine 2000转染试剂混合液,轻轻混匀,避光培养5h,更换常规培养基继续培养48h后,通过荧光显微镜观察自噬小体形成状况(绿色荧光点即为自噬小体)。重复3次实验。
8.Western blot法检测蛋白表达:每组随机取10孔(6孔板)药物干预24h后的MGC803/L-OHP细胞,消化后收集细胞,加入RIPA裂解液冰上静置30min,4℃、12000r/min离心20min取上清,BCA法检测蛋白浓度,10% SDS-PAGE电泳分离蛋白、转PVDF膜、5%封闭液室温封闭1h后,滴加稀释后p-PI3K、p-Akt、p-mTOR、caspase-3、cleaved caspase-3、LC3、Beclin1、β-actin一体4℃孵育过夜,洗膜后滴加二抗室温孵育1.5h,ECL显影,以目标蛋白与β-actin蛋白条带灰度值的比值做为目标蛋白相对表达量。重复3次实验取平均值。

结 果
1.不同浓度紫草素对MGC803/L-OHP细胞增殖抑制率及IC50:紫草素0、2.5、5.0、10.0、20.0、40.0μmol/L组细胞增殖抑制率分别为0、20.43%±2.37%、37.61%±4.08%、52.49%±6.17%、62.84%±7.36%、70.29%±7.55%。紫草素对MGC803/L-OHP细胞增殖抑制率呈剂量依赖性(P<0.05),IC50为9.58μmol/L,后续实验紫草素浓度设定为10μmol/L(图1)。
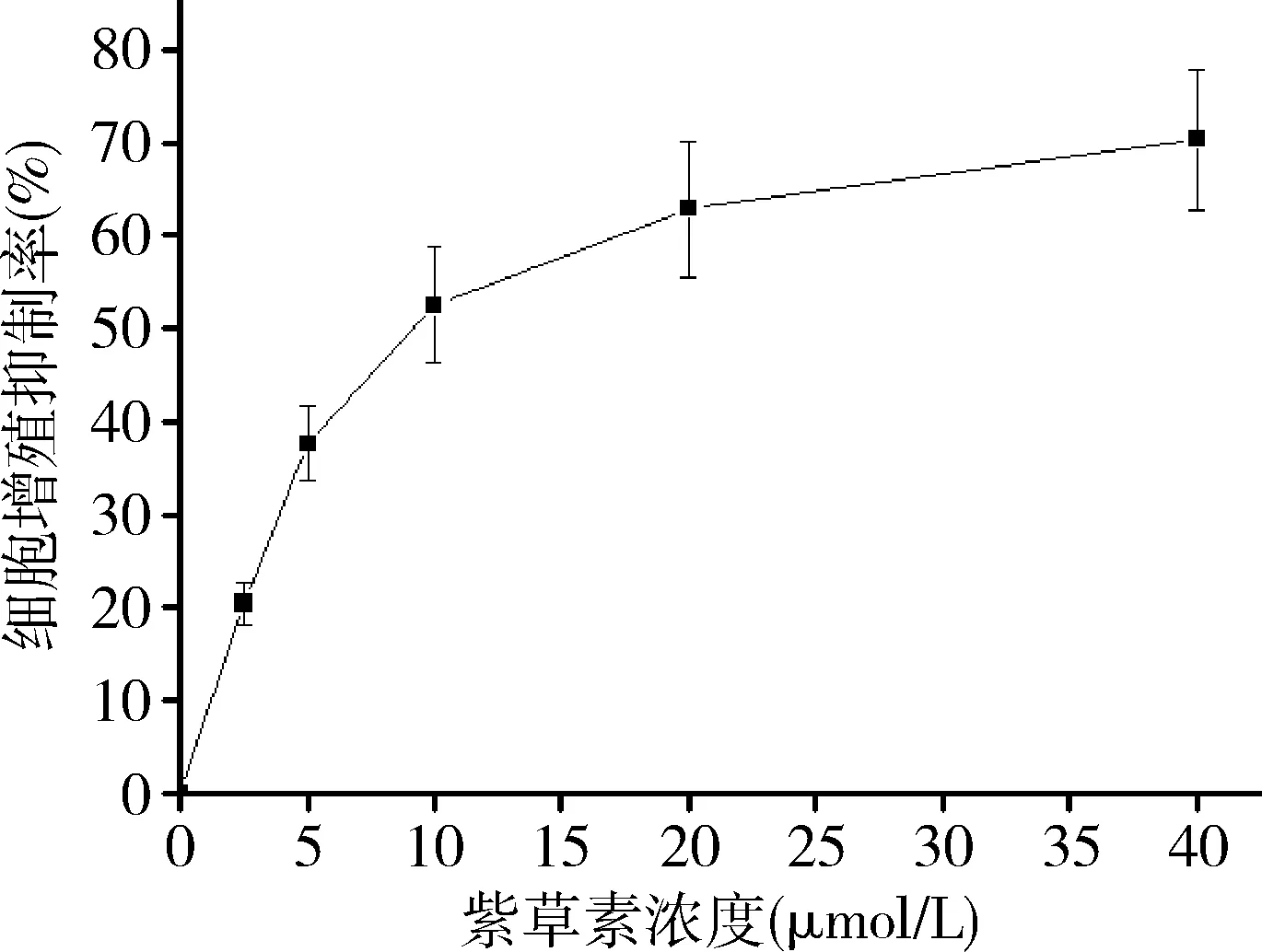
图1 不同浓度紫草素对MGC803/L-OHP细胞增殖抑制率
2.紫草素对MGC803/L-OHP细胞增殖和凋亡的影响:与空白对照组比较,奥沙利铂组细胞增殖抑制率和凋亡率升高(P<0.05);与奥沙利铂组比较,紫草素+奥沙利铂组细胞增殖抑制率和凋亡率升高(P<0.05);与紫草素+奥沙利铂组比较,紫草素+奥沙利铂+IGF-1组细胞增殖抑制率和凋亡率降低(P<0.05,图2、表1)。

表1 紫草素对MGC803/L-OHP细胞增殖抑制率和凋亡率的影响

图2 紫草素对MGC803/L-OHP细胞凋亡的影响A.空白对照组;B.奥沙利铂组;C.紫草素+奥沙利铂组;D.紫草素+奥沙利铂+IGF-1组
3.紫草素对MGC803/L-OHP细胞自噬的影响:与空白对照组比较,奥沙利铂组自噬小体数量增多;与奥沙利铂组比较,紫草素+奥沙利铂组自噬小体数量明显增多;与紫草素+奥沙利铂组比较,紫草素+奥沙利铂+IGF-1组自噬小体数量明显减少(图3)。

图3 紫草素对MGC803/L-OHP细胞自噬的影响A.空白对照组;B.奥沙利铂组;C.紫草素+奥沙利铂组;D.紫草素+奥沙利铂+IGF-1组
4.紫草素对MGC803/L-OHP细胞p-PI3K、p-Akt、p-mTOR蛋白表达的影响:与空白对照组比较,奥沙利铂组p-PI3K、p-Akt、p-mTOR表达量下调(P<0.05);与奥沙利铂组比较,紫草素+奥沙利铂组p-PI3K、p-Akt、p-mTOR表达量下调(P<0.05);与紫草素+奥沙利铂组比较,紫草素+奥沙利铂+IGF-1组p-PI3K、p-Akt、p-mTOR表达量上调(P<0.05,图4、表2)。

表2 紫草素对MGC803/L-OHP细胞p-PI3K、p-Akt、p-mTOR蛋白表达的影响

图4 紫草素对MGC803/L-OHP细胞p-PI3K、p-Akt、p-mTOR蛋白表达的影响A.空白对照组;B.奥沙利铂组;C.紫草素+奥沙利铂组;D.紫草素+奥沙利铂+IGF-1组
5.紫草素对MGC803/L-OHP细胞caspase-3、cleaved caspase-3蛋白表达的影响:与空白对照组比较,奥沙利铂组caspase-3、cleaved caspase-3表达上调,cleaved caspase-3/caspase-3比值升高(P<0.05);与奥沙利铂组比较,紫草素+奥沙利铂组caspase-3、cleaved caspase-3表达上调,cleaved caspase-3/caspase-3比值升高(P<0.05);与紫草素+奥沙利铂组比较,紫草素+奥沙利铂+IGF-1组caspase-3、cleaved caspase-3表达下调,cleaved caspase-3/caspase-3比值降低(P<0.05,图5、表3)。

表3 紫草素对MGC803/L-OHP细胞caspase-3、cleaved caspase-3蛋白表达及cleaved caspase-3/caspase-3比值的影响
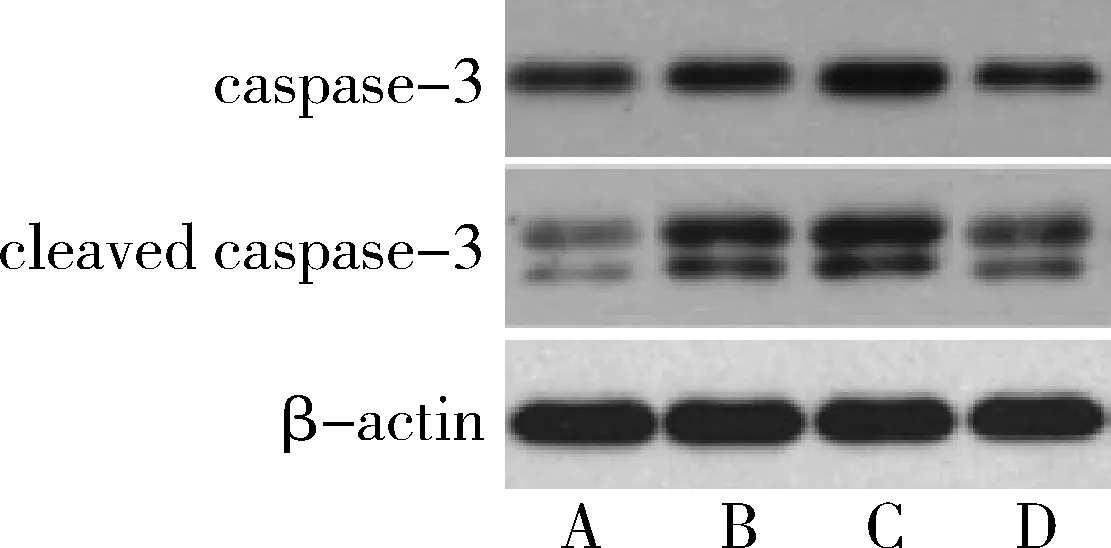
图5 紫草素对MGC803/L-OHP细胞caspase-3、cleaved caspase-3蛋白表达的影响A.空白对照组;B.奥沙利铂组;C.紫草素+奥沙利铂组;D.紫草素+奥沙利铂+IGF-1组
6.紫草素对MGC803/L-OHP细胞LC3、Beclin1蛋白表达的影响:与空白对照组比较,奥沙利铂组LC3-Ⅰ、LC3-Ⅱ、Beclin1表达上调,LC3-Ⅱ/LC3-Ⅰ比值升高(P<0.05);与奥沙利铂组比较,紫草素+奥沙利铂组LC3-Ⅰ、LC3-Ⅱ、Beclin1表达上调,LC3-Ⅱ/LC3-Ⅰ比值升高(P<0.05);与紫草素+奥沙利铂组比较,紫草素+奥沙利铂+IGF-1组LC3-Ⅰ、LC3-Ⅱ、Beclin1表达下调,LC3-Ⅱ/LC3-Ⅰ比值降低(P<0.05,图6、表4)。

表4 紫草素对MGC803/L-OHP细胞LC3、Beclin1蛋白表达及LC3-Ⅱ/ LC3-Ⅰ比值的影响

图6 紫草素对MGC803/L-OHP细胞LC3、Beclin1蛋白表达的影响A.空白对照组;B.奥沙利铂组;C.紫草素+奥沙利铂组;D.紫草素+奥沙利铂+IGF-1组
讨 论
紫草素是中药紫草的主要活性成分,具有抗炎、增强机体免疫力等药理学作用[9,10]。近年来,紫草素抗肿瘤活性被发现并深入挖掘,已证实紫草素能够逆转人肺腺癌细胞、卵巢癌细胞顺铂耐药[11,12]。本研究发现,紫草素对MGC803/L- OHP细胞具有剂量依赖性的增殖抑制作用;与奥沙利铂单药干预比较,紫草素+奥沙利铂联合能够显著提高MGC803/L-OHP细胞增殖抑制率,而紫草素+奥沙利铂+IGF-1组细胞增殖抑制率明显低于紫草素+奥沙利铂组。提示紫草素可逆转人胃癌细胞奥沙利铂耐药,而该作用能够被PI3K激活剂IGF-1明显逆转。
诱导细胞凋亡与自噬是铂类药物抗肿瘤的主要机制。caspase-3可被细胞色素C等诱导活化,cleaved caspase-3能够切割细胞膜结构蛋白、核蛋白并破坏核酸、DNA等结构而导致细胞凋亡[13]。LC3是细胞自噬过程发生的标志性蛋白,具有两种亚型(无活性LC3-Ⅰ,具有促细胞自噬活性的LC3-Ⅱ),生理状态下LC3主要以LC3-Ⅰ亚型存在,自噬发生时LC3-Ⅰ被剪切活化生成LC3-Ⅱ,所以LC3-Ⅱ/ LC3-Ⅰ比值能够反映LC3蛋白活化程度及细胞自噬水平。Akt为PI3K下游靶基因,是细胞凋亡和自噬过程重要的信号转导因子。PI3K活化形式p-PI3K能够诱导Akt磷酸化,p-Akt则能够诱导cleaved caspase-3磷酸化而失去促凋亡活性[14]。
p-Akt能够诱导mTOR磷酸化,p-mTOR则能够加速细胞周期运转而促进细胞增殖、能够抑制泛素蛋白表达而抑制细胞自噬[15]。Beclin1是LC3-Ⅱ转运蛋白,转移LC3-Ⅱ到自噬体膜发挥促细胞自噬作用,而p-mTOR能够诱导Beclin1磷酸化失活而间接抑制细胞自噬[16]。本研究发现,与奥沙利铂单药干预比较,紫草素+奥沙利铂联合能够明显提高MGC803/L-OHP细胞凋亡率和自噬小体数量,下调p-PI3K、p-Akt、p-mTOR表达,上调cleaved caspase-3、LC3-Ⅰ、LC3-Ⅱ、Beclin1表达,提高cleaved caspase-3/caspase-3、LC3-Ⅱ/ LC3-Ⅰ比值;PI3K激活剂IGF1能够明显逆转上述紫草素+奥沙利铂联合干预作用。提示促进细胞凋亡和自噬可能是紫草素逆转人胃癌细胞奥沙利铂耐药的重要机制,可能与抑制PI3K/Akt/mTOR通路而上调凋亡和自噬相关蛋白表达有关。
综上所述,紫草素可逆转人胃癌细胞奥沙利铂耐药,其作用机制可能与抑制PI3K/Akt/mTOR通路而促进胃癌细胞凋亡和自噬有关。本研究结果为紫草素做为胃癌化疗辅助用药提供了实验依据,但其作用机制还需进一步研究。

