CO2麻醉对大口黑鲈保活模拟运输效果的影响
王肇鼎,李 宁,白 婵,王炬光,柴 毅,熊光权
(1.长江大学动物科学技术学院/农学院,湖北 荆州 434023;2.湖北省农业科学院农产品加工与核农技术研究所/农业农村部农产品冷链物流技术重点实验室,湖北 武汉 430064;3.洪湖市农业农村局,湖北 荆州 4 332003;4.湖北省农业科技创新中心农产品加工研究分中心,湖北 武汉 430064)
大口黑鲈(Micropterus salmoides)是我国重要经济鱼类之一[1],其无棘间刺、味道鲜美、营养丰富、经济价值高并且抗病能力强[2],在我国广东、浙江、江苏等地广泛养殖,2022年产量超过80万t[3]。鲜活大口黑鲈的市场需求日益增长,目前长时间远距离运输市场需求量大。
在活鱼的运输过程中,高密度运输[4]、装卸[5]、捕捞[6]及运输过程中氨的积累[7]等会造成应激反应,影响运输后水产动物的存活率。采取麻醉后进行保活运输可以减轻鱼的应激反应,使鱼平静,减少运动,降低运输中的压力和疼痛[8]。目前国内外批准用于食用鱼的麻醉药物数量有限且具有特殊预防措施[9],如美国食品药品监督管理局(FDA)批准唯一鱼类麻醉药MS-222 使用后需要经过21 d 休药期才能食用[10],而苯佐卡因和丁香酚等新型麻醉剂由于药物消退期问题也存在争议[11]。CO2从1943年起就被认为是鱼体有效麻醉剂[12],作为公认的安全(GRAS)食品成分[8],CO2麻醉后运输的鱼不存在食品安全方面问题。
CO2麻醉作为麻醉剂在广泛温度范围内均有效,但长时间CO2麻醉会减弱呼吸频率,使鱼体内有氧呼吸转变为无氧呼吸,可能导致鱼类呼吸衰竭致死,因此其毒性在很大程度上与水温和使用时长有关[13-15]。目前关于CO2麻醉运输大口黑鲈相关研究报道较少。本研究通过单因素实验确定最佳运输水温和CO2麻醉浓度,在最佳条件下探究CO2麻醉处理对保活运输过程中大口黑鲈血清中皮质醇、葡萄糖含量,乳酸脱氢酶、谷草转氨酶活性等的影响,肌肉中蛋白质、乳酸、糖原含量等指标的影响,以达到提高大口黑鲈运输后存活率和运输效果的目的,同时为CO2麻醉使用安全提供理论基础。
1 材料与方法
1.1 材料与试剂
大口黑鲈(M.salmoides)购自湖北省嘉鱼县三湖渔业有限责任公司,用装满充氧淡水的1 t运输罐将健康无病、生长趋势良好的大口黑鲈迅速运输至实验场地,运输罐上覆盖黑色塑料布以减少运输途中产生的应激反应。实验前,将大口黑鲈放置在直径100 cm、高90 cm 的圆柱形循环缸(水温12~15 ℃,pH 7.3±0.1,溶氧量5.5~7.5 mg/L)中暂养大口黑鲈以确保状态稳定。暂养时每天投喂一次通威加州鲈膨化配合饲料,实验前停饲24 h。实验时,大口黑鲈的平均体质量为(509.0 ± 26.8)g,平均体长为(32.95±1.65)cm。
纳氏试剂购自平根科技检测技术服务中心;酒石酸钾钠溶液购自江标检测科技有限公司。皮质醇(Cortisol,COR)试剂盒购买自武汉纯度生物科技有限公司;葡萄糖(Glucose,GLU)、肌酐(Creatinine,CR)、尿素氮(Blood urea nitrogen,BUN)、谷草转氨酶(Aspartate aminotransferase,AST)、谷丙转氨酶(Alanine amiotransferase,ALT)、乳酸脱氢酶(Lactate sehydrogenase,LDH)、乳酸(Lactic acid,LD)、糖原(Glycogen,GLY)含量测定试剂盒均购买自南京建成生物工程研究所。
1.2 仪器与设备
3K15 高速冷冻离心机(德国Sigma 公司);HITACH UH5300 紫外可见分光光度计(日本HITACHI 公司);多功能酶标仪SPARK(瑞士Tecan仪器公司);BT25S 电子分析天平(精度0.001 g,德国Sartorius 公司);HQ40 哈希HACH 便携式双路输入多参数数字化分析仪(上海哈希水质分析仪器有限公司);便携式氨氮测定仪(杭州齐威仪器有限公司);FE28 pH 计(瑞士梅特勒-托利多国际有限公司);全自动凯氏定氮仪(海能仪器)。
1.3 CO2麻醉和保活运输大口黑鲈的条件确定
1.3.1 大口黑鲈麻醉和复苏时间测定 从暂养水箱中随机网取20 尾大口黑鲈放入装有15 L 曝气后实验用水的玻璃鱼缸中,分别在7 ℃和14 ℃时通入V(CO2)∶V(O2)=1∶1(流速为0.1 L/ min)的混合气体,每个实验组设置3 个平行组(n=3)。参照Holloway 等[15]的分期标准,通过观察大口黑鲈行为判断麻醉阶段,用秒表记录进入各麻醉阶段的时间,用CO2测定仪测定水体CO2含量,并根据鳃盖运动以确定各阶段的呼吸频率[16]。当大口黑鲈处于不同麻醉状态时,将大口黑鲈转入相同水温装有15 L曝气后实验用水的玻璃鱼缸中进行复苏,通过观察大口黑鲈的行为判断大口黑鲈复苏状态,用秒表记录鱼体平衡可以自由游动,反应恢复灵敏阶段(R4)的时间。采取同一观察者进行大口黑鲈行为特征的观察、麻醉和复苏阶段的判断并进行时间记录。
1.3.2 麻醉时水温的测定 从暂养水箱中随机网取20尾大口黑鲈,放置在装有15 L曝气后实验用水的玻璃鱼缸中模拟保活,分别在水温5、10、15、20 和25 ℃时通入V(CO2)∶V(O2)=1∶1(流速为0.1 L/min,CO2质量浓度为1.8 g/L)的混合气体,每个实验组设置3 个平行组(n=3)。在模拟保活的12、24、36 和48 h进行复苏,记录大口黑鲈死亡数,计算平均存活率,筛选最佳的麻醉时水温。
1.3.3 麻醉时CO2浓度的测定 从暂养水箱中随机网取20 尾大口黑鲈放置在装有15 L 曝气后的实验用水的玻璃鱼缸中,水温控制在15 ℃,然后分别通入V(CO2)∶V(O2)=1∶1(流速为0.1 L/min)的混合气体3、4、6、8 min,静置8 min。用CO2测定仪测量玻璃水缸中CO2质量浓度分别为1.8、4.8、6.8 和9.8 g/L。在上述四种CO2浓度下对鱼进行保活模拟运输,以不添加CO2的组作为对照组,每个实验组设置3个平行组(n=3)。在保活模拟运输的24、48、72和96 h 记录大口黑鲈的死亡数,计算平均存活率,筛选最佳的麻醉时CO2浓度。
1.3.4 模拟运输 从暂养水箱中随机网取20尾大口黑鲈放入装有15 L 曝气后实验用水的玻璃鱼缸中,根据1.3.3和1.3.4节的结果选取水温15 ℃和CO2质量浓度6.8 g/L 为CO2处理组,以不添加CO2的组作为对照组,在黑暗中进行模拟运输。其间每0.5 h振荡3 次,震荡条件为90 次/min,振荡5 min。分别在保活模拟运输的0、12、24、36 和48 h 随机选择5 尾鱼,擦拭干净鱼表皮黏液,用注射器从尾部血管采集1.5 mL 血液,单尾鱼只采样一次。然后迅速解剖鱼体,收集肝脏和每尾鱼同侧面侧线上头部到背鳍之间鱼背肌肉(长、宽、高为3、1、1 cm)组织,用0.01 mol/L 磷酸盐缓冲液(PBS,pH:7.4)清洗后,放置于无菌无酶的10 mL 离心管中用液氮迅速冷冻后,保存于-80 ℃冰箱待用。
1.4 指标测定
1.4.1 水中氨氮的测定 在1.3.4的保活模拟运输的0、24、48 和72 h 分别取水样,参照HJ 535—2009《水质氨氮的测定纳氏试剂分光光度法》[17]进行水中总氨氮浓度的测定。
1.4.2 生化指标测定 全血样品在4 ℃下静置4 h,待血液分层后在4 000 r/min 条件下离心10 min,小心吸取上层血清置于10 mL 离心管,保存于-80 ℃冰箱。保存过程中如若出现沉淀则同样条件再次离心。吸取上层血清分装于离心管,冰水浴中解冻血清样本,然后根据检测试剂盒(南京建成生物工程研究所,)操作步骤测定GLU、CR、BUN、AST、ALT、LDH和LD等指标。
1.4.3 肌肉营养成分的测定 称取1 g 左右冻存鱼肉,按照质量∶体积=1 g∶9 mL 的比例加入4 ℃的质量分数0.65%生理盐水,在冰水浴中匀浆,然后在4 ℃、2 500 r/min 条件下离心20 min,仔细收集质量分数10%的组织匀浆上清液,保存于-80 ℃冰箱备用。根据检测试剂盒(南京建成生物工程研究所)说明书操作步骤测定大口黑鲈组织的GLY、LD 等指标。蛋白质含量测定采用凯氏定氮法(GB 5009.5—2016)[18]进行。水分含量的测定采用直接干燥法(GB 5009.3—2016)[18]进行。
1.5 统计分析
实验均进行三次重复。实验结果为各测定值的平均值± 标准差。用SPSS 19.0 进行统计分析,组间差异采用单因素方差分析(One-way ANOVA),显著性差异检验采用Duncan's 检验,显著性水平α=0.05,用Graphpad Prism 8作图。
2 结果与分析
2.1 模拟保活运输水温对大口黑鲈麻醉和复苏时间的影响
参照Summerfelt[19]和Prince 等[20]对麻醉有效阶段的定义、Holloway 等的分类标准[15],结合大口黑鲈的实际情况,麻醉阶段和复苏阶段分期及相应时间记录如表1。大口黑鲈达到失去平衡、丧失肌肉张力的A4 阶段,在7 ℃下需要15.23 min,而在14 ℃下仅需10.33 min。达到鱼体恢复平衡可以自由游动、反应恢复灵敏的R4 阶段,在水温为7 ℃时需要10.20 min,14 ℃时仅需要3.53 min。复苏24 h后大口黑鲈的存活率随着温度的上升而提高,当水温为7 ℃时,60%的鱼能存活24 h。当温度为14 ℃时,大口黑鲈存活率可达100%。结果表明,水温较低时,大口黑鲈进入麻醉期的时间和麻醉之后的复苏时间延长,并且影响麻醉后的存活率。这可能是因为温度越低,CO2通过鱼鳃进入体内的渗透速率减慢,鱼体的代谢速率低、能量消耗减少,导致麻醉时间和复苏时间都增加[13]。根据Marking 等研究[10],理想麻醉剂的诱导时间应该在3 min 以内,恢复时间在5 min以内,并且根据Summerfelt等[21]列出的理想麻醉剂应有特征,本研究中所使用的的CO2是大口黑鲈的理想麻醉剂。

表1 水温对大口黑鲈麻醉和复苏时间的影响Table 1 Effect of water temperature on anesthesia and resuscitation of largemouth bass(Lepomis macrochirus)
2.2 运输水温和CO2浓度对大口黑鲈存活率的影响
由图1(a)可得,随着运输时间的延长,各温度组大口黑鲈存活率逐渐下降。5 ℃组的大口黑鲈在运输24 h 出现死亡,10 和20 ℃组在运输36 h 出现死亡,15 ℃组在运输48 h 出现死亡,25 ℃组在运输12 h 出现死亡。运输48 h,水温10 ℃和15 ℃下大口黑鲈存活率较高,为90.00%和86.67%。由此可知,在本研究条件下对大口黑鲈进行保活运输时,运输最佳水温为15 ℃。由于鱼类的细胞结构和功能只能在特定的温度范围内保持,所以温度变化会导致鱼类应激致死[22]。当水温较低时,大口黑鲈存活率下降,可能是低温应激导致鱼类细胞功能障碍并且刺激了相关凋亡基因的表达[21]。而在水温较高时,CO2通过渗透调节方面具有重要作用的鳃[23]进入鱼体的渗透速率加快,虽然麻醉作用下鳃盖运动减少导致大口黑鲈通气量减少,但这并不阻碍CO2进入血流[15],此时CO2大量累积在血液中,导致大口黑鲈在运输过程中麻醉致死。因此CO2麻醉大口黑鲈进行保活运输时,适宜选取水温为15 ℃。这与Tan 等[22]认为低温结合CO2麻醉可有效延长大黄鱼(Pseudosciaena crocea)存活率结果相似。

图1 不同水温和CO2质量浓度对模拟保活运输大口黑鲈存活率的影响Fig.1 Effects of water temperature and CO2 concentration on the survival rate of largemouth bass(Lepomis macrochirus)
由图1(b)可知,随着运输时间的延长,各CO2处理组大口黑鲈存活率逐渐下降。在水温为15 ℃、CO2质量浓度为4.8、6.8 g/L 时,大口黑鲈模拟保活运输96 h后存活率仍为100%,此时CO2质量浓度为1.8 g/L 和9.8 g/L 组大口黑鲈全部死亡,对照组存活率为50.67 %。模拟运输24 h,CO2质量浓度为9.8 g/L 组存活率为50.67%,其余组为100%。模拟运输48 h,对照组、1.8 g/L 组和9.8 g/L 组存活率分别为83.67%、60.67%和20.67%。模拟运输72 h,对照组和1.8 g/L 组存活率为66.33%和30.33%,而9.8 g/L 组鱼全部死亡。以上结果表明,使用CO2进行麻醉时,浓度过高或过低均不利于鱼类存活,本研究条件下CO2最佳麻醉质量浓度为4.8、6.8 g/L。低浓度CO2会导致麻醉过程不能达到鱼类麻醉标准[15],使大口黑鲈未处于低代谢、低能量消耗状态,导致麻醉后鱼体提前复苏,产生急性应激反应,并且麻醉本身会导致轻度或中度应激反应[24]。随着CO2浓度的增加和运输时间的延长,大口黑鲈体内的CO2含量也不断累计,高CO2含量会影响鱼类体内的酸碱平衡[25],从而影响CO2麻醉后鱼类的存活率。
2.3 不同CO2浓度对模拟保活运输水中氨氮含量的影响
由图2可知,随着模拟运输时间的延长,对照组及各CO2浓度组水中氨氮含量均有一定增加,但相较于对照组增加较少。同一运输时间下,CO2浓度增加,水中氨氮的含量反而逐渐减少。这表明通入CO2可一定程度抑制水中氨氮含量的上升。但经9.8 g/L CO2麻醉的大口黑鲈模拟运输组率先出现死亡现象,这可能是实验过程中排泄的CO2、氨积累及不良的水交换使水质降低[7],同时鱼被CO2过度麻醉造成高碳酸血症导致的[8],同时CO2浓度的增加会导致血液和组织呼吸色素酸化,使氧气摄入和输送的减少[26]。Rimmer 等[27]也认为运输过程中的封闭水体水质的变化主要受CO2的影响,与本研究结果相似。
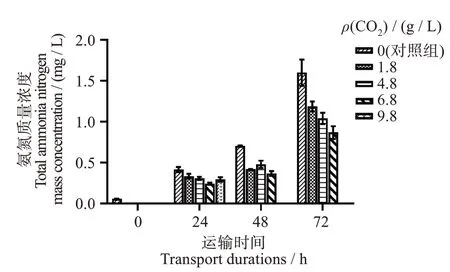
图2 不同CO2浓度对模拟运输过程中氨氮浓度的影响Fig.2 Effect of different CO2 concentrations on ammonianitrogen concentration during simulated transport
2.4 CO2麻醉对模拟保活运输大口黑鲈血清生化指标的影响
如图3(a)所示,在模拟保活运输过程中,6.8 g/L CO2麻醉处理组血清中COR 质量浓度低于对照组,且CO2处理组在各运输时间点之间具有显著差异(P<0.05),对照组在运输12、36 h 血清中COR 质量浓度无显著差异(P>0.05)。随着运输时间的增加,CO2处理组血清中COR 含量呈现先降低(0~12 h)后升高(12~48 h)的趋势,这可能是因为CO2麻醉降低了鱼类的新陈代谢并补偿了温度变化引起的应激[22],而随着运输时间增长,应激导致促肾上腺皮质激素释放,从而引起COR 合成和分泌,导致COR在运输后期出现峰值[28-29]。
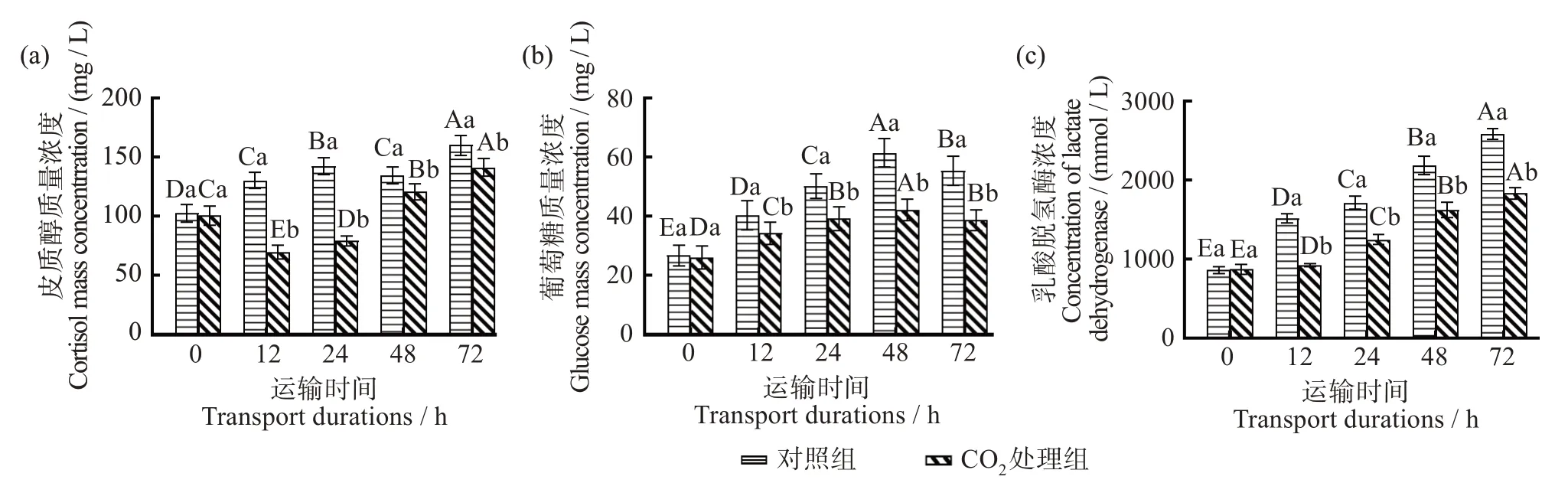
图3 CO2麻醉对模拟保活运输大口黑鲈血清中皮质醇、葡萄糖和乳酸脱氢酶的影响Fig.3 Effects of CO2 anesthesia on COR(a),GLU(b),and LDH(c)in the serum of simulated live-transported largemouth bass(Lepomis macrochirus)
如图3(b)所示,在保活模拟运输过程中,大口黑鲈血清中GLU 含量在0~36 h 呈增长趋势,之后下降。各运输时间之间具有显著差异(P<0.05),且对照组血清中的GLU 含量显著高于CO2处理组(P<0.05)。可能是因为运输前期血液中COR 含量增加导致糖原分解、糖异生作用加强[16],另外此时麻醉的鱼呼吸频率减缓,血液中会释放相对较高的儿茶酚胺,也会引起GLU 升高[30]。但后期模拟运输时间增加,长期饥饿使糖原脱支酶被抑制,糖原分解减少,GLU含量减少[31]。
LDH 可反映糖原分解产生乳酸的程度和葡萄糖厌氧代谢的程度。如图3(c)所示,在进行保活模拟运输的过程中,随着运输时间的增加,大口黑鲈LDH 摩尔浓度不断增加,且对照组和CO2处理组之间均具有显著差异(P<0.05),运输12~48 h 间对照组中LDH 摩尔浓度显著高于CO2处理组(P<0.05),可能是因为运输前期血液中GLU 含量上升,为处于应激状态下的需氧组织(心脏或鳃)提供能量[29],但CO2处理组麻醉时鳃盖运动、通气频率、通气量减少[28],组织氧供应减少从需氧代谢转换为无氧代谢[32],相较于对照组消耗了更少的能量,有更多的能量供给应激状态下的需氧组织(心脏或鳃),从而减少了由于鱼类应激导致心肌细胞的破损,降低了心肌细胞中LDH 的流出,从而CO2处理组血清中LDH 摩尔浓度显著低于对照组(P<0.05),表明经CO2麻醉处理之后进行保活模拟运输可以减轻因应激导致的心肌损伤。
由图4(a、b)可知,AST 活性在CO2处理组和对照组的各模拟运输时间之间均有显著差异(P<0.05),且同一时间下对照组AST 活性显著高于CO2处理组(P<0.05)。随着运输时间的延长,AST活性也增加,在模拟运输48 h 时,AST 活性达到最高,为(26.85± 1.93)U/L。CO2处理组ALT 活性在各模拟运输时间之间存在显著差异(P<0.05),对照组在运输0~12 h不具有显著差异(P>0.05),随着运输时间的延长,ALT活性增加,CO2处理组ALT活性在模拟运输48 h 时达到最高,为(43.00 ± 1.93)U/L。AST 作为生物体内作用于氨代谢的酶,在心肌中广泛分布[33]。ALT可以协助糖异生产生葡萄糖和氨基酸代谢,并作为应激中肝脏受损的主要指标[13]。在保活模拟运输过程中,大口黑鲈产生应激反应,导致机体细胞损伤、凋亡基因表达,AST 和ALT 作为细胞损伤和死亡的标志物在血流中释放,引起血清中AST和ALT质量浓度上升[16]。
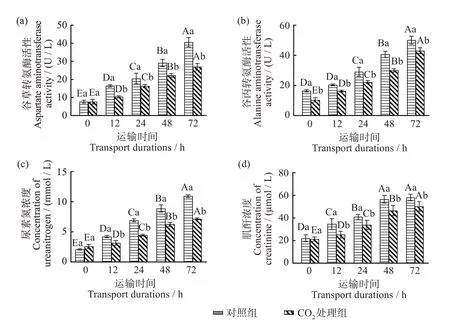
图4 CO2麻醉对模拟保活运输大口黑鲈血清中谷草转氨酶、谷丙转氨酶、尿素氮和肌酐的影响Fig.4 Effects of CO2 anesthesia on AST(a),ALT(b),BUN(c)and CR(d)in the serum of simulated live-transported largemouth bass(Lepomis macrochirus)
BUN 作为鱼体内除氨外的重要含氮排泄物,经常被用作肾损伤指标[34]。CR 水平升高说明结构损伤导致肾功能障碍[35]、肾小球滤过率能力降低和血液中产生许多不会被清除的废物[36]。由图4(c、d)可知,CO2处理组的BUN 和CR 浓度在各模拟运输时间均差异显著(P<0.05),并且随着运输时间不断增加,对照组BUN和CR浓度均大于CO2处理组,说明对照组大口黑鲈在模拟运输过程中发生了肾功能损害,CO2处理减轻了大口黑鲈的应激反应、新陈代谢水平和呼吸频率,使血液中BUN、CR 的流入量减少。
2.5 CO2麻醉对模拟保活运输大口黑鲈肌肉营养成分的影响
由图5(a)可知,随着运输时间的增加,鱼背肌肉中蛋白质质量分数整体呈下降趋势,CO2处理组在12~48 h 之间蛋白质质量分数显著高于对照组(P<0.05)。随着运输时间的增长,鱼背肌肉中蛋白质质量分数下降,一方面是因为鱼类在运输过程中降解一些营养物质(糖原、蛋白质等)为生物体提供营养并使其保持活力[37],另一方面,不利的环境因素(运输过程中的振动)不断刺激鱼体消耗能量,从而促进能量供应物质的分解[38],并且随着运输时间的增加,机体pH 降低酸化也会抑制蛋白质的生物合成[39]。
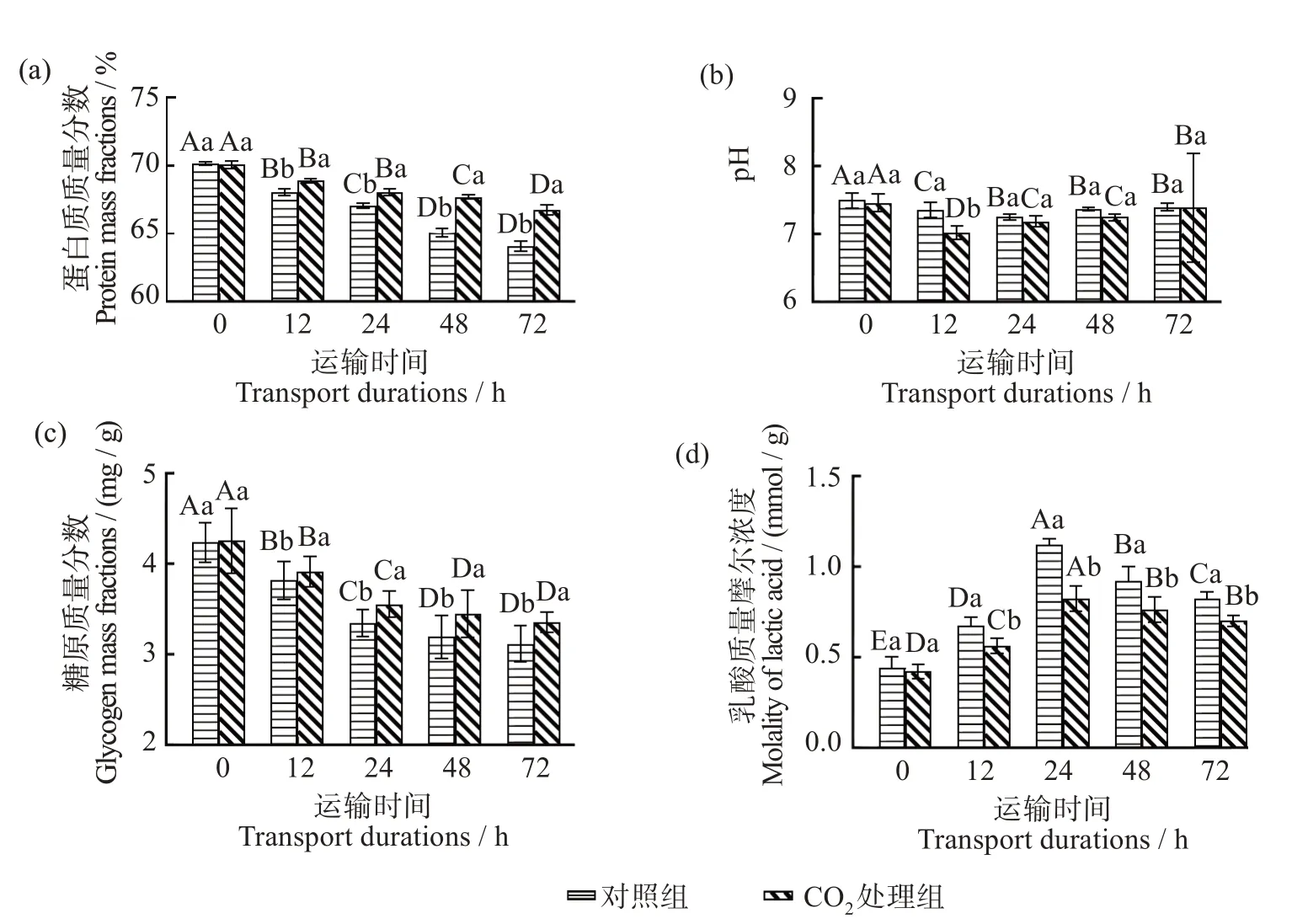
图5 CO2麻醉对模拟保活运输大口黑鲈肌肉蛋白质、pH值、糖原和乳酸的影响Fig.5 Effect of CO2 anesthesia on protein(a),pH(b),GLY(c)and LD(d)in the muscle of simulated live-transported largemouth bass(Lepomis macrochirus)
由图5(b-d)可知,随着运输时间延长,pH 在运输中呈现先降低(0~12 h)后升高(12~48 h)的趋势,但CO2处理组和对照组的pH 差异不显著(P>0.05)。在运输过程中对照组乳酸质量摩尔浓度显著高于CO2处理组(P<0.05),随着运输时间延长,呈现先升高后降低趋势,在运输24 h 最高,此时CO2处理组和对照组乳酸质量摩尔浓度分别为(0.82 ± 0.07)和(1.12 ± 0.03)mmol/g。糖原质量分数在模拟运输过程中呈现下降趋势,且0~36 h 间变化显著(P<0.05),CO2处理组在运输过程中糖原质量分数显著高于对照组(P<0.05)。经过长时间模拟运输,血液中CO2浓度增加,CO2分压增大使鱼类呼吸性酸中毒导致高碳酸血症[40],而高碳酸血症会导致组织产生大量乳酸[41],并且模拟运输过程中低温缺氧也会导致体内乳酸积累,同时糖原会被分解产生乳酸,糖酵解途径转变为脂肪分解代谢[42],因此糖原含量随模拟运输时间的增长而下降,乳酸含量随模拟运输时间的增长而上升。运输早期糖原被分解产生乳酸会降低pH,在机体酸化和pH 降低的情况下,鱼体通过儿茶酚胺蛋白进行离子交换来提高pH[43],并且蛋白质分解产生的碱性物质也会导致pH 上升[44],所以模拟运输过程中pH 呈现先降后升趋势。
3 结论
本研究发现,7 ℃相较于14 ℃大口黑鲈进入麻醉和恢复阶段需要更长的时间,并且恢复24 h 后14 ℃组存活率为100%,7 ℃组存活率仅为60%,说明麻醉温度会影响大口黑鲈体内代谢速率和存活率。随着运输时间的增加,水中氨氮浓度呈现增加的趋势,其中CO2处理组水中氨氮浓度低于对照组,表明通入CO2可一定程度抑制水中氨氮含量的上升,延缓水质恶化速度。确定大口黑鲈进行模拟保活运输采用15 ℃水温,6.8 g/L CO2麻醉时运输效果最佳,此条件可以减轻大口黑鲈在模拟运输过程中的应激反应,使COR、GLU、LDH、AST、ALT、BUN和CR 等指标随着运输时间的延长,其在体内增加的水平显著低于对照组(P<0.05),可以减少运输过程中肌肉乳酸的产生量,减缓运输过程中肌肉蛋白质及糖原的流失速率,但同时也减弱了大口黑鲈的呼吸频率,使大口黑鲈体内有氧呼吸转变为无氧呼吸,导致体内肝肾受损,进而影响存活率。因此,建议采用水温为15 ℃,CO2质量浓度为6.8 g/L 保活运输大口黑鲈时运输时长不宜超过36 h。

