二(2,4,4-三甲基戊基)二硫代膦酸-2,2′-联吡啶协萃体系分离三价镧系/锕系离子
方 拓,郭琦玲,柳 倩,金 畅,朱礼洋,*,杨素亮,*,田国新,2
(1.中国原子能科学研究院 放射化学研究所,北京 102413;2.清华大学 核能与新能源技术研究院,北京 100084)
闭式核燃料循环体系中,通常先通过Purex流程将乏燃料中的铀和钚提取出来,而将超钚元素(镅、锔等)、镧系元素与其他裂片元素一起留在高放废液中。采用分离-嬗变策略处理高放废液时,首先要对锕系及镧系进行共萃取分离,再对锕系和镧系进行分离(即将镅、锔与镧系元素分离),然后对镅和锔进行分离,最终在嬗变装置中将分离出的长寿命易嬗变核素转化为稳定核素或短寿命核素[1]。由于三价镧系离子(Ln(Ⅲ))和三价锕系离子(An(Ⅲ))的电荷相同、离子半径相近,因此它们的化学性质非常相似[2],导致它们之间的分离非常困难。经过几十年的探索,研究人员开发了几个有应用前景的三价镧系和锕系分离流程[3-5],其中研究较多的是清华大学开发的以纯化Cyanex 301为萃取剂的分离流程[6-7]。
Cyanex 301是一种应用于冶金工业的商用萃取剂,其主要成分为二(2,4,4-三甲基戊基)二硫代膦酸(HBTMPDTP,简写为HA),纯度(质量分数)在70%左右[8]。经过纯化的Cyanex 301 (纯度>99%)对An(Ⅲ)表现出很好的选择性萃取能力,并已经过热实验验证[9]。此外,不同于二(2-乙基己基)磷酸酯(P204,HDEHP)等常见稀土分离萃取剂,纯化Cyanex 301对Am(Ⅲ)和Cm(Ⅲ)也有较好分离效果[10]。但该流程在工业应用中也有不理想之处,首先是需要在较高pH值条件下进行萃取分离,体系酸度控制要求高,实际应用操作窗口小;其次是Am(Ⅲ)和Cm(Ⅲ)的分离效果仍需进一步提高。
为改善上述问题,本文在纯化Cyanex 301-煤油萃取体系中引入2,2′-联吡啶作为协萃剂,研究该体系在不同条件下萃取分离Ln(Ⅲ)/An(Ⅲ)以及Am(Ⅲ)/Cm(Ⅲ)的性能和机理。其中,Ln(Ⅲ)以离子半径与Am(Ⅲ)/Cm(Ⅲ)较接近的Nd(Ⅲ)和Eu(Ⅲ)为代表。
1 实验
1.1 主要试剂与仪器
Cyanex 301粗产品(含约70%的二(2,4,4-三甲基戊基)二硫代膦酸),清华大学核能与新能源技术研究院提供,用铵盐法进行纯化后得到纯化的二(2,4,4-三甲基戊基)二硫代膦酸(结构如图1a所示)产品,经31P核磁分析及标准碱溶液滴定分析,所得纯化产物的纯度>99%[8];煤油,试剂级,阿拉丁公司产品;241Am(Ⅲ)、244Cm(Ⅲ)示踪剂溶液,介质为1.0 mol/L HNO3溶液,原子高科股份有限公司;硝酸铕、硝酸钕及硝酸钠,纯度>99.9%,Alfa Aesar公司;2,2′-联吡啶(结构如图1 b所示,本文中简写为B),分析纯,阿拉丁公司,室温下在煤油中溶解度约为0.06 mol/L;ULTIMA GoldTMLTT闪烁液,美国Perkin Elmer公司。其他试剂均为分析纯,国药集团化学试剂公司产品;配制溶液使用的去离子水均采用Millipore Milli-Q超纯水机制备。
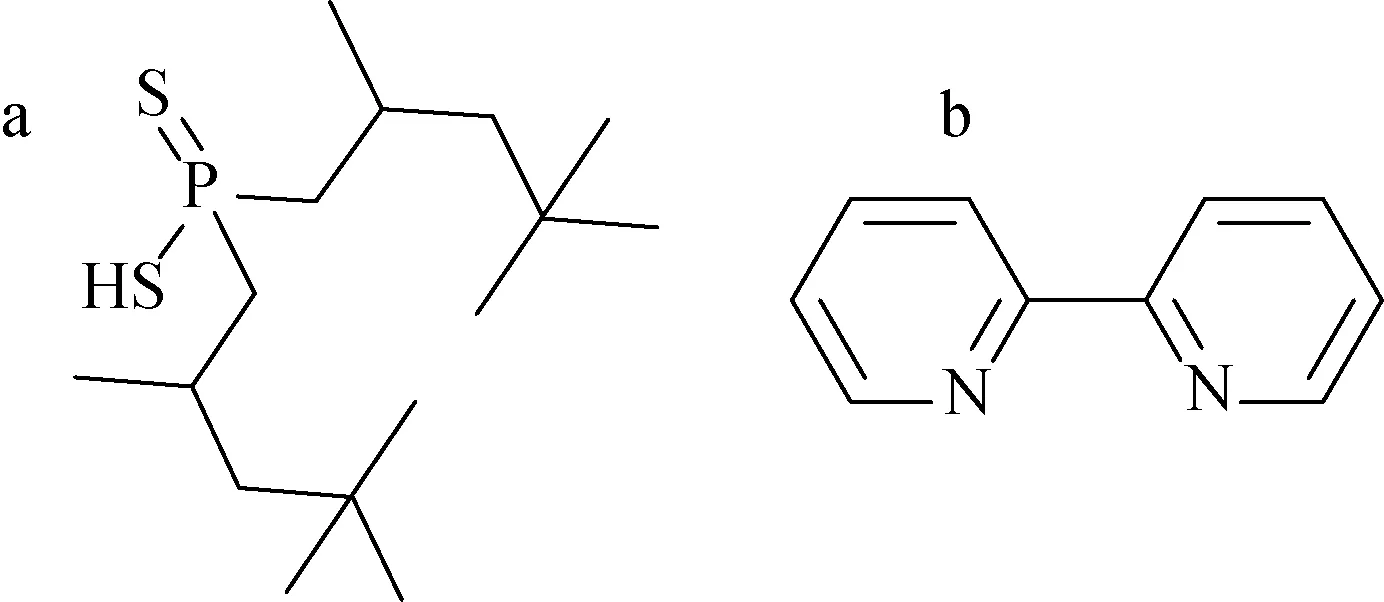
图1 Cyanex 301(a)与2,2′-联吡啶(b)结构示意图Fig.1 Structure schematic diagram of Cyanex 301 (a) and 2,2′-bipyridine (b)
Tri-Carb 2910TR型液体闪烁计数器,美国Packard公司;OPTIMA 8000型ICP-OES光谱仪,美国Perkin Elmer公司;Pt1000温度补偿pH计,瑞士万通公司;安捷伦Cary 7000 UV-Vis-NIR分光光度计,美国Agilent Technologies公司;ZWY-2102C型恒温培养振荡器,上海智城分析仪器制造有限公司;石英比色杯,光程为(10.00±0.01) mm,Starna scientific公司。
1.2 方法
由文献[11]可知,纯化Cyanex 301萃取体系对三价锕镧的分离因子(SFAn/Ln)在1.0×103以上,因此在相同平衡水相pH值下同时对An(Ⅲ)与Ln(Ⅲ)的分配比进行准确测量较困难。本工作在保持pH值、离子强度等条件尽量一致的条件下,分别进行Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)/Eu(Ⅲ)萃取实验。
体系中两种金属离子的分离因子(SF)定义为萃取分配比(D)的比值;金属离子的半萃取pH值(pH1/2)定义为分配比D为1.0的萃取平衡水相的pH值;协萃系数(R)定义为其他条件相同时,有无协萃剂存在时金属离子分配比的比值,即R=D协/DHA。
1) 萃取分配比测定
有机相稀释剂均为煤油。如无特殊说明,水相均为含一定量An(Ⅲ)/Ln(Ⅲ)金属离子的1.0 mol/L NaNO3溶液,萃取前预先调节水相pH值至接近实验目标值;有机相为不同浓度2,2′-联吡啶-0.5 mol/L HA-煤油溶液。对于Am(Ⅲ)和Cm(Ⅲ)的萃取实验,少量示踪剂溶液加热蒸干后用已预调pH值的水相溶解,以减小示踪剂加入对预平衡水相pH值的影响。萃取实验相比均为1∶1,在恒温振荡器中(25±1) ℃下振荡萃取30 min后离心分相。水相pH值均在(25.0±0.5) ℃下测定。
有机相和水相中241Am(Ⅲ)和244Cm(Ⅲ)的活度均采用液体闪烁法进行测定。控制示踪剂用量、取样量、测量时间等,使样品计数的统计误差均小于5%。水相Nd(Ⅲ)和Eu(Ⅲ)的浓度,在稀释适当倍数后采用ICP-OES进行测定;有机相先用1.0 mol/L HNO3溶液反萃,再用ICP-OES测定Nd(Ⅲ)和Eu(Ⅲ)的浓度。对每个样品均进行多次平行测量。
2) 变温萃取实验
按1∶1相比将预调pH值的含金属离子的水相与实验探究范围内最高协萃剂浓度体系有机相(即0.05 mol/L 2,2′-联吡啶-0.5 mol/L HA-煤油)加入玻璃瓶中,密封后置于已预先控温(10、25、40、55、70 ℃)的夹套水浴烧杯中(控温精度为±1 ℃)。磁力搅拌萃取30 min,停止搅拌后保持控温。静置分相后,快速进行两相分离,并将分离的两相样品置于(25.0±0.5) ℃水浴中,恒温后进行相关测定。
3) Nd(Ⅲ)吸收光谱测定
萃取Nd(Ⅲ)后至有机相后,测定有机相的吸收光谱。萃取实验中2,2′-联吡啶浓度为0~0.05 mol/L,HA浓度为0.5 mol/L,起始水相为0.2 mol/L Nd(NO3)3,相比为1∶1,萃取时间为2 h,静置分相后取有机相测量吸收光谱。
紫外-可见吸收光谱测量波长为500~630 nm,仪器狭缝宽度为0.5 nm,数据间隔为0.1 nm,光程为10 mm。将有机相样品的吸收光谱除以金属离子的摩尔浓度,得到有机相金属离子浓度归一化吸收光谱,即萃合物的摩尔吸收光谱。
2 结果与讨论
2.1 协萃剂2,2′-联吡啶对萃取性能及分离因子的影响
平衡水相pH=2~6时,在实验测定的误差范围内观察不到0.05 mol/L的2,2′-联吡啶-煤油溶液对Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)的萃取,表明0.05 mol/L及更低浓度的2,2′-联吡啶-煤油溶液对它们的萃取可忽略。
固定有机相中HA的浓度为0.5 mol/L,有机相2,2′-联吡啶浓度及平衡水相pH值与Am(Ⅲ)、Cm(Ⅲ)和Nd(Ⅲ)、Eu(Ⅲ)萃取分配比的关系示于图2。由图2可见,加入2,2′-联吡啶后,在实验pH值范围内,有机相中4种金属离子的分配比均明显增大,说明2,2′-联吡啶对该体系有显著的协萃作用。
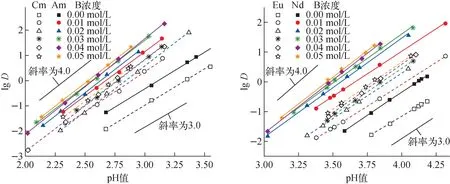
图2 Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)和Eu(Ⅲ)分配比与平衡水相pH值的关系Fig.2 Dependence of lg D on pH of aqueous phase
2,2′-联吡啶浓度对4种金属离子半萃取pH值的影响如图3所示。从图3可看出,随着2,2′-联吡啶浓度的增大,4种金属离子的半萃取pH值均呈现明显减小趋势,非常直观地反映了2,2′-联吡啶的协萃作用。与不含2,2′-联吡啶的0.5 mol/L HA-煤油体系相比,加入的2,2′-联吡啶浓度为0.03 mol/L时,Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)的半萃取pH值平均降低约0.6,分别从3.11、3.34、4.12和4.43降低到2.56、2.77、3.51和3.86。2,2′-联吡啶浓度大于0.03 mol/L时,增加2,2′-联吡啶浓度仍能降低4种金属离子的半萃取pH值,但幅度相对较小。当2,2′-联吡啶浓度为0.05 mol/L时(接近饱和溶解度),4种金属离子半萃取pH值分别为2.52、2.73、3.46和3.79,与2,2′-联吡啶浓度0.03 mol/L时相比,平均仅下降0.05。与无协萃剂存在时的体系相同,在实验研究的2,2′-联吡啶浓度范围内,半萃取pH值仍按照Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)的顺序依次增大,且An(Ⅲ)和Ln(Ⅲ)两组分离越来越明显。这说明2,2′-联吡啶的协萃作用没有改变HA优先萃取相对较“软”金属离子的特性,仍能保持对三价锕系金属离子的优良选择性。
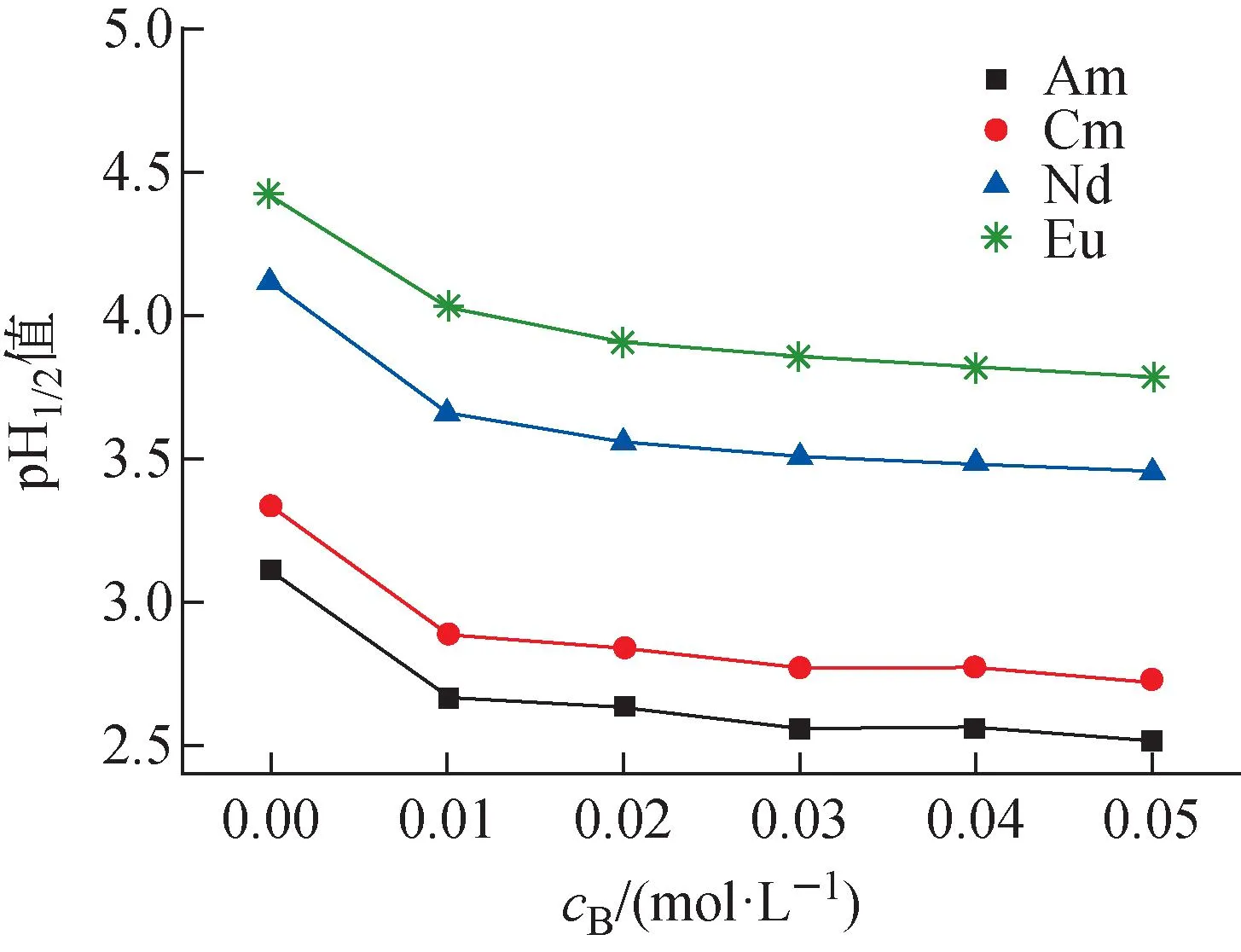
图3 2,2′-联吡啶浓度与pH1/2值的关系Fig.3 Relationship between concentration of 2,2′-bipyridine and pH1/2
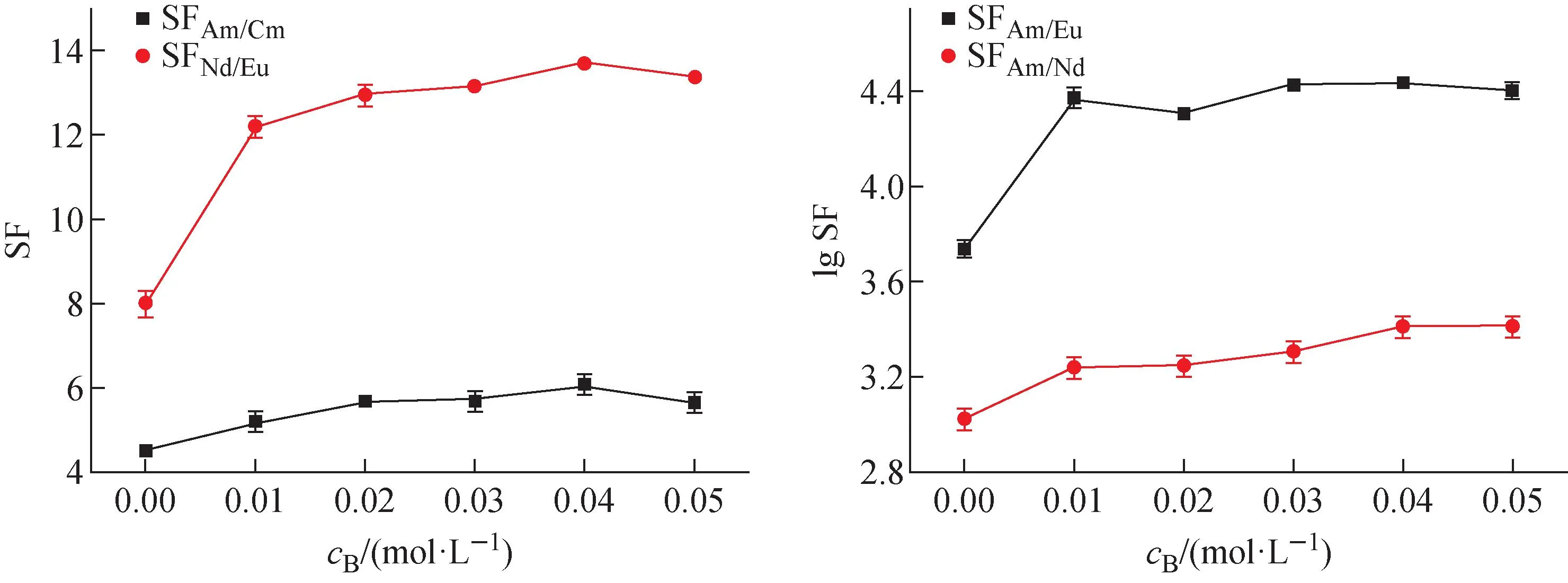
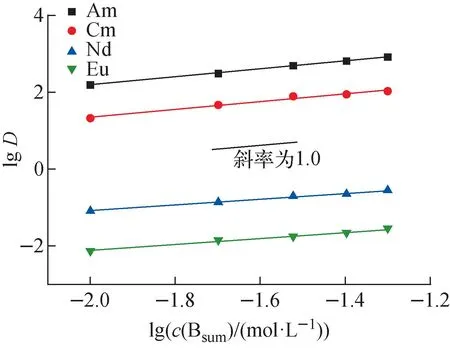
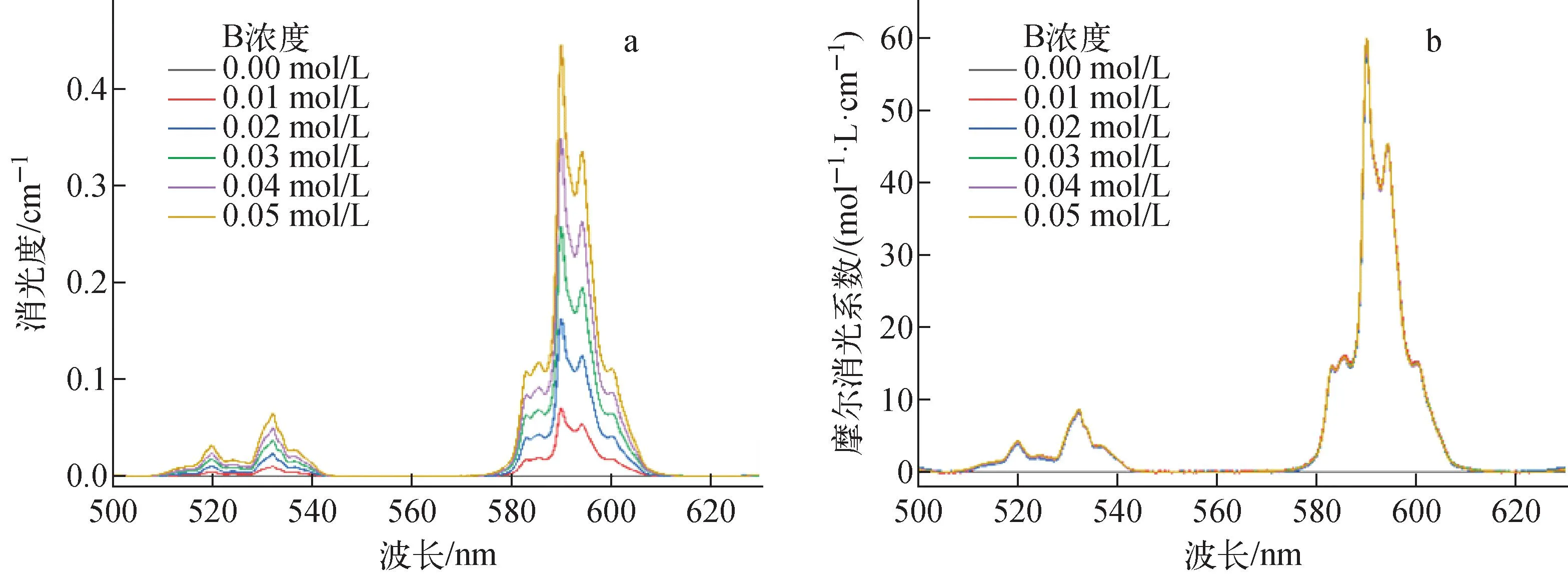
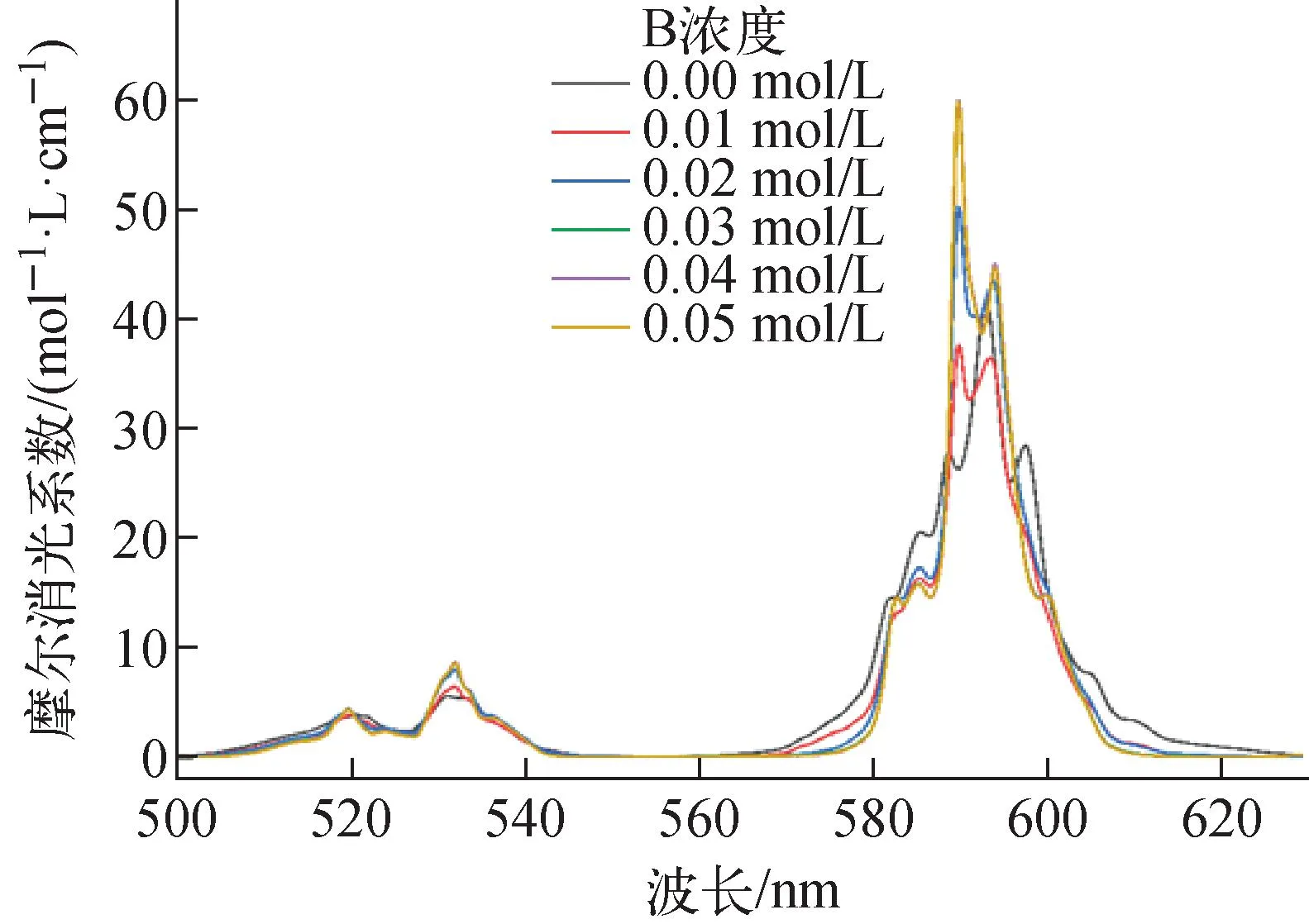
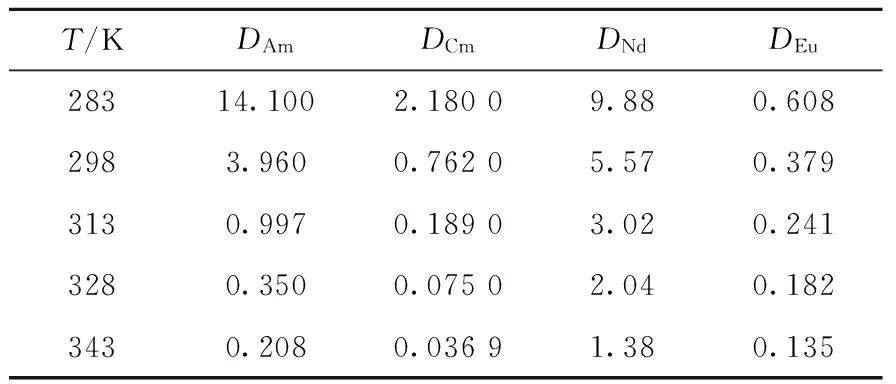
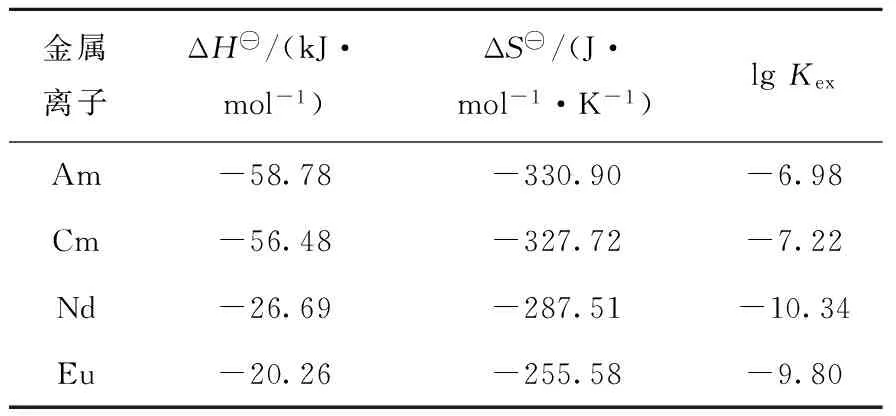
平衡水相pH=3.3时,2,2′-联吡啶浓度对0.5 mol/L HA-煤油萃取4种金属离子的影响如图4所示。由图4可看出,协萃系数不但随2,2′-联吡啶浓度的增大而逐渐增大,而且各元素的协萃系数大小顺序为:Eu(Ⅲ) 图4 萃取平衡水相pH=3.3时2,2′-联吡啶浓度与协萃系数R的关系Fig.4 Relationship between concentration of 2,2′-bipyridine and synergistic coefficient R at pH=3.3 为更清楚地显示2,2′-联吡啶对0.5 mol/L HA-煤油体系萃取分离三价镧锕离子的影响,用图2中数据拟合得到的线性关系推算几种金属离子的pH1/2值,再用两个金属离子pH1/2值的平均值为分离pH值,代入线性关系式计算分离因子SF(该pH值条件下,其中一个金属离子分配比大于1而被优先萃取到有机相,另一个金属离子的分配比小于1而被保留在水相),结果如图5所示。由图5可见,加入2,2′-联吡啶可使三价锕系与三价镧系离子组间、三价锕系离子Am(Ⅲ)与Cm(Ⅲ)、三价镧系离子Nd(Ⅲ)与Eu(Ⅲ)的分离因子均显著提高。随着2,2′-联吡啶浓度的增大,分离因子总体呈先迅速增大再缓慢增加的趋势,在约0.04 mol/L时达到最大值,之后缓慢减小,但幅度并不显著,总体均保持在较高的位置。在协萃剂2,2′-联吡啶的浓度为0.05 mol/L时,SFAm/Cm、SFAm/Eu、SFAm/Nd分别为5.64、2.51×104和2.61×103。 图5 2,2′-联吡啶浓度与Am(Ⅲ)/Cm(Ⅲ)、Nd(Ⅲ)/Eu(Ⅲ)、Am(Ⅲ)/Eu(Ⅲ)、Am(Ⅲ)/Nd(Ⅲ)分离因子的关系Fig.5 Relationship between concentration of 2,2′-bipyridine and separation factors of Am(Ⅲ)/Cm(Ⅲ), Nd(Ⅲ)/Eu(Ⅲ), Am(Ⅲ)/Eu(Ⅲ) and Am(Ⅲ)/Nd(Ⅲ) 水相溶液中,金属离子与硝酸根的配位反应可用式(1)表示: (1) 其中,M3+表示Ln(Ⅲ)/An(Ⅲ);Ki为平衡常数。 HA-煤油体系萃取An(Ⅲ)/Ln(Ⅲ)的反应可用式(2)[8,11-14]表示: (2) 其中:下标O表示物质在有机相;煤油中萃取剂HA以二聚体的形式存在,所以用(HA)2表示。萃合物分子中含有3个脱质子的A-离子以及1个中性的HA分子。 加入2,2′-联吡啶后,推测其协萃机理应为2,2′-联吡啶分子取代了萃合物中的中性HA分子。2,2′-联吡啶在20 ℃的质子化常数(pKa,酸离解常数)为4.35,质子化反应如式(3)所示。在本文pH值范围内,2,2′-联吡啶以中性分子和带1个正电荷离子(HB)+两种形式存在。在单一的水溶液体系中,pH值越低,(HB)+占比越大;pH值为3.0时,(HB)+占比达95%以上,pH值为2.0时,(HB)+占比达99.6%。在两相萃取体系中,推测在平衡有机相中2,2′-联吡啶也以B和(HB)+两种形式存在,且随着平衡水相酸度的变化,两种形式的2,2′-联吡啶的相对含量也有与单一水溶液体系相类似的分布规律。 (3) MA3Bm(O)+(3+n)H+ (4) 根据式(4),萃取反应常数Kex可用式(5)表示: (5) 根据式(1)可得金属离子的分配比D: (6) 将式(6)代入式(5),并对方程两边取对数,变换形式后得式(7): lgD=lgKex+mlgc(Bsum)+(3+n)pH+ 1.5lgc((HA)2(O))-lgY (7) 在pH值=3.3、萃取温度为25 ℃、有机相HA浓度为0.5 mol/L、相比为1∶1的条件下,2,2′-联吡啶与4种金属离子分配比的关系示于图6。由图6可见,4种金属离子的lgD-lgc(Bsum)的斜率均接近于1.0。说明在4种金属离子萃取反应中,均为1个2,2′-联吡啶分子参与反应,即每个萃合物分子均含有3个A-离子和1个B分子,即萃取反应可表达为式(8)。 图6 2,2′-联吡啶浓度与Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)分配比的关系(pH=3.3)Fig.6 Dependence of lg D of Am(Ⅲ), Cm(Ⅲ), Nd(Ⅲ) and Eu(Ⅲ) on lg c(Bsum) (pH=3.3) MA3BO+(3+n)H+ (8) 在不加入NaOH皂化HA的条件下,不同浓度2,2′-联吡啶得到的Nd(Ⅲ)萃合物的吸收光谱及以有机相中Nd(Ⅲ)浓度归一化后的摩尔吸收光谱示于图7。从图7a可看出,此时0.5 mol/L HA-煤油萃取Nd(Ⅲ)的能力弱,有机相光谱基本看不到Nd(Ⅲ)的吸收峰;加入2,2′-联吡啶后,随2,2′-联吡啶浓度的增加,越来越多的Nd(Ⅲ)被萃入有机相,Nd(Ⅲ)萃合物的吸收峰强度增加。结合有机相中Nd(Ⅲ)浓度分析发现,吸收峰强度与萃入有机相的Nd(Ⅲ)量呈正比。从图7b看出,归一化后的有机相吸收光谱几乎完全相同,表明尽管有机相中2,2′-联吡啶浓度不同,但生成的萃合物的组成和结构相同。 图7 不同浓度2,2′-联吡啶下Nd(Ⅲ)萃合物的吸收光谱Fig.7 Absorption spectra and corresponding normalized molar absorption spectra of organic phase containing different concentrations of 2,2′-bipyridine in 0.5 mol/L HA-kerosene equilibrated with 0.2 mol/L Nd(NO3)3 为探究协萃剂加入后萃合物组成的变化趋势,加入NaOH中和部分HA(皂化度为18%),此时萃入有机相中的Nd(Ⅲ)浓度约为0.03 mol/L,萃取平衡后得到的有机相的归一化吸收光谱如图8所示。 图8 加入NaOH中和18% HA后不同浓度2,2′-联吡啶-0.5 mol/L HA-煤油萃取0.2 mol/L Nd(NO3)3有机相摩尔吸收光谱Fig.8 Molar absorption spectra of organic phase containing different concentrations of 2,2′-bipyridine in 0.5 mol/L HA-kerosene neutralized by 18% and equilibrated with 0.2 mol/L Nd(NO3)3 由图8可见,在加入协萃剂2,2′-联吡啶后,平衡有机相萃合物吸收光谱峰形与不加2,2′-联吡啶的明显不同。当2,2′-联吡啶浓度低于有机相中Nd(Ⅲ)浓度(0.03 mol/L)时,有机相吸收光谱随着2,2′-联吡啶浓度的变化而变化;当2,2′-联吡啶浓度达到0.03 mol/L后,有机相吸收光谱不再随2,2′-联吡啶浓度增加而变化,与图7中摩尔吸收光谱一致。推测有机相中2,2′-联吡啶足够多时,生成组成为NdA3B的萃合物。当有机相中2,2′-联吡啶不足时,除NdA3B萃合物外,部分Nd(Ⅲ)仍以NdA3(HA)的形式被萃取。 在控制水相离子强度为1.0 mol/L NaNO3,Am(Ⅲ)、Cm(Ⅲ)萃取平衡水相pH=2.69,Nd(Ⅲ)、Eu(Ⅲ)萃取平衡水相pH=3.78的条件下,有机相为0.05 mol/L 2,2′-联吡啶-0.5 mol/L HA-煤油,温度对Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)分配比的影响列于表1。从表1可看出,随着萃取温度的升高,各离子的分配比均有不同程度的降低,即萃取反应均为放热反应。 表1 温度对萃取分配比的影响Table 1 Relationship between temperature and extraction distribution ratio 根据范特霍夫方程(式(9)),lgKex与热力学常数的关系可用式(10)[11]表达: ΔG⊖=-RTlnK=ΔH⊖-TΔS⊖ (9) (10) 其中:ΔH⊖为萃取反应焓变;ΔS⊖为萃取反应熵变;T为萃取温度;R为理想气体常数,R=8.314 J/(mol·K)。由于式(7)中m=1,则式(7)可写为式(11): lgD=lgKex+lgc(Bsum)+(3+n)pH+ 1.5lgc((HA)2(O))-lgY (11) 将式(11)结合式(10)并变换形式,可得: 1.5lgc((HA)2(O))+lgc(Bsum)-lgY (12) 根据式(12),保持萃取平衡水相pH值等条件不变的前提下,可认为(3+n)pH+1.5lgc((HA)2(O))+lg(c(Bsum))-lgY为常数,若实验温度范围内的ΔH⊖与ΔS⊖也可视为常数,则可通过斜率法得到ΔH⊖+ΔS⊖。 保持其他条件不变,仅改变实验温度,4种金属离子的分配系数与T的关系如图9所示。 图9 萃取温度与Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)分配比的关系Fig.9 Plot of lg D against 1 000/T 由图9可见,在实验温度范围内,4种金属离子的lgD与1 000/T有良好的线性关系,即ΔH⊖与ΔS⊖在此范围内可视为常数。结合图2中0.05 mol/L 2,2′-联吡啶-0.5 mol/L HA-煤油协萃体系萃取Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)的lgD-pH的斜率,可计算得到式(11)中的Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)萃取反应的ΔH⊖与ΔS⊖及25 ℃下萃取平衡常数lgKex,如表2所列。 表2 协萃体系萃取Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)的反应焓变、熵变及25 ℃下的萃取平衡常数Table 2 Enthalpies, entropies, and equilibrium constant at 25 ℃ for extraction of Am(Ⅲ), Cm(Ⅲ), Nd(Ⅲ), Eu(Ⅲ) 通过向0.5 mol/L HA-煤油体系引入2,2′-联吡啶作协萃剂,达到了降低萃取分离三价锕系元素离子的操作pH值、提高Am(Ⅲ)和Cm(Ⅲ)之间分离效果的目的。经过实验探究,得到如下结论。 1) 引入协萃剂2,2′-联吡啶后,萃取平衡方程仍为离子交换萃取机理,但其萃合物组成不同,协萃剂2,2′-联吡啶参与萃合物配位,萃合物组成为MA3B。 2) 随着2,2′-联吡啶浓度增加,对An(Ⅲ)/Ln(Ⅲ)萃取能力与分离能力均有明显增强,协萃系数明显增加。半萃取pH值在协萃剂2,2′-联吡啶浓度为0.05 mol/L时与无2,2′-联吡啶协萃时相比均降低了约0.6,此时相应的SFAm/Cm、SFAm/Eu、SFAm/Nd分别为5.64、2.51×104和2.61×103。 3) 0.05 mol/L 2,2′-联吡啶-0.5 mol/L HA-煤油协萃体系萃取Am(Ⅲ)、Cm(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)的萃取反应均为放热反应,反应焓变分别为-58.78、-56.48、-26.69、-20.26 kJ/mol。萃取温度升高,该协萃体系对4种金属离子的萃取能力减弱,SFAm/Cm、SFNd/Eu均有所降低。 因此,与单独的纯化Cyanex 301体系相比,采用2,2′-联吡啶或类似协萃剂与纯化Cyanex 301协同萃取分离三价镧系和锕系元素可以在相对较低的pH值条件下进行,有利于工业化实施;由于该体系同时还具有较好的镅锔分离效果,因此在实现三价镧系与锕系的分离后,可通过简单的分步反萃,有效实现镅锔之间的相互分离,具有很好的工业应用前景。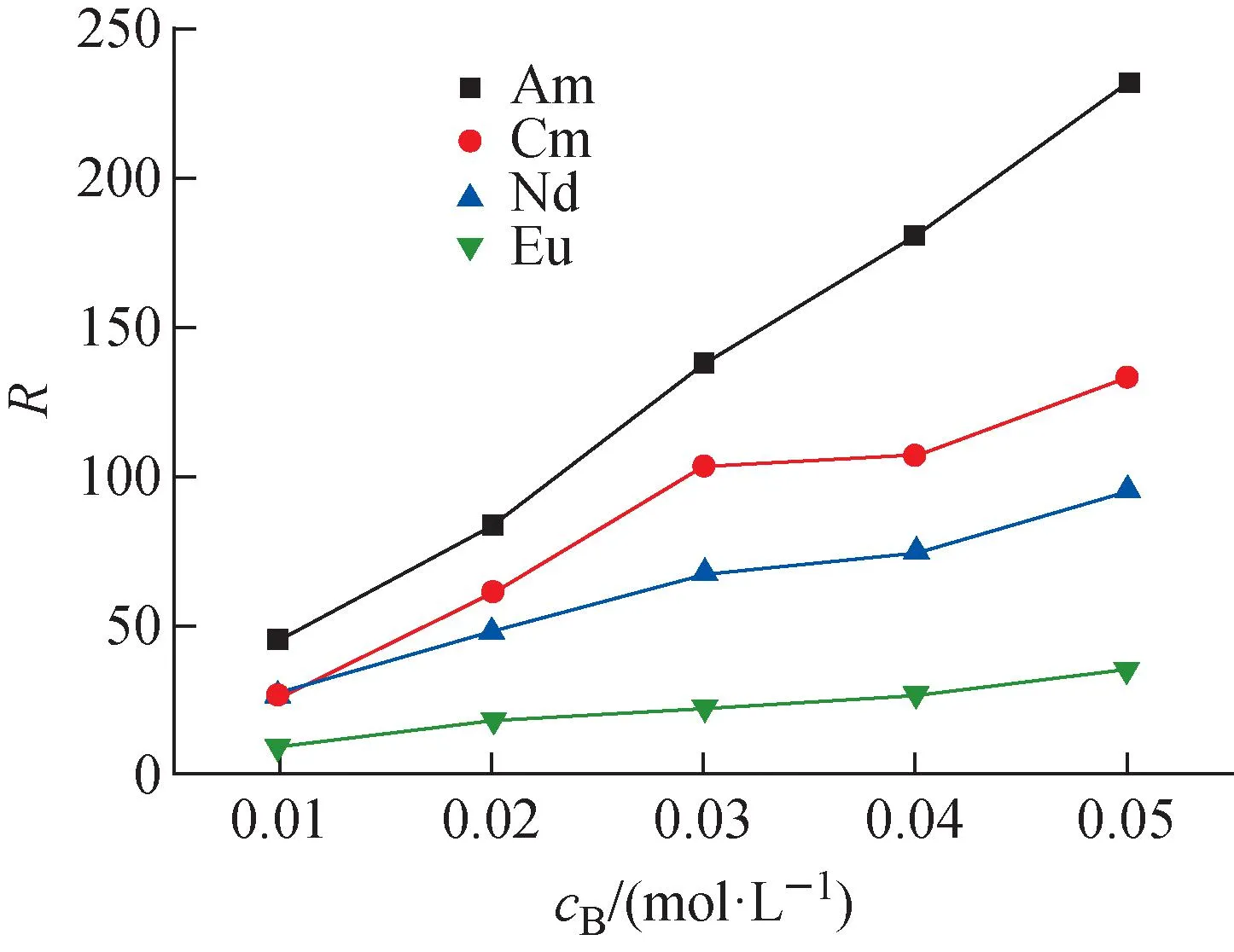
2.2 萃取反应机理
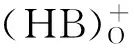
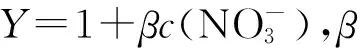
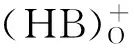
2.3 温度对协萃体系的萃取性能影响

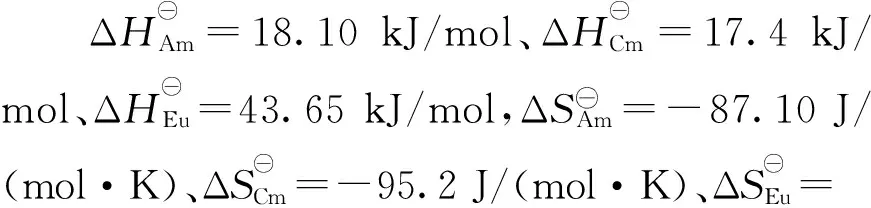
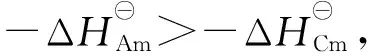
3 结论

