超声波与酶法辅助提取紫苏叶中黄酮类化合物的工艺研究*
刘 娜,陈金莹,闫文乐,苑仪桢,王凯瑶,张紫玉,司可可
(1 郑州师范学院化学化工学院,河南 郑州 450044;2 天水市第五中学,甘肃 天水 741000)
紫苏其叶似唇形,叶边呈锯齿状,属于唇形科紫苏属中的一年生草本植物[1]。在我国有两千多年的栽培历史,各地区均有种植[2]。紫苏气清香,味微辛,其根、茎、叶、籽皆可入药,具有很高的医用和食用价值[3-5]。紫苏叶中含有多种生物活性成分,紫苏叶中的黄酮类化合物具有杀菌消炎、抗氧化、促进血液循环、增强免疫力、降压降脂、减轻心脑血管疾病等功效[6-8]。从植物组织中萃取黄酮类化合物的方法有:溶剂提取法[9-10]、超声波和微波辅助提取法[11-13]等。其中溶剂提法报道较多,该法对提取设备要求不高、所耗成本低、绿色安全,但提取出的成分较多,不利于后续的分离纯化。超声波辅助提取法具有所需仪器设备简单、操作简单高效、提取率高的优点。因此,文中采用超声波与酶辅助提取紫苏叶中的黄酮类化合物,并通过紫外分光光度法进行定量分析。通过单因素实验分别考察乙醇体积分数、加酶量、酶解温度、酶解时间、超声时间、超声温度、料液比等因素对紫苏叶中黄酮类化合物萃取率的影响,以期优化出最佳提取工艺。
1 实 验
1.1 材料与试剂
新鲜紫苏叶采摘于广西南宁(4月),芦丁对照品和纤维素酶:上海麦克林生化科技有限公司;无水乙醇等试剂为分析纯。
1.2 仪器与设备
FA114电子分析天平,上海海康电子仪器厂;T6新世纪紫外可见分光光度计,北京普析通用仪器有限公司;JP-020超声波清洗仪,深圳市洁盟清洗设备有限公司;H1850 医用离心机,北京仪器开发有限公司;DF-101S恒温油浴锅,巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 原材料预处理
紫苏叶洗净并至于阴凉处晾干,然后放在烘箱中60 ℃下烘4 h,将烘干后的紫苏叶粉碎,过60目筛得紫苏叶粉末,装入样品袋中置于阴凉干燥处备用。
1.2.2 芦丁标准曲线的绘制
向50 mL烧杯中加入准确称取的10.1 mg芦丁对照品,加入60%乙醇溶液10.0 mL,搅拌溶解后转移至50 mL容量瓶中,加60%乙醇溶液至刻度线,摇匀得0.202 mg/mL芦丁标准溶液。取洁净干燥的10 mL容量瓶6个,用吸量管分别准确量取1.0、2.0、3.0、4.0、5.0 mL芦丁标准溶液于10 mL容量瓶中,加60%乙醇溶液至5.0 mL。向上述6个容量瓶中依次加入0.3 mL 5% NaNO2溶液,摇匀后静置3 min,再加入10% Al(NO3)3溶液0.3 mL,摇匀后静置3 min,最后加入5% NaOH溶液3.0 mL,加60%乙醇溶液至刻度线,摇匀后静置10 min。通过紫外可见分光光度计在500 nm处,测定其吸光度A。以芦丁标准溶液的浓度C为横坐标,对应吸光度A为纵坐标,绘制芦丁标准曲线。
1.2.3 总黄酮类化合物含量的测定
准确称取1.0 g紫苏叶粉末于圆底烧瓶中,加入一定比例的纤维素酶,然后按一定的料液比加入一定体积的乙醇溶液,设置酶解温度,在该温度下水解一定时间,水解结束后在100 ℃下灭活,随后转移至超声仪中,设置超声温度,在该温度下超声一定时间,将所得萃取液抽滤。量取5.0 mL离心处理,准确移取2.0 mL上层清液于50 mL容量瓶中,然后按照1.2.2的方法进行显色和测定所得试液的吸光度A。最后根据芦丁标准曲线方程,计算试液中黄酮类化合物的浓度和紫苏叶中黄酮类化合物的萃取率,计算公式如下:
(1)
式中:y为紫苏叶中黄酮类化合物萃取率,%;c为试液黄酮类化合物浓度,mg/mL;v0为萃取试液总体积,mL;n为稀释倍数;m为称取紫苏叶干粉末质量,g。
2 结果与讨论
2.1 芦丁标准曲线的绘制

图1 芦丁的标准曲线Fig.1 Rutin’s standard curve
以60%乙醇溶液为空白对照,通过紫外可见分光光度计在500 nm处,测定其吸光度。以芦丁标准溶液浓度C为横坐标,对应吸光度A为纵坐标,绘制得到芦丁标准曲线。结果如图1所示,芦丁浓度c(mg/mL)与吸光度A在相应浓度范围内具有较好的线性关系,线性回归方程为A=12.257 4c-0.027 2,R2=0.999 4。
2.2 紫苏叶中黄酮类化合物的单因素实验结果
2.2.1 乙醇体积分数对紫苏叶中黄酮类化合物萃取率的影响
准确称取5份1.0 g紫苏叶粉末和3.0 mg/g纤维素酶(加酶量为0.3%),按照料液比1∶40,分别加入体积分数为30%、40%、50%、60%、70%乙醇溶液,在30 ℃下酶解3 h,酶解结束后在100 ℃下灭活,转移至超声仪中在50 ℃下超声萃取20 min,萃取液按照1.2.3的实验步骤进行处理和显色,测定各试液的吸光度,考察乙醇体积分数对紫苏叶中黄酮类化合物萃取率的影响。

图2 乙醇体积分数对萃取率的影响Fig.2 Influence of ethanol volume fraction on extraction rate
不同体积分数的乙醇溶液对萃取率的影响如图2所示。乙醇体积分数在30%~50%时,紫苏叶中黄酮类化合物的萃取率呈现增大趋势;乙醇体积分数为50%时,紫苏叶中黄酮类化合物的萃取率达到最大值;乙醇体积分数在50%~70%时,紫苏叶中黄酮类化合物的萃取率呈下降趋势。原因可能是紫苏叶中黄酮类化合物为极性有机化合物,当乙醇体积分数偏小或偏大时,黄酮类化合物在乙醇溶液中的溶解度偏低。因此,体积分数为50%乙醇溶液作为萃取剂时,试液中黄酮类化合物的浓度最高。
2.2.2 加酶量对紫苏叶中黄酮类化合物萃取率的影响

图3 加酶量对萃取率的影响Fig.3 Effect of enzyme dosage on extraction rate
准确称取5份1.0 g紫苏叶粉末,分别按照加酶量为0.3%、0.4%、0.5%、0.6%、0.7%加入纤维素酶,按照料液比1∶40,加入50%乙醇溶液40 mL,在30 ℃下酶解3 h。酶解结束后在100 ℃下灭活,转移至超声仪中在50 ℃下超声萃取20 min,萃取液按照1.2.3的实验步骤进行处理和显色,测定各试液的吸光度,考察加酶量对紫苏叶中黄酮类化合物的萃取率的影响。
加酶量对萃取率的影响图3所示。加酶量小于0.5%时,萃取率随着加酶量的增加而升高;加酶量大于0.5%时,萃取率随着加酶量的增加而降低;加酶量为0.5%时,萃取率最大。随着加酶量的增大,水解速度加快;加酶量过大时,水解作用受到抑制,萃取率降低。因此,最佳加酶量为0.5%。
2.2.3 酶解温度对紫苏叶中黄酮类化合物萃取率的影响
准确称取5份1.0 g紫苏叶粉末,加酶量为0.5%时,按照料液比1∶40,加入50%乙醇溶液40 mL,分别在度为20 ℃、30 ℃、40 ℃、50 ℃、60 ℃下酶解2 h,酶解结束后在100 ℃下灭活,转移至超声仪中在50 ℃下超声萃取20 min,萃取液按照1.2.3的实验步骤进行处理和显色,测定试液的吸光度,根据芦丁标准曲线方程计算紫苏叶中黄酮类化合物的萃取率,考察酶解温度的影响。
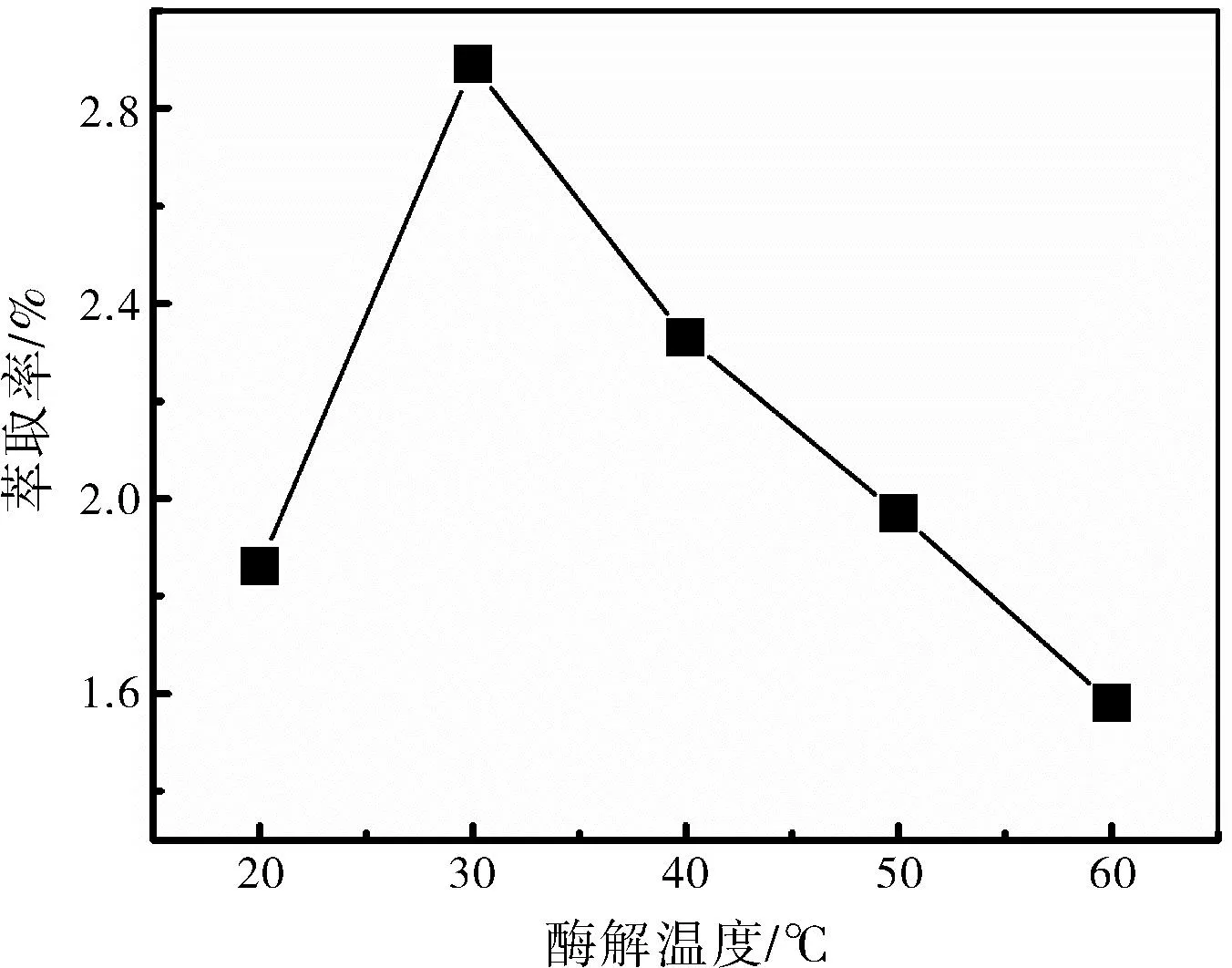
图4 酶解温度对萃取率的影响Fig.4 Influence of enzymatic hydrolysis temperature on extraction rate
不同酶解温度对萃取率的影响图4所示。酶解温度在 20~30 ℃时,萃取率逐渐升高;当酶解温度为30 ℃时,萃取率最大;酶解温度超过30 ℃,萃取率逐渐下降。纤维素酶的活性受温度影响较大,在30 ℃时酶的活性最高。因此,酶解温度为 30 ℃时,试液中黄酮类化合物的浓度最高。
2.2.4 酶解时间对紫苏叶中黄酮类化合物萃取率的影响

图5 酶解时间对萃取率的影响Fig.5 Influence of enzymatic hydrolysis time on extraction rate
准确称取5份1.0 g紫苏叶粉末,加酶量为0.5%时,按照料液比1∶40,加入50%乙醇溶液40 mL,在30 ℃下分别酶解1 h、2 h、3 h、4 h、5 h,酶解结束后在100 ℃下灭活,转移至超声仪中,在30 ℃下超声萃取20 min,萃取液按照1.2.3的实验步骤进行处理和显色,测定各试液的吸光度,考察酶解时间对紫苏叶中黄酮类化合物萃取率的影响。
不同酶解时间对萃取率的影响图5所示。在酶解时间为1~3 h时,紫苏叶中黄酮类化合物的萃取率呈上升趋势;酶解时间为3 h时,萃取率达到最大值,酶解时间超过3 h后萃取率逐渐下降,原因是加入的纤维素酶能够加速破坏植物的细胞壁,使黄酮类化合物更易浸出,但随着酶解时间的增长紫苏叶中其他化合物的浸出抑制了黄酮类化合物的浸出,使萃取率呈下降趋势。因此,最佳酶解时间为3 h。
2.2.5 超声温度对紫苏叶中黄酮类化合物萃取率的影响
准确称取1.0 g紫苏叶粉末,加酶量为0.5%时,按照料液比1∶40,加入50%乙醇溶液40 mL,在30 ℃下分别酶解3 h,酶解结束后在100 ℃下灭活,转移至超声仪中,分别在30 ℃、40 ℃、50 ℃、60 ℃下超声萃取20 min,萃取液按照1.2.3的实验步骤进行处理和显色,测定各试液的吸光度,考察超声温度对紫苏叶中黄酮类化合物萃取率的影响。

图6 超声温度对萃取率的影响Fig.6 Influence of ultrasonic temperature on extraction rate
不同超声温度对萃取率的影响如由图6所示。超声温度为30~60 ℃时,黄酮类化合物的萃取率呈上升趋势;超声温度为60 ℃时,萃取率达到最大值;在超声温度60~80℃时,黄酮类化合物的萃取率随着温度的升高逐渐下降。可能的原因是随着温度的升高黄酮类化合物在溶液中的溶解度逐渐增大;超声温度过高时,一些热敏性黄酮类化合物不稳定,萃取率下降。由此可知,最佳的超声萃取温度为60 ℃。
2.2.6 超声时间对紫苏叶中黄酮类化合物萃取率的影响

图7 超声时间对萃取率的影响Fig.7 Influence of ultrasonic time on extraction rate
准确称取1.0 g紫苏叶粉末,加酶量为0.5%时,按照料液比1∶40,加入50%乙醇溶液40 mL,在30 ℃下分别酶解3 h,酶解结束后在100 ℃下灭活,转移至超声仪中,在60 ℃下分别超声萃取10 min、20 min、30 min、40 min、50 min,萃取液按照1.2.3的实验步骤进行处理和显色,测定各试液的吸光度,考察不同超声时间对黄酮类化合物萃取率的影响。
不同超声时间对萃取率的影响如图7所示。在超声萃取时间为10~20 min 时,萃取率随着超声萃取时间的推移逐渐增大;当超声时间为20 min时,萃取率达到最大值;一旦超声时间超过20 min时,黄酮类化合物的萃取率逐渐下降。原因可能是随着超声萃取的时间延长,黄酮类化合物的溶出程度增大,萃取率随之增大;随着紫苏叶中其他化合物不断被浸出,致使紫苏叶中黄酮类化合物的溶解度降低,萃取率下降。由此可知,最佳超声时间为20 min 。
2.2.7 料液比对紫苏叶中黄酮类化合物萃取率的影响
准确称取1.0 g紫苏叶粉末,加酶量为0.5%时,分别按照料液比1∶20、1∶30、1∶40、1∶50、1∶60,加入50%乙醇溶液40 mL,在30 ℃下分别酶解3 h,酶解结束后在100 ℃下灭活,转移至超声仪中,在60 ℃下超声萃取20 min,萃取液按照1.2.3的实验步骤进行处理和显色,测定各试液的吸光度,考察不同料液比对黄酮类化合物萃取率的影响。

图8 料液比萃取率的影响Fig.8 Influence of solid-liquid ratio on extraction rate
不同料液比对萃取率的影响如图8所示。料液比(1∶20)~(1∶50)时,紫苏叶中黄酮类化合物的萃取率呈现上升趋势;料液比为1∶50时,萃取率达到最大值;料液比(1∶50)~(1∶60)时,紫苏叶中黄酮类化合物的萃取率呈下降趋势。原因可能是萃取溶液较少时,紫苏叶中黄酮类化合物易达到饱和未被充分浸出。当萃取溶液较多时,所用溶剂量增多,黄酮类化合物的萃取率变化不大。由此可知,最佳的料液比为1∶50。
综上所述,通过实验探究和对实验数据的分析,得出最优的萃取工艺条件为乙醇体积分数为50%、加酶量为0.5%,酶解时间3 h、酶解温度30 ℃、超声温度为60 ℃、超声时间20 min、料液比为1∶50 g/mL,此时萃取率最高为3.45%。
3 结 论
文中采用超声波和酶法协同辅助溶剂提法萃取紫苏叶中黄酮类化合物,并对提取工艺进行优化。通过单因素试验,探究乙醇体积分数、加酶量、酶解时间、酶解温度、超声时间、超声温度、料液比等因素对紫苏叶中黄酮类化合物萃取率的影响。最终得出的最佳萃取工艺条件为乙醇体积分数为50%、加酶量为0.5%、酶解时间3 h、酶解温度30 ℃、超声时间20 min、超声温度为60 ℃、料液比为1∶50 g/mL。

