表没食子儿茶素没食子酸酯靶向调控Nrf2-Keap1信号通路与脑梗死神经保护作用的关系
肖湘芝 陈管雄 胡智文
长沙市第四医院(湖南师范大学附属长沙医院)急诊科(长沙 410000)
出血性转化(hemorrhagic transformation,HT)是急性缺血性卒中(ischemic stroke, IS)最具破坏性的并发症之一,其特征是脑血管破裂和实质内出血[1]。IS 后24 h 内HT 的发生率为15.20%,在整个IS 期间达到30.15%,导致预后不良[2]。然而,临床上尚无治疗HT 的有效药物。研究[3]发现,高血糖是IS 患者的常见危险因素,大约40%的IS 患者患有糖尿病和高血糖。脑卒中发病后24 h 内血糖高于7 mmol 与脑损伤加重和病死率增加相关,严重影响脑卒中的临床治疗[4]。因此,研究高血糖引起HT 的机制,寻找新的靶点和治疗药物,对于改善脑卒中的治疗和预后具有重要意义。表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶的主要生物活性成分,目前已证实其对大部分中枢神经系统疾病发挥潜在的治疗作用,如阿尔茨海默病、朊病毒病、外伤性脑损伤和脑缺血[5-6]。研究[7-8]证实,EGCG 是一种多靶点药物,因为它与细胞内区室(如线粒体、溶酶体和细胞核)相互作用以介导多种生物作用。然而,EGCG 对高血糖诱导HT 的保护作用尚不清楚。因此,本研究采用急性高血糖联合电凝脑缺血模型评价EGCG 对HT 的保护作用。同时采用网络药理学预测与HT 发生相关的潜在靶点和通路,并进一步通过实验验证EGCG 在高血糖诱导HT 中的作用机制。
1 材料与方法
1.1 动物体质量240 ~ 260 g 的雄性SD 大鼠购自北京维通利华实验动物技术有限公司[许可证号 SCXK(京)2018-0006]。研究方案经本院伦理委员会批准同意(编号:E2020081.1)。
1.2 试剂和仪器EGCG(纯度≥ 95%)购自美国Sigma 公司;QuantiChrom Hemoglobin Assay Kit 购自美国BioAssay Systems 公司;Nrf2、Keap1、TLR4一抗购自美国Proteintech 公司;NF-κB p65、phosphorylated-NF-κB p65、β-actin 一抗购自美国Cell Signaling Technology 公司;Alexa 594 偶联的二抗购自美国Abcam 公司;PVDF 膜购自美国Millipore 公司;HRP 偶联的兔或小鼠IgG 二抗购自北京CWBIO 公司。YLS-14B 血栓形成测试仪购自济南一研科技发展有限公司;FreeStyle Optium Neo 血糖仪购自美国Abbott Diabetes Care 公司;分光光度计购自美国Molecular Devices 公司;Nikon Eclipse Ti-SR 购自日本Nikon 公司;Tanon 5200 增强型化学发光加检测系统购自上海Tanon 公司。
1.3 方法
1.3.1 制备高血糖诱导的HT 模型大鼠在手术前30 min 腹腔注射50%葡萄糖(6 mL/kg),并用10%水合氯醛(4 mL/kg)麻醉。参照文献[9]方法建立电凝诱导的血栓性局灶性缺血大鼠模型。将大鼠右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)钝性分离。将YLS-14B 血栓形成测试仪的电钳放入颈总动脉中并刺激(1.00 mA)4 min。血栓被压碎并冲入ICA。再将CCA 夹住15 min,然后将动物放回笼子。
1.3.2 动物分组将动物随机分为假手术组(Sham,n= 20)、模型组(n= 27)、高血糖模型组(HG,n= 43)、EGCG 组(n= 43)。在Sham 组中,仅分离出CCA。在模型组中,大鼠接受手术但未接受50%葡萄糖注射。在HG组和EGCG组中,大鼠接受手术并接受50%的葡萄糖。此外,EGCG 组在IS 前灌胃给药5 d。在脑缺血模型中研究了各种剂量的EGCG,我们根据之前的研究[10]选择50 mg/(kg·d)的剂量。本研究共使用143 只大鼠,排除10 只非卒中大鼠。
1.3.3 血糖检查在注射50%葡萄糖前和术后0、1、2、3 h 通过尾静脉穿刺采血。使用FreeStyle Optium Neo 血糖仪进行测量血糖。
1.3.4 神经功能评估缺血24 h 后,对大鼠进行神经功能测试。根据Longa 的五点量表,选择评分为1 ~ 3 的大鼠进行后续实验。改良神经严重程度评分(mNSS)方法包括运动功能评分(6 分)、感觉功能评分(2 分)、平衡木评分(6 分)和反射功能(4 分)。得分越高表明损伤的严重程度越高。得分≥ 8 分的大鼠用于进一步实验。
1.3.5 梗死体积检查缺血24 h后,将大鼠麻醉并处死。大脑被迅速取出并在-80 ℃下冷冻15 min。将大脑切成2 mm 冠状切片,并在1% TTC 溶液中保存15 min。然后,用4%多聚甲醛固定脑切片并拍照。通过Image J 软件检查梗死体积、对侧对应结构的体积和同侧对应结构的体积。以下公式用于校正水肿和萎缩的梗死体积:梗死体积百分比 =[总梗死体积-(同侧半球体积-对侧半球体积)]/对侧半球体积× 100%[11]。
1.3.6 HT 发病率和死亡率统计每组所用大鼠数、死亡数、有无出血大鼠数。HT发生率(%)=出血大鼠数/(出血大鼠数+无出血大鼠数)×100%。死亡率(%) = (死亡的大鼠数/使用的大鼠数) × 100%。
1.3.7 出血评分和血红蛋白含量测量灌注后迅速取出大脑,冠状切开6 片进行评分。出血的严重程度分为4 个等级:1 - 4 分:小点状出血性梗塞(HI1,1 分)、融合性点状出血性梗塞(HI2,2 分)、小实质出血(PH1,< 梗塞区的30%,轻度占位效应,3 分)和大量实质出血(PH2,≥ 30%梗死区,显著的占位效应,4 分)[12]。评分后,快速称重同侧半球,用0.1 mol/L PBS(1∶1)进行分离和匀浆。以13 000 ×g离心30 min 后,收集上清液。将50 μL上清液吸收到96 孔板中,加入200 μL 试剂(QuantiChrom Hemoglobin Assay Kit)并避光。在室温下反应15 min 后,用分光光度计在400 nm 处测量OD值。
1.3.8 苏木精-伊红(HE)染色用多聚甲醛固定大脑,然后脱水,石蜡包埋,切成5 μm 厚的切片。将大鼠切片脱蜡、再水化并用HE 染色以进行整体形态学评估。
1.3.9 免疫荧光测定将4%多聚甲醛固定的大脑切成25 μm 切片用于双重免疫染色分析。将切片与大鼠抗 Nrf2(1∶100)或Keap1(1∶100)一起孵育,然后与Alexa 594 偶联的二抗(1∶500)一起孵育。将盖玻片固定在载玻片上并用4',6-didiayl-2-phenylindole 染色。在荧光显微镜下测量切片。使用Nikon Eclipse Ti-SR 获得荧光图像,并通过Image J 软件进行分析。测量积分光密度和免疫反应点的面积。
1.3.10 网络药理学分析EGCG 的潜在靶点收集于瑞士靶点预测(http://www.swisstargetprediction.ch/)网站。与“缺血性卒中”、“高血糖”、“脑出血”、“出血性转化”和“高血糖缺血性卒中”相关的靶点通过搜索OMIM 数据库、DrugBank 数据库、GeneCards 数据库、TTD 数据库获取。将化合物与疾病的相互作用靶基因导入Cytoscape 3.7.1 软件进行蛋白质-蛋白质相互作用(PPI)分析,选择度数、介数中心性和接近中心性大于各自中位数的基因作为核心靶基因。STRING(https://string-db.org/)网站用于执行京都基因和基因组百科全书(KEGG)通路富集分析。
1.3.11 蛋白质印迹脑组织在含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA 缓冲液中裂解和匀浆。然后将匀浆在冰上裂解20 min 并在4 ℃下以13 000 ×g离心15 min。蛋白质浓度采用BCA 法测定。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS/PAGE)分离蛋白质并转移至PVDF 膜。在TBST 中用5% BSA 封闭1 h 后,将膜与Nrf2(1∶1 000)、Keap1(1∶1 000)、TLR4(1∶800)、NF-κB p65(p65,1∶1 000)、phosphorylated-NF-κB p65(pp65,1∶1 000)和β-actin(1∶1 000)一抗在4 ℃下孵育过夜。在室温下加入针对HRP 偶联的兔或小鼠IgG 二抗(稀释度1∶5 000)2 h。使用Tanon 5200增强型化学发光加检测系统进行检测,并使用Image J 软件分析条带的光密度。
1.4 统计学方法采用SPSS 22.0 进行统计分析。正态分布的计量资料结果表示为平均值±标准差。使用未配对的学生t检验进行两组之间的统计分析。使用单因素方差分析和Bonferroni 多重比较事后检验进行两个以上组的统计分析。使用带有Tukey 事后检验的重复测量双向ANOVA 分析血糖数据。计数资料以率(%)表示,采用χ2检验分析出血发生率和死亡率。使用非参数Kruskal-Wallis检验和事后Dunnett 多重比较检验分析神经系统评分。P< 0.05 认为差异有统计学意义。
2 结果
2.1 注射50%葡萄糖后不同时间点的血糖水平如表1 所示,模型组卒中后3 h 内血糖水平逐渐升高。注射50%葡萄糖的大鼠在注射后30 min 血糖水平最高,并维持3 h。然而,EGCG 不影响血糖升高。
表1 注射50%葡萄糖后不同时间点的血糖水平Tab. 1 Blood sugar levels at different time points after 50% glucose injection ±s,mmol/dL
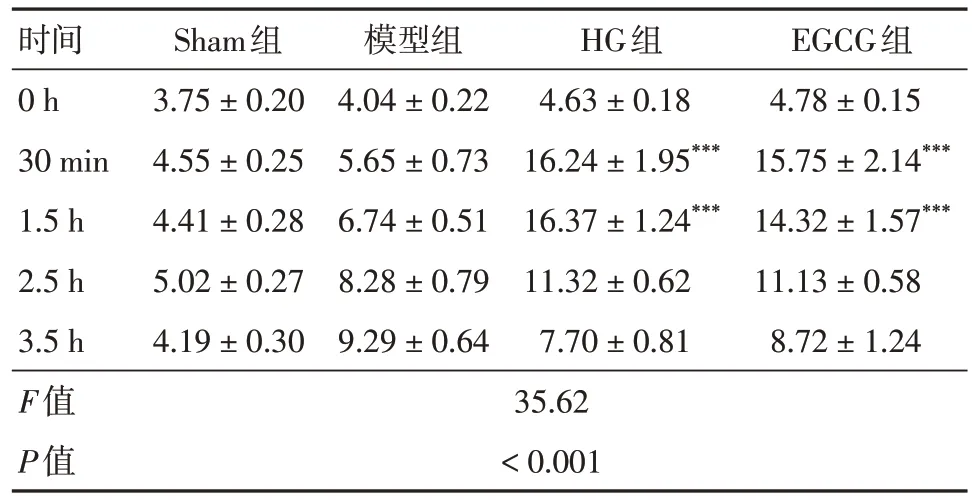
表1 注射50%葡萄糖后不同时间点的血糖水平Tab. 1 Blood sugar levels at different time points after 50% glucose injection ±s,mmol/dL
注:与模型组相比,***P < 0.001
时间0 h 30 min 1.5 h 2.5 h 3.5 h F值P值Sham组3.75 ± 0.20 4.55 ± 0.25 4.41 ± 0.28 5.02 ± 0.27 4.19 ± 0.30模型组4.04 ± 0.22 5.65 ± 0.73 6.74 ± 0.51 8.28 ± 0.79 9.29 ± 0.64 HG组4.63 ± 0.18 16.24 ± 1.95***16.37 ± 1.24***11.32 ± 0.62 7.70 ± 0.81 EGCG组4.78 ± 0.15 15.75 ± 2.14***14.32 ± 1.57***11.13 ± 0.58 8.72 ± 1.24 35.62< 0.001
2.2 EGCG 改善神经功能并减少急性高血糖引起的梗死体积与模型组相比,HG 组大鼠死亡率显著升高(P< 0.05)。EGCG 组大鼠死亡率较HG组显著降低(P< 0.05)。其次,HG 组的Longa 评分明显高于模型组(P< 0.05),EGCG 预处理显著改善了神经功能。通过TTC 染色测量梗死体积。如图1 和表2 所示,NG 组有明显的脑梗死,高血糖进一步增加了梗死体积。与HG 组相比,EGCG 预处理显著降低了梗死体积(P< 0.05)。

图1 通过TTC 染色测量梗死体积(n = 6)Fig.1 Infarct volume was measured by TTC staining(n = 6)
表2 EGCG 对急性高血糖卒中大鼠神经功能和梗死体积的影响Tab.2 Effects of EGCG on neurological function and infarct volume in rats with acute hyperglycemia ±s

表2 EGCG 对急性高血糖卒中大鼠神经功能和梗死体积的影响Tab.2 Effects of EGCG on neurological function and infarct volume in rats with acute hyperglycemia ±s
注:与Sham组相比,***P < 0.001;与模型组相比,&P < 0.05;与HG组相比,#P < 0.05、##P < 0.01
组别Sham组模型组HG组EGCG组F/χ2值P值梗死体积(%)0 38.06 ± 3.17***42.14± 4.37***28.50 ±3.73#34.26< 0.001 n 20 27 43 43死亡[n(%)]0(0)6(21.2)***22(51.2)***&13(30.20)#7.11 0.029 mNSS评分(分)0 10.02 ± 0.38***11.27 ± 0.45***9.63 ± 0.29##28.62< 0.001 Longa评分(分)0 2.33 ± 0.42***3.57± 0.20***&1.93 ± 0.33#31.53< 0.001
2.3 EGCG 减轻急性高血糖引起的HTHG 组的HT发生率高于模型组(59.3%vs. 90.7%)。EGCG显著降低高血糖诱导的HT 发病率至69.8%(表3)。出血评分结果显示,模型组有轻微出血,HG 组出血评分明显升高。与HG 组相比,EGCG 组显著降低了出血评分(图2A 和表3)。HG 组的血红蛋白含量明显高于模型组。与HG 组相比,EGCG 使血红蛋白含量分别从(53.42 ± 5.11) mg/dL 降低到(37.04 ± 2.39) mg/dL(表3)。HE 染色显示了急性高血糖导致脑出血增加,EGCG 可缓解(图2B)。

图2 EGCG 对高血糖引起的脑出血的影响Fig.2 Effect of EGCG on cerebral hemorrhage caused by hyperglycemia
表3 EGCG 对急性高血糖卒中大鼠HT 的影响Tab. 3 Effect of EGCG on HT in Rats with Acute Hyperglycemia Stroke ±s
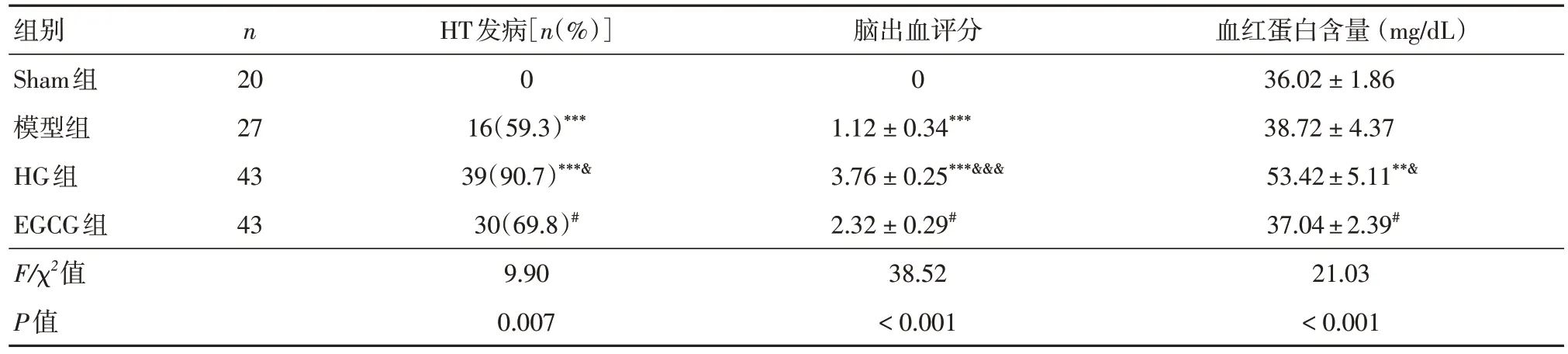
表3 EGCG 对急性高血糖卒中大鼠HT 的影响Tab. 3 Effect of EGCG on HT in Rats with Acute Hyperglycemia Stroke ±s
注:与Sham组相比,***P < 0.001;与模型组相比,&P < 0.05;与HG组相比,#P < 0.05
组别Sham组模型组HG组EGCG组F/χ2值P值血红蛋白含量 (mg/dL)36.02 ± 1.86 38.72 ± 4.37 53.42 ± 5.11**&37.04 ± 2.39#21.03< 0.001 n 20 27 43 43 HT发病[n(%)]0 16(59.3)***39(90.7)***&30(69.8)#9.90 0.007脑出血评分0 1.12 ± 0.34***3.76 ± 0.25***&&&2.32 ± 0.29#38.52< 0.001
2.4 EGCG 可通过Nrf2-Keap1 通路预防急性高血糖诱导的HT采用网络药理学分析EGCG 在HT 中的潜在靶点。结果表明,EGCG 与高血糖卒中之间有366 个交叉目标,PPI 网络分析产生了139 个EGCG 的核心靶基因,这些基因作用于高血糖诱导的HT(图3A)。KEGG 通路富集分析结果显示,Nrf2-Keap1 通路富集35 个核心靶基因,HIF-1通路富集26 个基因,PI3K-Akt 通路富集35 个核心靶基因,EGFR 酪氨酸激酶抑制剂抗性途径中富集23 个基因(图3B)。

图3 EGCG 治疗高血糖诱导的HT 的网络药理学预测Fig.3 Network pharmacological prediction of EGCG in the treatment of hyperglycemia-induced HT
2.5 EGCG 促进急性高血糖后Nrf2-Keap1 通路的激活缺血后Nrf2 和Keap1 的表达水平明显降低,HG 进一步降低。与HG 组相比,EGCG 组Nrf2和Keap1 的表达水平显著增加(P< 0.05)(图4A)。同样,HG 组Nrf2 和Keap1 的表达显著降低和TLR4的表达、NF-κB 的磷酸化显著增加,但EGCG 逆转了这一过程(图4B)。

图4 EGCG 对急性高血糖后Nrf2-Keap1 信号通路激活的影响Fig.4 Effect of EGCG on activation of Nrf2-Keap1 signal pathway after acute hyperglycemia
3 讨论
作为脑卒中的严重并发症,高血糖诱发的HT越来越受到关注。由于病理机制复杂,临床上仍缺乏治疗药物。有必要寻找新的治疗药物改善脑卒中的预后。本研究结果表明,EGCG 预处理显著改善了IS 后急性高血糖引起的神经功能缺损和脑出血。它的影响可能与激活Nrf2-Keap1 介导的神经保护作用有关。
在这项研究中,我们使用了电凝诱导的血栓性卒中大鼠模型。CCA 中形成的血栓引起的MCA闭塞与人类血栓栓塞性卒中相似,适用于评估溶栓药物[13]。与传统的栓塞卒中模型相比,该模型还开发了可重复和可预测的梗死体积。基于该模型,通过诱导缺血性卒中后急性高血糖来评估EGCG 对HT 的影响。先前的一项研究[14]报道,MCAO 后急性高血糖大鼠的HT 发生率高于95%。本研究中HT 发生率为90.7%,符合实验要求。
EGCG 作为绿茶的主要活性成分。近期研究[15-16]发现,EGCG 通过调节线粒体呼吸功能和脂质代谢以及减少线粒体自噬和细胞凋亡来改善脑缺血,但EGCG 对HT 的影响尚不清楚。本研究结果表明,EGCG 改善了神经功能缺损和梗死体积,这与之前的研究[16]一致。值得注意的是,我们观察到EGCG 可以减轻高血糖诱导的HT 并降低HT的发病率和死亡率。先前的研究表明,高血糖通过IS 后的多种病理机制促进HT,例如促进能量代谢紊乱、氧化应激和神经炎症[17]。此外,高血糖会刺激HIF-1α 和VEGF 过表达以及PAI-1 的产生,导致血管功能异常,并通过刺激AIF-Caspase-3 通路诱导细胞凋亡[18]。这些病理机制导致神经血管稳态的破坏。本研究采用网络药理学预测EGCG 预防HT 的靶点和途径。网络药理学研究侧重于成分、靶点和疾病之间的相互关系,有助于阐明天然产物的作用机制和靶点[19]。结果表明,EGCG 的作用靶点复杂,与高血糖诱导的HT 信号通路相关,如Nrf2-Keap1 通路、HIF-1 通路、PI3K-Akt 通路和EGFR 通路。因此,这些通路可能是EGCG 减轻高血糖诱导的HT 的潜在途径。
在网络药理学预测的这些信号通路中,一些研究[20]表明Nrf2-Keap1 抑制了高血糖诱导的炎症损伤,被认为是减轻糖尿病血管疾病和血管功能障碍的保护因素。Nrf2 是生物防御系统抵高血糖刺激的关键介质,增加Nrf2 活性可能会抵消华法林的促出血作用[21]。在静止条件下,Nrf2 与Keap1结合,通过泛素化促进Nrf2 的快速蛋白酶体降解。然而,在急性高血糖应激期间,Nrf2 从Keap1 解离并促进Toll 样受体2 和4(TLR2,TLR4)的表达以及NF-κB 的核转位,导致神经炎症[22]。此外,高血糖会抑制Nrf2-Keap1 的产生和促进TLR4 的表达,从而激活NF-κB 信号通路,导致神经炎症[23]。因此,结合网络药理学的结果,我们进一步研究了Nrf2-Keap1 通路介导的神经炎症在高血糖诱导的HT 中的作用,结果证实了TLR4 和p-p65 的表达因高血糖而显著上调,而在EGCG 给药后受到抑制,表明EGCG 逆转了高血糖对Nrf2-Keap1 信号通路的抑制作用。
总之,急性高血糖通过抑制Nrf2-Keap1 信号通路,促进炎症因子的释放,进而诱导缺血性卒中后HT 的发生。EGCG 预处理防止了HT 的发生,这可能与激活Nrf2-Keap1 信号通路介导的神经保护作用有关。但结合网络药理学结果,EGCG 对高血糖增强HT 的保护作用可能还与血管功能和氧化应激有关,本研究并未对此进行分析。因此,EGCG 在HT 中的作用机制有待进一步探索。

