高甘油三酯葡萄糖乘积指数与腹膜透析患者病死率增加相关的队列研究
杨珊 李红英 周静璇 陈耀德 李亚琴 古梓棋 牛红心,
南方医科大学珠江医院1全科医学科,3特需医疗服务中心 (广州 510220);2广州市海珠区龙凤街社区卫生服务中心(广州510250)
在全球范围内,终末期肾脏病(end-stage renal disease, ESRD)的健康负担越来越沉重[1]。在2018-2019 年期间,根据我国对慢性疾病调查的研究表明,约有8 200 万慢性肾衰竭患者,但仅有10%左右的患者对自身的疾病有较为明确的认知。目前中国慢性肾脏病(chronic kidney disease,CKD)的患病率为8.2%[2]。近年来,由于低成本和便利性,腹膜透析(peritoneal dialysis, PD)已经逐渐成为肾脏替代治疗的优先选择[3]。尽管目前治疗策略在不断优化,但PD 患者心血管疾病(cardiovascular disease, CVD)的发生率仍然居高不下,占比高达40% ~ 50%,占据了致死因素的前列[4]。因此,探讨PD 患者死亡的预测因子是当前肾脏病学的一个重要课题。
研究显示,胰岛素抵抗(insulin resistance, IR)是CVD 的重要致病因素之一,与高血糖、高血压、血脂异常等都有着很大的关系,可以引起机体的炎症反应、凝血异常和动脉粥样硬化[5-7]。对于患有CKD 的人来说,在疾病的早期阶段就可能会出现血糖波动和影响胰岛素稳态的异常情况,并通过各种方式引发IR[8-9]。IR 与血脂异常会随着慢性肾脏病的进展而逐渐加重,尤其是在PD 患者中,腹膜透析液中的葡萄糖会进一步加重上述的代谢异常[10]。IR 与糖代谢改变在CKD 患者中很常见,并可能会改变PD 患者的生存期[11]。甘油三酯葡萄糖乘积指数(triglyceride glucose index, TyG)的计算方法是将血液中甘油三酯(triglycerides, TG)与空腹血糖(fasting plasma glucose, FPG)乘积得到,通常用ln[TG(mg/dL)×FPG(mg/dL)/2]计算出的值来表示。有研究表明,TyG 指数是IR 的一个可靠、简单的替代指标[12]。一项横断面研究显示,TyG指数对IR 的敏感度为81.1%,特异度为84.8%[12]。多个研究报道[13-15],TyG 指数能够简单、便捷、有效地识别IR。同时,TyG 指数是CVD 风险的重要早期生物标志物,在健康人群中,较高的TyG 指数和高CVD 病死率相关[16]。但对于PD 患者的TyG 指数与全因死亡和CVD 病死率之间关系的研究,目前鲜有相关报道。本研究探索了TyG 指数与PD患者全因死亡和CVD 死亡风险之间的关联性,旨在提供一种方便、快速、经济的临床预测指标,用于评估PD 患者的全因死亡和CVD 死亡风险。
1 资料与方法
1.1 研究对象本研究为单中心、回顾性队列研究。在南方医科大学珠江医院接受PD 治疗的患者中进行招募,时间为2007年1月1日至2018 年12月31 日,入组的具体流程详见图1。本研究已获得所有入组参与者及家属的知情同意(2023-KY-269-01)。入组标准为:(1)年满18 周岁;(2)PD 治疗时间为3 个月以上。排除标准:(1)FPG 或TG基线缺失的患者;(2)曾在其他医疗机构进行过PD 治疗的患者;(3)肾脏移植失败或由血液透析(hemodialysis, HD)转成PD 的患者。本研究符合纳排标准的所有患者均使用同一厂家(中国广州百特公司)提供的低钙PD 液、Y-套和双袋系统。这项回顾性队列研究符合STROBE 标准。

图1 本研究入组流程图Fig.1 Study flow
1.2 随访所有患者均随访至2018 年12 月31 日或转为HD、转至其他医疗中心、肾移植、死亡。在连续PD 开始后的前1 ~ 3 个月,对患者的基线数据进行收集,包括人口统计学资料和实验室资料:年龄、性别、ESRD 的主要病因、BMI 和在南方医科大学珠江医院中心实验室检测的血白细胞、血红蛋白(hemoglobin, Hb)、生化指标[血清白蛋白(serum albumin, Alb)、血清肌酐、白蛋白校正钙、血清磷、FPG、TG、总胆固醇(total cholesterol,TC)、血清铁蛋白、尿酸(uric acid, UA)等]。此后每3 个月进行一次生化抽血检查。根据国际PD 协会指南,对血脂异常的PD 患者进行评估和处理,要求患者至少每隔3 个月就要回到我中心进行一次综合评估,此外,每月需要与PD 护士进行电话联系,评估患者的一般情况和目前服用药物的情况;季度随访和每月的电话随访均用于临床治疗目的,而不是专门用于本研究。
1.3 相关定义CVD 定义为心绞痛、心肌梗死、心力衰竭、冠状动脉搭桥术、血管成形术或脑卒中[17]。糖尿病(diabetes mellitus, DM)患者定义为确诊2型糖尿病或/和正在接受胰岛素治疗或服用降糖药的患者。根据24 h收集的尿液和患者的体表面积,通过尿素和肌酐清除率来计算得出残余肾功能(renal residual function, RRF)。肾脏Kt/V 和腹膜Kt/V 是通过24 h 尿液和24 h 透析液计算出来的尿素清除率,总Kt/V 是肾脏Kt/V 和腹膜Kt/V 之和。
1.4 研究终点本研究终点为PD 患者CVD 死亡和全因死亡。CVD 死亡包括心脏骤停、心律失常、急性心肌梗死、心肌病、动脉粥样硬化性心脏病、充血性心力衰竭、缺氧脑病、缺血性脑损伤、脑血管意外和周围血管疾病。
1.5 统计学方法TyG 指标的计算方法为ln[TG(mg/dL)× FPG(mg/dL)/2]。根据TyG 指数的中位数将患者分为两组:一组为低TyG组,其中TyG指数< 8.44;另一组为高TyG 组,其中TyG 指数 ≥ 8.44。将时间平均的TyG 指数(Time-averaged TyG Index,TA-TyG 指数)也分两组:TA-TyG < 8.49 为低TATyG 组;TA-TyG ≥ 8.49 为高TA-TyG 组。
计数资料用例(%)表示,组间比较采用Pearson χ2检验或Fisher 精确检验。计量资料采用均数±标准差或M(P25,P75)表示,两组之间比较采用独立样本t检验或Mann-WhitneyU检验。用Kaplan-Meier 计算生存率,用log-rank 检验生存率的分布差异。采用Cox 回归模型对TyG 指数与死亡率进行相关分析。P< 0.05 为差异有统计学意义。使用SPSS 22.0 版本进行统计分析。
2 结果
2.1 高TyG 组与低TyG 组基本资料比较表1 列出了本研究PD 患者的基线人口统计学数据、临床数据和实验室特征,并根据TyG 指数的中位数进行了分类。具有可用基线TyG 指数的519 例患者被纳入研究,平均年龄为(50.7 ± 14.2)岁;59.0%患者为男性;28.1%患者合并有DM。最常见的原发性肾脏疾病是慢性肾小球肾炎(56.3%),其次是糖尿病肾病(16.2%)和高血压肾病(14.5%)。患者的基线中位血清TyG 指数为8.44(6.48,11.94),基线TyG 指数越高(≥ 8.44)的患者,CVD、高血压发生率越高,TG、FPG、TC、Alb、血清铁蛋白、UA 水平越高(P< 0.05)。
表1 高TyG 组与低TyG 组的 PD 患者临床特征比较Tab.1 Baseline characteristics of PD patients with baseline TyG index±s

表1 高TyG 组与低TyG 组的 PD 患者临床特征比较Tab.1 Baseline characteristics of PD patients with baseline TyG index±s
项目年龄(岁)男性[例(%)]BMI(kg/m²)收缩压 (mmHg)舒张压 (mmHg)并发症[例(%)]CVD糖尿病高血压白细胞(×109·L-1)Hb(g/dL)Alb(g/dL)TC(mg/dL)TG(mg/dL)FPG(mg/dL)HDL-C (mg/dL)LDL-C (mg/dL)血清UA(mg/dL)血浆铁蛋白(ng/mL)血清白蛋白校正钙(mg/dL)血清磷(mg/dL)血清肌酐(mg/dL)总Kt/V每周总肌酐清除率[L/(周·1.73 m2)]残余肾功能[mL/(min·1.73 m2)]低TyG组(n = 259)50.3 ± 13.6 158(61.0)21.73 ± 2.15 137.98 ± 16.23 83.16 ± 11.45高TyG组(n = 260)51.1 ± 14.8 148(56.9)21.60 ± 2.24 138.42 ± 17.17 82.93 ± 12.62 P值0.492 0.658 0.727 0.656 0.724 59(22.8)68(26.3)108(41.7)7.11 ± 2.55 9.70 ± 2.04 3.17 ± 0.39 164.47 ± 43.51 128.88 ± 81.53 90.49 ± 16.83 46.85 ± 17.18 105.16 ± 35.48 6.97 ± 1.66 323.40 ± 105.59 8.42 ± 0.80 6.01 ± 1.52 8.84 ± 4.15 2.18 ± 0.57 61.54 ± 20.15 4.43 ± 4.51 103(39.6)78(30.0)139(53.5)7.27 ± 2.49 9.81 ± 2.14 3.26 ± 0.40 180.09 ± 44.97 158.10 ± 84.77 96.84 ± 16.78 45.26 ± 15.45 108.50 ± 40.70 7.42 ± 2.01 390.54 ± 118.27 8.50 ± 0.96 6.10 ± 1.49 9.60 ± 2.77 1.98 ± 0.42 58.14 ± 20.44 4.29 ± 4.50 0.001 0.344 0.007 0.477 0.462 0.013< 0.001< 0.001< 0.001 0.520 0.320 0.005 0.042 0.411 0.362 0.132 0.231 0.158 0.773
各组间性别、年龄、BMI、血压、血清肌酐、Hb、血清磷、血清白蛋白校正钙、RRF、总KT/V、每周总CrCl 比较,差异均无统计学意义(P> 0.05)。Spearman 秩相关分析显示,TyG 指数水平与Alb(P< 0.01)、TG(P< 0.01)、UA(P< 0.05)呈正相关。
2.2 TyG 指数和病死率中位随访时间为35.4(8,101)个月。有104 例患者死亡,20 例行肾移植,49 例转为HD,17 例转入其他中心,12 例失访。
在104 例死亡病例中,55 例因CVD 死亡,27 例因感染性疾病死亡,4 例因恶性肿瘤死亡,4 例因恶病质死亡,6 例死于其他原因,8 例死因不明。
55 例因CVD 死亡的患者中,24 例死于脑血管意外,11 例死于急性心肌梗死,9 例死于充血性心衰,9 例死于心脏骤停,2 例死于周围血管疾病。
见图2,基于不同的基线水平的TyG 指数对全因死亡风险及CVD 相关死亡风险的影响进行了Kaplan-Meier 生存分析。结果显示,低TyG 组第1 年、第3 年和第5 年的累计存活率分别为99.2%、89.6% 和80.7%;而高TyG 组则分别为97.7%、82.7%和59.2%。低TyG 组CVD 累计生存率分别为98.8%、93.4%和89.4%,高TyG 组分别为98.8%、89.2%和79.1%。在对原始病例数据分析时,TyG指数组间及其与全因病死率和CVD 病死率的相关性存在显著差异(log rank test 分别为P< 0.001和P= 0.003)。同样,在原始病例数据分析中,TA-TyG指数较高的患者全因病死率和CVD病死率也较高(log rank test 分别为P= 0.001 和P=0.006),见图3。
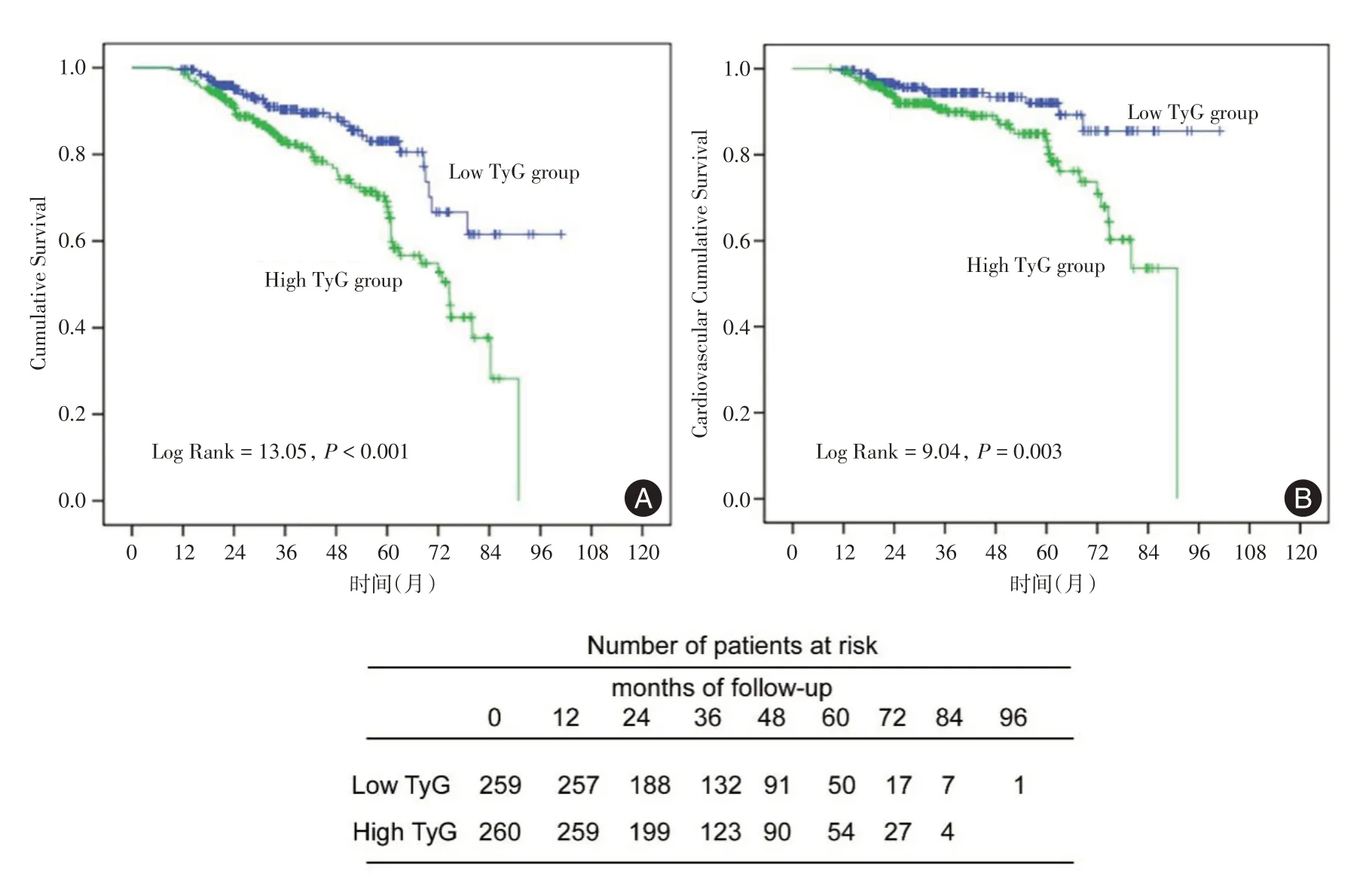
图2 PD 患者不同基线 TyG 指数水平的 Kaplan-Meier 曲线Fig.2 The Kaplan-Meier curves for PD patients with varying initial TyG indices are presented
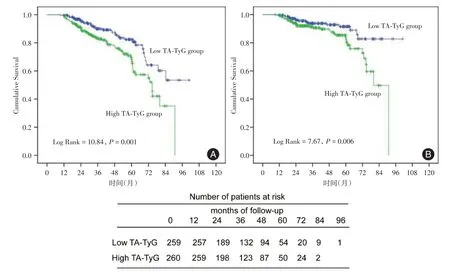
图3 PD 患者不同时间平均的TyG 指数的Kaplan-Meier 曲线Fig.3 The Kaplan-Meier curves display the outcomes of PD patients categorized by their time-averaged TyG index levels
2.3 TyG 指数与病死率的关系不同模型中TyG指数和病死率的关系见表2。在COX 回归分析中,经过了包括年龄、性别、BMI、CVD、高血压、DM、Hb、Alb、TG、RRF、血清铁蛋白的校正后,我们发现相比较于低TyG 组,高TyG 组有着更高的全因死亡风险以及心血管死亡风险(HR= 2.22,95%CI: 1.43 ~ 3.44,P< 0.001;HR= 2.50,95%CI:1.34 ~ 4.65,P= 0.004);同时我们也观察到,与低TA-TyG 组相比较,高TA-TyG 组的全因死亡风险和CVD 死亡风险也均明显地有所增加(分别为HR= 1.90,95%CI: 1.25 ~ 2.90,P= 0.003 和HR=2.05,95%CI: 1.14 ~ 3.70,P= 0.017),见表2。

表2 TyG 与死亡率之间的关系Tab.2 Relationship between the TyG index and mortality
3 讨论
本研究涵盖了来自中国南部地区的519 例定期进行PD 的患者,结果显示基线的TyG 指数越大,PD 患者的全因死亡及CVD 死亡风险就越高。同时,我们也考虑到了TyG 指数可能会因为观察时间的延长而有所变化,因此我们对时间平均的TyG 指数(TA-TyG 指数)也进行了分析,发现在观察期间内,TA-TyG 指数越高,PD 患者发生全因死亡或CVD 导致死亡的几率也会相应增加。
根据已有的研究数据,在PD 患者中,心血管事件的死亡率较高,约占所有死亡事件的40% ~50%[4],这与本研究中,PD 患者因心血管事件导致的死亡在总死亡人数中的比例(52.9%)大致相符。有研究指出,在接受连续腹膜透析治疗的患者中,其血脂异常的发生率较高,而且胰岛素血症的发生率也较高[18-19]。本研究也发现了这一现象,即基线较高的TyG 指数水平与PD 患者的总胆固醇、血清TG 水平升高有关。SANCHEZ-INIGO 等[16]研究显示,患者发生CVD 的风险也会随着TyG 指数的升高而增加。两者的正相关性在混杂因素调整之后依然存在。TyG 指标在评估健康成年人群心血管疾病发病风险方面具有显著的前瞻性作用,为临床实践提供了重要参考,可以更好地反映健康人群中CVD 的风险情况[16,20]。
PD 患者常有血脂异常,PD 也会导致PD 患者血脂异常[21]。本研究表明,高TyG 指数的PD 患者与全因死亡率及CVD 死亡率明显相关。这一结论与YAN 等人[22]在3 054 例PD 患者中得出的研究结论相一致,他们发现较高的TyG 指数显著地与PD 患者的全因死亡率和CVD 死亡率有关。
本研究发现,PD 患者的全因死亡率和CVD 死亡率与TyG 指数相关,可能的机制与胰岛素抵抗有关。既往研究证实,在导致CVD 的重要因素中,胰岛素抵抗是其中之一[5-7]。目前研究显示,胰岛素抵抗可能会引发机体的炎症反应,凝血功能异常和动脉粥样硬化[7,23],而这些都被认为是导致CVD 的危险因素。
Kaplan-Meier 生存分析得出基线或时间平均TyG 指数低的PD 患者生存率较高。众所周知,长期接受腹膜透析治疗的患者往往会面临着营养不良和炎症问题,这两个问题都是潜在的CVD 发展风险因素[24],而且这些因素也会影响我们使用TyG 指标预测PD 患者预后的能力。一项研究显示,PD 患者的血脂异常是冠心病、脑卒中和动脉粥样硬化等CVD 的主要危险因素[25]。这些因素使PD 患者的TyG 指数偏高,让他们面临更高死亡风险。在未校正模型中,高TyG 指数患者比低TyG 指数患者的CVD 死亡和全因死亡率更高。在对混杂因素进行了校正后,我们依然发现基线时TyG 指数较高的患者之后发生CVD 死亡和全因死亡的风险也更高。因此,本研究具有一定的临床意义,通过推动优化治疗方案(如药物和体力活动)的使用,可以促进改善PD 患者的IR 和降低他们患CVD 的风险。
本研究的局限性:关于PD 患者的TyG 指数与全因病死率以及CVD 病死率之间的因果关系,目前还没有确切的定论。其次,本研究的样本规模相对较小,且参与者均来自中国的南部地区,因此该研究结论的普适性受到了一定的限制。最后,本研究未对酒精、果汁以及其他糖类的摄入量进行评估,而这些因素均可能会对血液中的TG 水平产生一定的影响。
CKD 患者主要死因是CVD 死亡。本研究发现,PD 患者的CVD 死亡风险升高与较高的TyG 指数有关。众多研究已经表明,TyG 指数是一种可以代替IR 的指标,它与CVD 的不良结局有着非常紧密的关系[26]。TyG 指数与其他常规的IR 标志物相比, 具有较低的费用和简单的操作过程,这使得其在早期识别并介入PD 患者的预防心血管事件方面具有着巨大的实用价值。通过进一步探索TyG 指数与PD 患者病死率之间的关联,我们可以找到更多具有经济效益的方法去预防PD 患者发生心血管相关的死亡事件。然而,仍需行前瞻性研究探索高TyG 指数与PD 患者全因及CVD 死亡风险的关联机制。

