增强CT和MRI在鉴别鼻腔鼻窦鳞状细胞癌与淋巴瘤中的应用
陈海静 杨亚英 赵卫 胡继红 吴莉 郑凌琳 吴岩 李青青
昆明医科大学第一附属医院医学影像科(昆明 650032)
鼻腔鼻窦因解剖结构复杂,可发生多种良恶性肿物,良性肿物以炎性息肉多见,恶性肿物以恶性肿瘤为主[1]。与其他头颈部恶性肿瘤相比,鼻腔鼻窦恶性肿瘤相对不常见,约占头颈部恶性肿瘤的3%~5%、全身恶性肿瘤的0.2% ~ 0.8%[2-4],肿瘤发病隐匿,恶性程度高,多数患者就诊时已至晚期,总体预后差。鼻腔鼻窦鳞状细胞癌(squamous cell carcinoma, SCC)与鼻腔鼻窦非霍奇金淋巴瘤(non-Hodgkin′s lymphoma,NHL)是发生在鼻腔鼻窦区域两种不同的恶性肿瘤,两者治疗策略不同,准确鉴别诊断对于制定个体治疗方案及预后至关重要。但两者临床表现没有明显差异,其鉴别诊断存在一定的难度。CT 和MRI 检查是诊断及鉴别鼻腔鼻窦肿瘤的必要检查方法,在鼻腔鼻窦肿瘤诊治中发挥重要作用,鼻腔鼻窦肿瘤都应进行CT 和MRI 检查以明确鼻窦有无解剖变异、病变累及范围、邻近器官有无侵犯及对病变进行定性诊断,但目前鲜见CT 和MRI 鉴别鼻腔鼻窦NHL 和SCC 的相关研究。因此本研究拟探讨鼻腔鼻窦SCC 与NHL 在增强CT 和MRI 的影像特征,分析不同影像特征在鼻腔鼻窦SCC 与NHL 中的鉴别效能,为临床诊断及治疗提供更有价值、更准确的信息。
1 资料与方法
1.1 一般资料收集2018 年3 月至2023 年2 月在昆明医科大学第一附属医院行鼻窦增强CT和鼻窦增强MRI 检查的患者影像学及临床资料。纳入标准:(1)术前于本院行鼻窦增强CT 和鼻窦增强MRI检查者;(2)术后病理检查证实为鼻腔鼻窦NHL 或SCC;(3)检查前未接受手术、放化疗等特殊治疗。排除临床病史、病理资料或影像学资料不全,以及图像伪影重影响观察的病例。所有患者行鼻窦增强CT 和鼻窦增强MRI 检查前均签署知情同意书。SCC 患者中,低分化、中分化、高分化依次为25 例(69.4%)、10 例(27.8%)、1 例(2.8%)。两组患者的年龄组间比较差异无统计学意义(P> 0.05),性别组间比较差异有统计学意义(P< 0.05),SCC 男性多见。见表1。
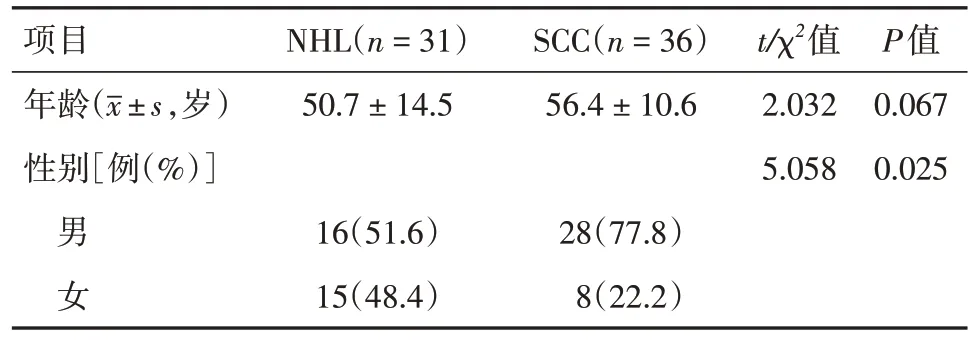
表1 患者特征Tab.1 Patient characteristics
1.2 检查方法
1.2.1 CT 检查CT 扫描采用Siemens Somatom Definition Flash 双源CT、Philips IQon spectrum CT 或美国GE Revolution CT。扫描范围:自额窦上缘至硬腭。扫描参数:管电压100 ~ 120 kVp;管电流采用自动管电流调节技术;准直器宽度64 × 0.625 mm;X 线管转速0.5 s/周;螺距0.985。增强扫描使用非离子型碘对比剂(碘海醇,350 mgI/mL)经高压注射肘静脉给药,剂量80~100 mL(1.2~1.5 mL/kg 体重),流速3.0 ~ 3.5 mL/s,并以相同流速注射30 mL生理盐水进行冲洗,于30 s 和60 s 扫描动脉期及静脉期图像。所有图像层厚及层间距为1 mm。
1.2.2 MRI 检查MRI 扫描采用Philips 1.5 T MRI扫描仪、Philips 3.0 T MRI 扫描仪或SIEMENS MRI 1.5TI 扫描仪,各仪器均使用8 通道头颈联合线圈,扫描范围:前颅窝、鞍隔水平至第二颈椎下缘,包括整个鼻腔鼻窦或整个病变。扫描参数:平扫采用快速自旋回波序列,T1WI:TR 350 ~ 500 ms,TE 8 ~ 20 ms;T2WI:TR 3 000 ~ 4 500 ms,TE 90 ~ 120 ms;冠状位压脂T2WI:TR 3 000 ~ 4 500 ms,TE 90 ~120 ms;增强扫描:TR 8.4 ms,TE 4.0 ms;对比剂:钆喷替酸葡甲胺(GD-DTPA)0.1 mL/kg 体质量,注射流率2.5 mL/s 经肘静脉注射后行横轴位、矢状位和冠状位T1WI 增强扫描,层厚4.0 ~ 5.0 mm,层间距0 ~ 1 mm。
1.3 图像分析所有影像资料经两名具有5 年以上头颈部影像诊断经验的放射科医师在不知道病理结果的情况下独立阅片分析,观察分析内容包括:肿瘤起源部位、肿瘤最大直径、CT 密度及增强强化程度、MRI 信号及增强强化程度、肿瘤内部坏死、临近骨质破坏、对周围组织的侵犯、扫描范围内是否有颈部淋巴结转移等影像表现特征。出现意见分歧时,经另一名具有15 年以上头颈部影像诊断经验的放射科医师阅片,给出最终结论。增强强化程度分为明显强化、中度强化、轻度强化3 组,“轻度强化”被定义为与相邻肌肉相似或更低的增强程度;“中度强化”定义为增强程度介于鼻黏膜和邻近肌肉强化程度之间;“明显强化”定义为增强程度与鼻黏膜接近或更高[5]。颈部淋巴结转移被定义为淋巴结短径> 1.0 cm 或增强图像上伴局灶性低密度区或增强图像上局灶性未增强区域;肿瘤内部坏死被定义为增强图像上局灶性低密度区域或增强图像上局灶性未增强区域[6]。
1.4 统计学方法采用SPSS 26.0统计分析软件进行分析,Kolmogorov-Smirnov 检验用于分析计量资料是否服从正态分布,符合正态分布的计量资料以均数±标准差表示,采用独立样本t检验进行组间比较;非正态分布的计量资料采用M(P25,P75)表示,组间比较采用Mann-Whitney 检验。计数资料以例(%)表示,采用χ2检验或Fisher 精确检验。采用受试者操作特征(receiver operating characteristic,ROC)曲线及曲线下面积(area under curve, AUC)分析不同影像学特征鉴别鼻腔鼻窦SCC 和NHL的效能。AUC < 0.7、0.7 ≤ AUC < 0.9、AUC ≥ 0.9 分别代表诊断效能较差、良好、极好[7]。鼻窦NHL 与SCC 组患者年龄、肿瘤最大径均服从正态分布,组间差异比较采用两独立样本t检验。其中肿瘤最大直径Levene 方差齐性检验P= 0.155 > 0.05,认为方差齐。两组间年龄Levene 方差齐性检验P=0.159 > 0.05,认为方差齐。两组间肿瘤起源部位、CT 强化均匀度、肿瘤内部坏死、临近骨质破坏、对周围组织的侵犯、颈部淋巴结转移的比较采用χ2检验,而MRI 强化均匀度中有2 个单元格的期望计数小于5,最小期望计数为1.85,采用Fisher 精确检验。
2 结果
2.1 影像学表现鼻腔鼻窦SCC 与NHL 的肿瘤起源部位、肿瘤最大径、肿瘤内部坏死、周围骨质破坏以及周围组织侵犯5 个影像学特征组间差异有统计学意义(P< 0.05),与鼻腔鼻窦SCC 相比,NHL 全部起源于鼻腔,肿瘤最大径较小,肿瘤内部坏死、周围骨质破坏少见,但周围组织侵犯更常见。见表2 和图1 - 2。

图1 左侧鼻腔淋巴瘤的CT、MRI 图Fig.1 CT and MRI images of left nasal lymphoma
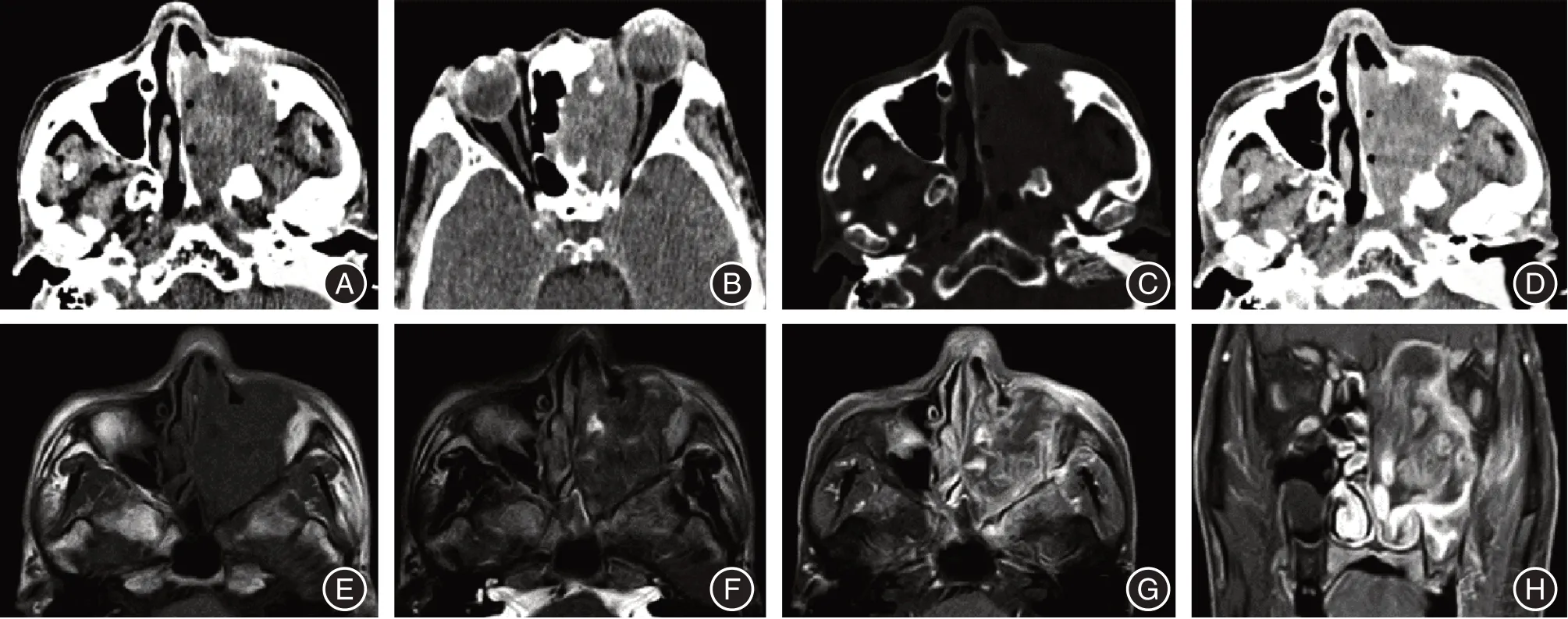
图2 左侧上颌窦鳞状细胞癌的CT、MRI 图Fig.2 left maxillary sinus squamous cell carcinoma

表2 鼻腔鼻窦SCC 与NHL 影像学表现Tab.2 Nasal sinus SCC and NHL imaging findings例(%)
2.2 鉴别诊断效能对差异有统计学意义的影像学特征绘制ROC 曲线,ROC 曲线显示肿瘤起源部位、肿瘤最大径、肿瘤内部坏死、周围骨质破坏以及周围组织侵犯的AUC 分别为0.708、0.694、0.785、0.850、0.629;其中肿瘤起源部位、肿瘤内部坏死、周围骨质破坏的AUC 较大(AUC 均> 0.7),鉴别诊断效能较高。将肿瘤起源部位、肿瘤内部坏死、周围骨质破坏三者联合,联合影像表现的AUC 为0.969,具有较高的鉴别诊断准确度,鉴别鼻腔鼻窦SCC 和NHL 的敏感度为83.9%,特异度为97.2%,因此可认为联合特征的鉴别价值最大。见表3、图3。

图3 肿瘤起源部位、内部坏死、骨质破坏及三者联合特征鉴别的ROC 曲线Fig. 3 ROC curves for tumor origin site, internal necrosis,bone destruction and joint feature identification of the three

表3 各影像学特征对鼻腔鼻窦SCC 和NHL 鉴别诊断效能Tab.3 Efficacy of imaging features in differential diagnosis of nasal sinuses SCC and NHL
3 讨论
鼻腔鼻窦是上呼吸道重要的解剖结构,两者均为含气腔隙,通过窦口相通,常将其视为一个功能单位。发生在鼻腔鼻窦的恶性肿瘤病理类型多样,以SCC 为主,根据2017 年WHO 头颈部肿瘤分类[8],鼻腔鼻窦SCC 可以分为角化型SCC、非角化型SCC、梭形细胞型SCC、淋巴上皮样癌以及未分化癌。鼻腔鼻窦SCC 约占头颈部恶性肿瘤的3%、鼻腔鼻窦恶性肿瘤的60%[6,9]。NHL 是鼻腔鼻窦区第二大常见原发性恶性肿瘤,约占鼻腔鼻窦恶性肿瘤的11% ~ 17%[10-11],可以分为B、T 和 NK/T细胞淋巴瘤3 种亚型,其中NK/T 细胞淋巴瘤是最常见的类型。鼻腔鼻窦NHL 和SCC 均可表现为鼻塞流涕、涕中带血或鼻出血等临床症状,表现不具特异性。鼻腔鼻窦SCC 的主要治疗方法是手术切除,术后辅助放疗或化疗,而鼻腔鼻窦NHL 采取放疗和化疗相结合的治疗方法[12-13],术前明确诊断并给予正确的治疗,预后截然不同。活检是鉴别鼻腔鼻窦NHL 和SCC 的金标准,但活检是有创检查,且肿瘤通常合并炎症、坏死,取材范围不足时往往会被误诊,因此,寻求一种无创、有效的检查来鉴别两者至关重要。
鼻腔鼻窦病变检查方法多样,包括鼻内镜、CT、MRI、PET/CT 等。鼻内镜可以观察鼻腔鼻窦肿物的颜色、形态及质地,但无法显示肿物内部结构、周围侵犯及远处转移情况。CT 检查是鼻腔鼻窦肿物的重要检查方法,成像速度快,能够较好地显示骨结构,增强检查可以鉴别肿瘤与阻塞性炎症,但对肿瘤性病变的诊断价值有限。MRI 软组织分辨率高,无辐射[14],对肿瘤的颅底及颅内侵犯较敏感,增强MRI 检查可以更好确定病变浸润范围及分期,但对骨质及钙化的显示不如CT,对较小病变观察价值有限。PET/CT 可以评价肿瘤远处转移情况,提高临床对恶性肿瘤分期的准确性,对肿瘤治疗后复发进行监测[15],但辐射剂量大,费用昂贵,扫描时间长。CT 和MRI 是鼻腔鼻窦恶性肿瘤的必要检查方法,两者在鼻腔鼻窦肿瘤中各有优劣势,相辅相成。增强CT 与MRI 相结合,可以相互弥补不足,细致观察病变软组织内部和范围特点、骨质改变和临近结构侵犯情况,提高疾病诊断效能、提示肿瘤的软组织成分并评估肿瘤浸润骨窦壁以外的程度,更好地区分鼻腔鼻窦肿瘤性病变[16-18]。
在本研究中,鼻腔鼻窦NHL 全部起源于鼻腔,沿着鼻腔黏膜弥漫性浸润生长,周围侵犯范围大于骨质破坏,骨质破坏轻微。与SCC 相比,NHL 全部起源于鼻腔,密度及信号更为均匀,肿瘤最大径较SCC 小,CT 增强呈较均匀强化,MRI 增强检查更倾向于明显均匀强化,与既往研究[19-20]认为鼻腔鼻窦NHL 沿鼻窦壁生长,伴骨质侵润性吸收,骨质破坏轻微,病灶较为均匀、少见坏死相符。而鼻腔鼻窦SCC 多起源于鼻腔,其次为上颌窦,肿瘤内部坏死更多见,因此在CT 平扫上多表现为不均匀密度,增强呈明显不均匀强化,MRI 上多为混杂信号,增强呈明显不均匀强化,周围骨质破坏更为明显,肿瘤多呈破坏性生长,周围软组织侵犯范围更为广泛,多累及颞下窝、眼眶等周围结构。本研究表明肿瘤起源部位、肿瘤内部坏死以及骨质破坏有助于鉴别两者,其中三者联合影像特征的鉴别诊断效能最高,敏感度和特异度分别为83.9%、97.2%,优于单个影像学特征,有助于提高鉴别诊断效能,与以往研究[21-23]认为骨侵蚀、肿瘤坏死和软组织侵犯可能有助于鉴别诊断部分相符。KIM等[5]研究发现鼻腔鼻窦NHL 较SCC 体积大,但在本研究中,鼻腔鼻窦SCC 的最大直径较NHL 大,周围软组织侵犯范围更广,可能与样本量较少、所纳入均为NK/T 细胞淋巴瘤病例有关。因此,在增强CT 和MRI 图像上,当肿物起源于鼻腔,密度及信号更为均匀,增强呈较均匀强化,肿瘤呈浸润性生长,坏死少见,骨质破坏轻微,应优先考虑鼻腔鼻窦NHL 的可能。
本研究有几个局限性:(1)患者的样本量较小,后续将进一步加大样本量。(2)NHL 亚型中只纳入了NK/T 细胞淋巴瘤,没有针对肿瘤的其他组织学亚型进行进一步鉴别分析。
综上所述,肿瘤起源部位、肿瘤最大径、肿瘤内部坏死、骨质破坏以及周围组织侵犯有助于鼻腔鼻窦SCC 与NHL 的鉴别,尤其是出现肿瘤起源于鼻腔,内部坏死少见,骨质破坏轻微,应优先考虑鼻腔鼻窦NHL 的可能。增强CT 和MRI 有助于鼻腔鼻窦SCC 与NHL 的鉴别,联合使用有助于提高鉴别诊断效能。

