烷烃知识点梳理与拓展
■广东省佛山市高明区教师发展中心 雷范军
烷烃是组成和结构上最基础的有机物,是产生其他衍生物的碳骨架基础,承载了有机物母体和碳骨架基础两个属性。有机物的通性源于其分子中官能团之外的烃基,排除碳碳双键、碳碳三键和苯基的影响,实际上主要体现的是烷烃的性质。因此,我们需要基于烷烃认识有机物在生产生活中的广泛应用、组成、结构、通性和有机反应的特点。
一、目标导航
1.通过感受生活中常用的烷烃燃料(甲烷、丙烷、丁烷、煤油等)的重要作用,认识有机化合物中碳原子的成键特点和烷烃的结构与组成,加深与烷烃相关的有机物通性的认识,增强合理利用化学品的意识。
2.从化学角度分析生活中使用其他含烷烃的物质(如凡士林、石蜡等)的一些现象,根据甲烷的性质及生活常识推测烷烃可能具有的物理性质和化学性质,建立烷烃性质与用途的关联,促进知识融会贯通、学以致用。
3.通过实际用途(燃料、石油化工和天然气化工原料)和实验探究烷烃的氧化反应(燃烧)、取代反应(卤代)和分解反应(热裂),提升考生对烷烃与烯烃、芳香烃及烃的衍生物结构与性质的学科理解水平,初步形成基于物质类别对物质性质进行预测和检验的认知模型。
4.从有机物通性的视角分析解决一些情境化问题(聚乙烯、聚丙烯等合成材料为何会老化,全氟代有机物为何抗老化,废塑料何以能够制油),构建完整认识有机物性质的视角,认识烷烃在有机物知识体系中的重要意义。
二、重点梳理
1.烷烃的分子结构与组成(见表1)。

表1
研究发现,无论是直链烷烃还是支链烷烃,它们的结构与甲烷相似,所含共价键全部是单键。进一步研究证明,烷烃分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向的sp3杂化轨道与氢原子或其他碳原子结合,形成C—H 或C—C σ键。链状烷烃的组成通式为CnH2n+2(n≥1),结构相似、分子组成上相差一个或若干个CH2原子团的烷烃,互称为同系物。
2.烷烃的物理通性及其与组成的关系。
(1)根据图1 中烷烃所含碳原子数与沸点变化曲线预测,丁烷为什么能作打火机的理想充入气体? 因为沸点太低了不行,难以液化,沸点太高了也不行,不易气化。丁烷的沸点为-0.5 ℃,常温下加压易液化,减压后又迅速气化,因此丁烷是打火机的理想填充气体。

图1
(2)烷烃的沸点与碳原子数之间存在什么样的变化规律? 结合曲线图分析,碳原子数越多,烷烃的相对分子质量越大,范德华力越大,沸点越高。
(3)烷烃还有哪些物理性质呢? 随着碳原子的增加,烷烃的物理性质有什么样的变化规律? 烷烃的组成有什么特点? 与烷烃的物理性质之间有什么关系? 烷烃的物理性质既具有密度小、溶解性能较好等相似性,又随碳原子数增大呈现出递变的规律(见表2)。
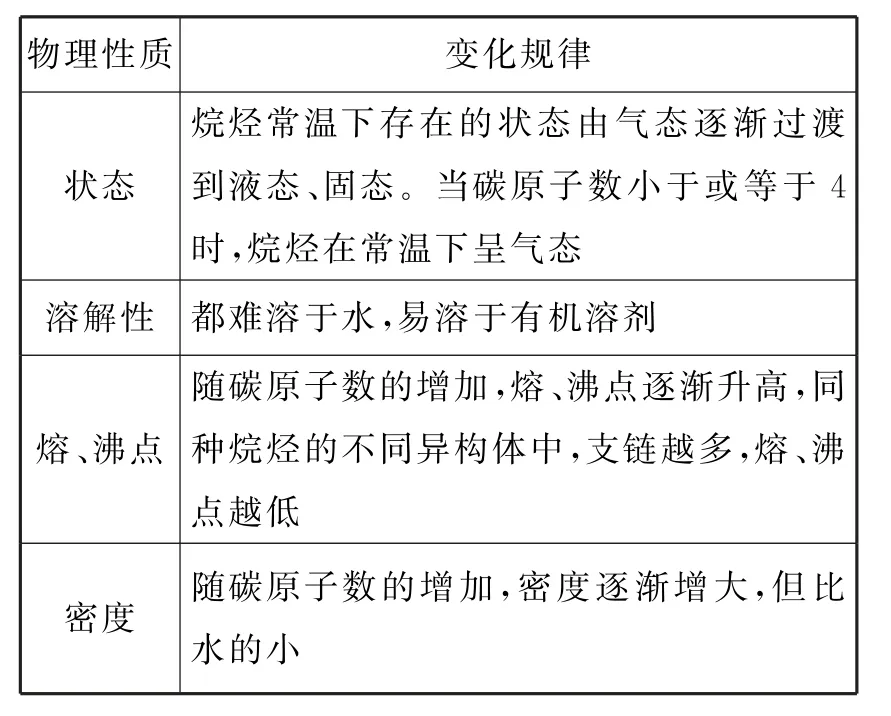
表2
3.烷烃的化学性质。
烷烃分子中, C—C键和C—H 键中的σ键比较牢固,需要吸收较高能量才能断裂;C与H 的电负性差异较小,σ键电子不易偏向某一原子,分子中电子分布较均匀,对亲核或亲电试剂均无特殊亲和力。与烯烃、炔烃、芳香烃及烃的衍生物相比,烷烃较为稳定,化学性质相对贫乏。
(1)与酸性KMnO4溶液、溴的四氯化碳溶液、强酸溶液、强碱溶液不能反应。
(2)氧化反应——可燃性。
断裂C—H 键、C—C 键和O═ O 键,形成C═ O 键和H—O 键。
烷烃都具有可燃性,这一性质决定了烷烃在生活、生产中的重要用途,常用作燃料。
(3)特征反应——取代反应。
甲烷与氯气的反应中,断裂C—H 键和Cl—Cl键,形成C—Cl键和H—Cl键。其他的烷烃物质也可以在光照或高温下与氯气、液溴等卤素单质发生取代反应。
烷烃受热时,会分解产生含碳原子数较少的烷烃和烯烃。石化工业中的裂化和裂解,资源再生中的废塑料制油等过程,都利用了与烷基性质相关的有机物在高温下发生分解的通性。
烷烃这一类物质,在结构上存在相似性,也就决定了它们在化学性质上的相似性。从典型代表物的性质入手,通过分析物质的结构来推测、学习同一类别物质的性质,这是我们学习有机化学的一种重要方法。
三、方法指导
1.烷烃知识的结构化。
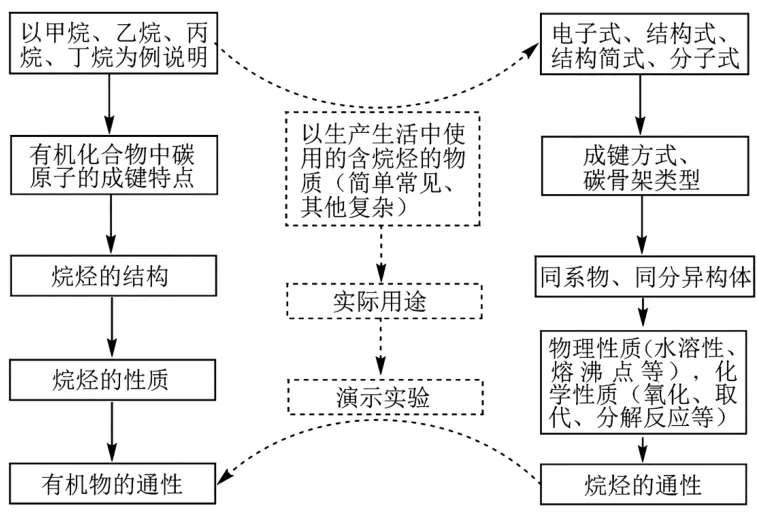
2.适当拓展延伸与烷烃相关的有机物通性。
塑料、橡胶、合成纤维等有机材料应用非常广泛,但普遍存在由热老化、机械老化、化学老化等所导致的耐久性不足问题。其中的化学老化,一方面源于考生较为熟悉的官能团,如高分子链节中碳碳双键、酯基、酰胺键等在环境因素作用下发生的化学反应;另一方面则与链节碳骨架中烷基的化学反应有关。
烷烃(烷基)除了燃烧氧化,在催化剂、光照等作用下,分子中的C—H 键断裂,还可发生部分氧化反应,生成醛、酮、羧酸等有机物;或与卤素作用,发生取代反应。芳香烃侧链的氧化反应和醛、酮、羧酸的α位卤代反应等,均体现了源于烷基化学反应的有机物通性。
这也解释了聚乙烯、聚丙烯等链节中缺乏活性官能团的合成材料的老化,以及卤素单质等对其老化的加速作用。同样,基于以上原理,为满足抗老化、防腐蚀和灭火阻燃等要求,就需要排除与有机物分子所含烷基中C—H 键相关通性的影响。其中的一种做法是以较稳定的C—F键代之,使用全氟代有机物,如聚四氟乙烯塑料、七氟丙烷灭火剂等。
四、跟踪小练
1.下面是4个碳原子相互结合的6种方式(氢原子没有画出),其中符合通式CnH2n+2的是( )。

A.②③ B.①⑤
C.②③④ D.①⑤⑥
2.有一类有机硅化合物中只含有硅元素和氢元素,叫硅烷,它们的分子组成与烷烃相似,其中有一种结构最简单的硅烷叫甲硅烷(SiH4),则有关描述不正确的是( )。
A.硅烷的分子通式可表示为SinH2n+2
B.甲硅烷燃烧生成SiO2和H2O
C.甲硅烷的沸点高于甲烷
D.甲硅烷的稳定性比甲烷强
3.在1.013×105Pa下,测得某些烷烃的沸点见表3。据表分析,下列说法正确的是( )。

表3
A.在标准状况下,新戊烷是气体
B.在1.013×105Pa、20 ℃时,戊烷都是液体
C.烷烃随碳原子数的增加,沸点降低
D.分子式为C5H12的烷烃的同分异构体中,随支链的增加,沸点降低
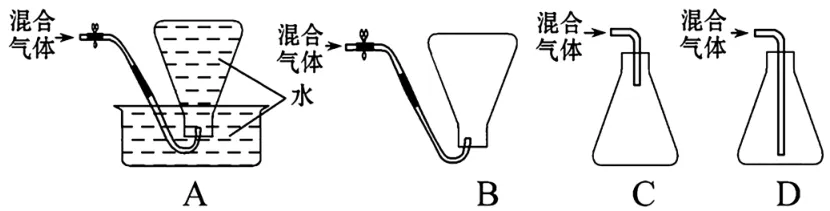
4.某化学课外活动小组为测定某厂生产的液化石油气(设该液化石油气由丁烷和丙烷组成)的平均相对分子质量,在实验中需收集该混合气体样品,下列收集方法中正确的是( )。
5.由沸点数据:甲烷-146 ℃,乙烷-89 ℃,正丁烷-0.5 ℃,戊烷36 ℃,可以判断异丁烷的沸点可能是( )。
A.低于-89 ℃ B.低于-0.5 ℃
C.高于-0.5 ℃ D.高于36 ℃
6.北京2022 年冬奥会火种灯独具中国文化特色,其造型灵感来自“中华第一灯”——西汉长信宫灯,借“长信”之意,表达人们对光明与希望的追求和向往。火种灯燃料是丙烷(C3H8)气体,下列关于丙烷说法不正确的是( )。

A.分子中碳原子不在一条直线上
B.难溶于水,熔沸点比乙烷高
C.不能发生氧化反应
D.不存在同分异构体
7.等质量的下列烷烃完全燃烧,生成CO2和H2O,耗氧量最多的是( )。
A.C2H6B.C3H8
C.C4H10D.C5H12
8.下列关于烷烃性质的叙述不正确的是( )。
A.烷烃的沸点随着相对分子质量的增大而逐渐升高,常温下烷烃的状态随碳原子数的增加由气态→液态→固态
B.烷烃都能使溴水、酸性KMnO4溶液褪色
C.在烷烃分子中,所有的化学键都是单键
D.烷烃和卤素单质在光照条件下能发生取代反应
9.一溴甲烷被广泛用于土壤消毒和消灭害虫,但在蒙特利尔条约中属于逐步禁用的药品。下列说法错误的是( )。
A.一溴甲烷的化学式是CH3Br
B.可以利用加成反应制备一溴甲烷
C.一溴甲烷中只含共价键
D.一溴甲烷不存在同分异构体
10.有机化合物M、N 的结构简式如下所示。下列说法错误的是( )。
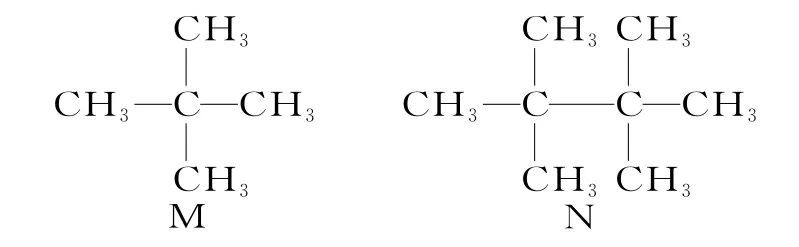
A.M、N 都不能使酸性KMnO4溶液褪色
B.M 有两种同分异构体
C.M、N 分子中每个碳原子都形成4 个共价键
D.等质量的M、N 在足量氧气中燃烧,完全燃烧时生成CO2的质量相同
11.2,2-二甲基丁烷发生一氯代反应时,得到的一氯取代物最多有( )。
A.2种 B.3种
C.4种 D.5种
12.全氟烷烃的同系物有CF4、CF3—CF3、CF3—CF2-CF3等,下列关于全氟烷烃同系物的表述不正确的是( )。
A.全氟烷烃属于大气污染物,能破坏臭氧层
B.全氟烷烃属于卤代烃
C.全氟烷烃能发生加成反应
D.全氟烷烃的通式为CnF2n+2(n≥1)
13.丙烷卤代反应的部分反应机理(以Cl2为例)如下:
Ⅰ.Cl2(g) →2Cl·(g)
Ⅱ.CH3CH2CH3(g)+Cl· (g) →CH3HCH3(g)+HCl(g)
Ⅲ.CH3HCH3(g)+ Cl2(g) →CH3CHClCH3(g)+Cl·(g)
其中,Ⅱ步反应为决速步骤,能量随反应进程的变化如图2 所示,下列说法不正确的是( )。

图2
A.Ⅰ步反应的ΔH:氯代时大于溴代时
B.稳定性:CH3CH2H2<CH3HCH3
C.丙烷中不同基团上碳氢键断裂吸收的能量不同
参考答案:
1.B 提示:符合通式CnH2n+2的是链状烷烃,链状烷烃不含双键和碳环;①⑤不含双键和碳环,属于链状烷烃,②③④含有双键,⑥含有碳环。
2.D 提示:根据题意,硅烷的分子组成与烷烃相似,分子通式为SinH2n+2,A 项正确。与甲烷相似,甲硅烷燃烧生成SiO2和H2O,B项正确。甲硅烷与甲烷分子的组成和结构相似,甲硅烷相对分子质量大,所以沸点高于甲烷,C 项正确。碳元素的非金属性比硅强,所以甲烷比甲硅烷稳定,D 项错误。
3.D 提示:新戊烷沸点为9.5 ℃,标准状况为0 ℃,新戊烷为液体,A 项错误。C5H12包括了正戊烷、异戊烷、新戊烷,而新戊烷的沸点是9.5 ℃,标准状况下是液体,20 ℃时是气体,B 项错误。从表中数据可知,烷烃随碳原子数的增加,沸点逐渐升高,C项错误。C5H12的3 种同分异构体中,随支链数增加,沸点逐渐降低,D 项正确。
4.D 提示:因为丁烷和丙烷都不溶于水而且密度比空气的大,所以都可以用排水法和向上排空气法收集,但是用排水法收集的气体中含有水蒸气,使测得的平均相对分子质量偏小,所以不能选用此方法;在用排空气法收集该混合气体时,应选用向上排空气法且导气管应插到瓶底。
5.B 提示:由沸点数据:甲烷-146 ℃,乙烷-89 ℃,正丁烷-0.5 ℃,戊烷36 ℃,可知烷烃中碳原子个数越多其熔沸点越高,异丁烷中含有4 个碳原子,其碳原子个数大于乙烷而小于戊烷,所以其沸点应该大于乙烷而小于戊烷,并且支链越多熔沸点越低,所以异丁烷熔沸点低于正丁烷,则戊烷的沸点可能是“低于-0.5 ℃”。
6.C 提示:C3H8是链烃,其中的碳原子为饱和碳原子,饱和碳原子和与之相连的四个原子形成四面体结构,3 个碳原子不在一条直线上,A 项正确。丙烷是非极性分子,水是极性分子,难溶于水,丙烷相对分子质量比乙烷大,熔沸点比乙烷高,B 项正确。丙烷能与氧气发生氧化反应,C 项错误。丙烷不存在同分异构体,D 项正确。
7.A 提示:在质量相等的条件下,烷烃分子中含氢量越高,完全燃烧消耗的氧气越多。
8.B 提示:烷烃的性质:烷烃的沸点随着相对分子质量的增大而逐渐升高,常温下烷烃的状态随碳原子数的增加由气态→液态→固态,A 项正确。烷烃均不能被酸性KMnO4溶液氧化,也不能和溴水反应,不会使其褪色,B 项错误。烷烃分子中碳原子之间全部以碳碳单键结合成链状,碳原子剩余的价键全部跟氢原子相结合而达到饱和,无论是碳碳键还是碳氢键都是单键,C 项正确。烷烃跟纯净的卤素单质在光照条件下能发生取代反应,D 项正确。
9.B 提示:甲烷分子中的一个氢原子被溴原子取代生成一溴甲烷,所以一溴甲烷的化学式为CH3Br,A 项正确。甲烷分子中不含不饱和键,因此不能利用加成反应制备一溴甲烷,B项错误。一溴甲烷分子中碳原子和溴原子、氢原子之间都是以共价键相结合,所以只含共价键,C项正确。一溴甲烷只有一种结构,所以不存在同分异构体,D项正确。
10.D 提示:M 和N 都是烷烃,不能与酸性KMnO4溶液反应,A 项正确。M 是新戊烷,有两种同分异构体:CH3(CH2)3CH3、(CH3)2CHCH2CH3,B 项正确。有机化合物分子中每个碳原子都形成4 个共价键,C 项正确。M 的分子式是C5H12,N 的分子式是C8H18,M、N 的最简式不同,等质量的M、N在足量氧气中燃烧,生成CO2的质量不同,D项错误。
11.B 提示:2,2-二甲基丁烷分子中含有3 类氢原子,与氯气光照条件下发生一氯代反应时,得到的一氯取代物最多有3种。
12.C 提示:全氟烷烃中碳原子已达饱和,不能发生加成反应。
13.D 提示:氯代和溴代第一步断裂Cl—Cl 键和Br—Br 键,断键需要吸热,Cl—Cl键的键长短,键能大,Ⅰ步反应的ΔH:氯代>溴代,A 项正确。能量越低,产物越稳定,B 项正确。烷烃中氢原子活性叔氢>仲氢>伯氢,氢原子环境不同,C—H 键的键能有差别,丙烷中含有仲氢和伯氢,断裂C—H 键吸收的能量不同,C项正确。丙烷氯代产物的活化能差值较小,而两种溴代产物的活化能差值较大,得到产物的难度不一样,所得产物比例不相等,D 项错误。

