2024 年高考化学模拟试题 A 卷
■河南省鄢陵县第一高级中学 高小艳 冯存良
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.化学与生产、生活、科技及环境等密切相关。下列说法正确的是( )。
A.“天和”核心舱用到的镁合金涂层中的自愈缓蚀剂2-巯基苯并噻唑(C7H5NS2),属于有机高分子化合物
B.植物可以吸收利用空气中的NOx作为肥料,实现氮的固定
C.葡萄酒中通常添加有微量SO2,既可以杀菌,又可以防止营养成分被氧化
D.我国新一代长征七号运载火箭使用的是液氧煤油发动机,煤油主要由煤的干馏制得
2.聚醋酸乙烯酯难溶于水,可用作白乳胶、塑料薄膜和涂料等,用它可得到聚乙烯醇,聚乙烯醇水溶液可用作医用滴眼液。合成路线如下。
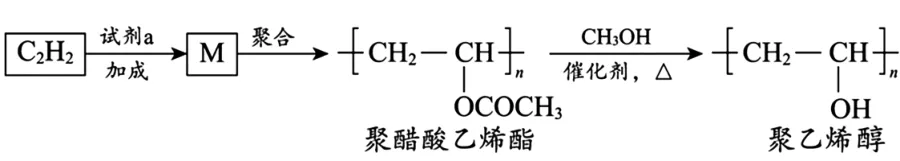
下列说法不正确的是( )。
A.试剂a是乙酸
B.通过增加甲醇用量可提高聚乙烯醇的产率
C.由M 转化为聚醋酸乙烯酯的过程中发生了缩聚反应
D.由聚醋酸乙烯酯转化为聚乙烯醇过程中还会生成乙酸甲酯
3.丁二酮肟常用于检验Ni2+,在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如下所示。下列说法不正确的是( )。
A.元素H、C、N、O、Ni电负性由大到小的顺序为O>N>C>H>Ni
B.1 mol该沉淀含有σ键与π键的个数比为17∶2
C.基态Ni2+的价电子排布式为3d64s2
D.该沉淀中C的杂化方式为sp2、sp3
4.科学家近年发明了一种新型光电催化装置,它能将葡萄糖和CO2转化为甲酸盐,如图1所示。光照时,光催化电极a产生电子(e-)和空穴(h+),图中的双极膜中间层中的H2O 会解离产生H+和OH-。
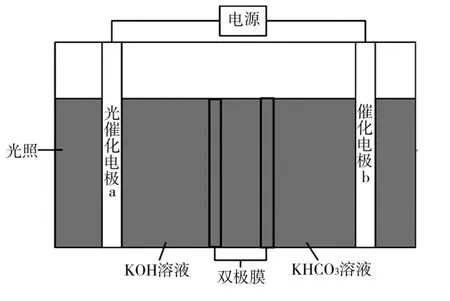
图1
下列说法错误的是( )。
A.光催化电极a 的反应为C6H12O6+12h++18OH-══6HCOO-+12H2O
B.双极膜中间层中的H+在外电场作用下向催化电极b移动
C.理论上电路中转移4 mol e-时可生成2 mol HCOO
D.阳极区和阴极区的pH 均减小
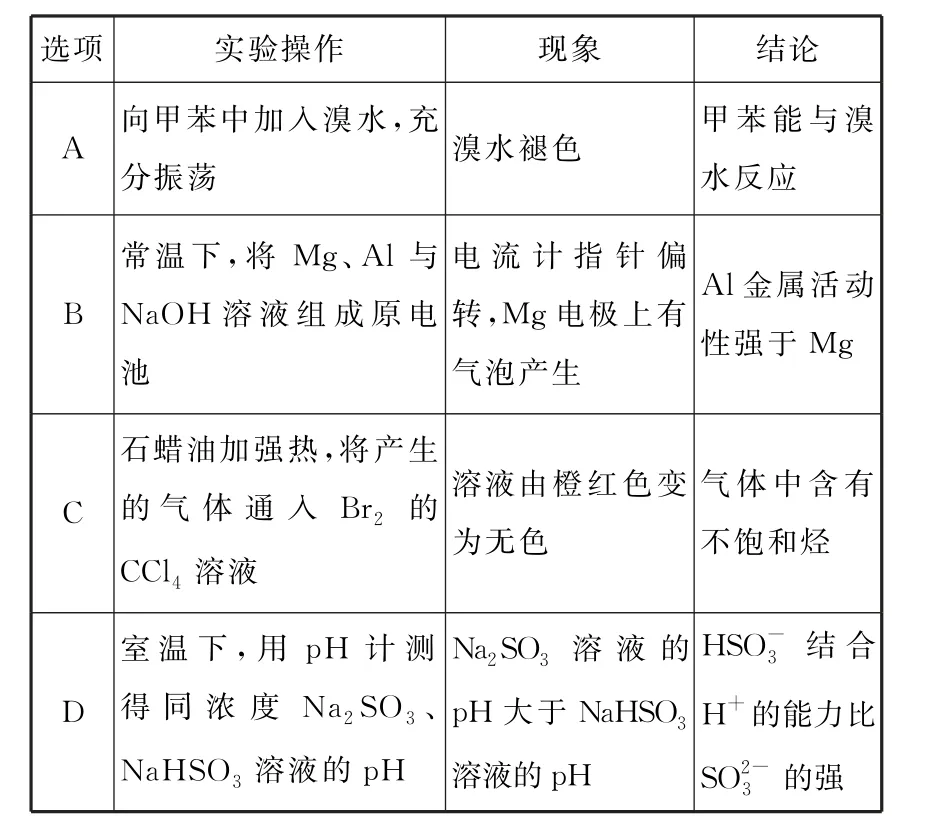
5.下列实验操作和现象均正确,且能推出相应结论的是( )。
6.开发常压旋转滑行弧实现高效固氮具有广阔的应用前景,如图2所示。
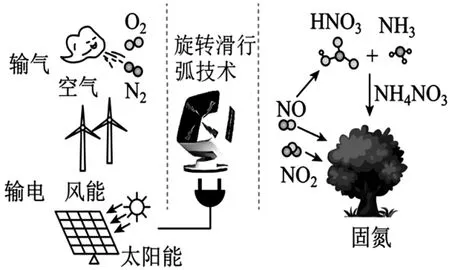
图2
下列叙述正确的是( )。
A.N2和O2在光照或风能作用下直接生成NO2
B.上述过程包括4NO+3O2+2H2O══4HNO3
C.NH4NO3中阴、阳离子空间结构相同
D.HNO3分子可表示为,HNO3和NH3都存在分子内氢键
7.室温下,将 Na2CO3溶液与过量CaSO4固体混合,溶液pH 随时间变化如图3所示。

图3
已知:Ksp(CaSO4)=4.9×10-5,Ksp(CaCO3)=3.4×10-9。
下列说法不正确的是( )。
A.两者混合发生反应:CaSO4(s)+
D.0~600 s内上层清液中存在:c(Na+)+2c(Ca2+)<c()+2c()+2c()
二、非选择题:本题共4小题,共58分。
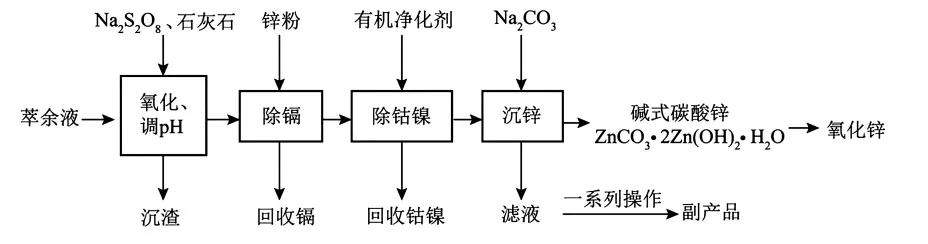
8.(14 分)某湿法炼锌的萃余液中含有Na+、Zn2+、Fe2+、Mn2+及二价钴离子(Co2+)、镍离子(Ni2+)、镉离子(Cd2+)和H2SO4等,逐级回收有价值金属并制取活性氧化锌的工艺流程如下。
已知(见表1):
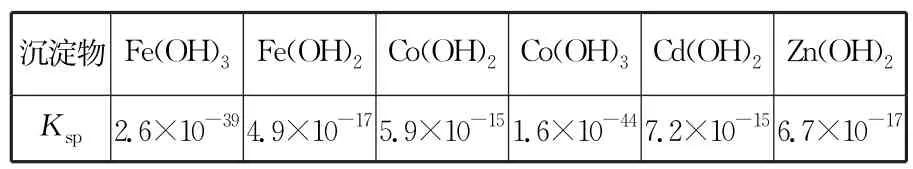
表1
(1)“氧化、调pH”时,先加入适量的石灰石调节pH 为1.0;加入一定量的Na2S2O8;再加入石灰石调节溶液的pH 为4.0。
①“沉渣”的主要成分除MnO2外,还有______。
②若加入过量的Na2S2O8,钴元素会被氧化进入“沉渣”中,则溶液中残留Co3+的浓度为______mol·L-1。
(2)“沉锌”时,在近中性条件下加入Na2CO3,可得碱式碳酸锌 [ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体,试分析产生大量气体的原因:______。
(3)由碱式碳酸锌生成氧化锌的化学方程式为______。
(4)沉锌后的滤液经过一系列操作后得到的副产品为______(填化学式)。
(5)ZnO 的晶胞结构如图4,则锌的配位数为______;已知晶胞参数为acm,该晶体的密度为______g·cm-3(写出计算式,阿伏加德罗常数的值为NA)。

图4
9.(15分)科学探究要实事求是、严谨细致。某化学兴趣小组设计实验进行有关氯化物的探究,回答下列问题:
Ⅰ.制备FeCl2。装置如图5 所示(夹持装置省略),已知FeCl3极易水解。
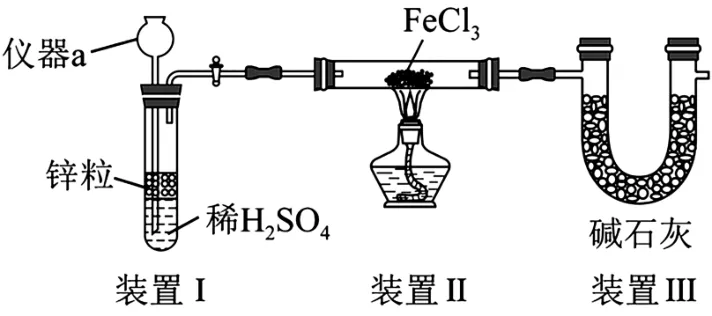
图5
(1)仪器a的名称是______。
(2)装置Ⅱ中制备FeCl2的化学方程式为______。
(3)该装置存在的缺陷是:①______;②缺少氢气的尾气处理装置。
Ⅱ.利用惰性电极电解0.1 mol·L-1FeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
(4)实验数据如表2所示。
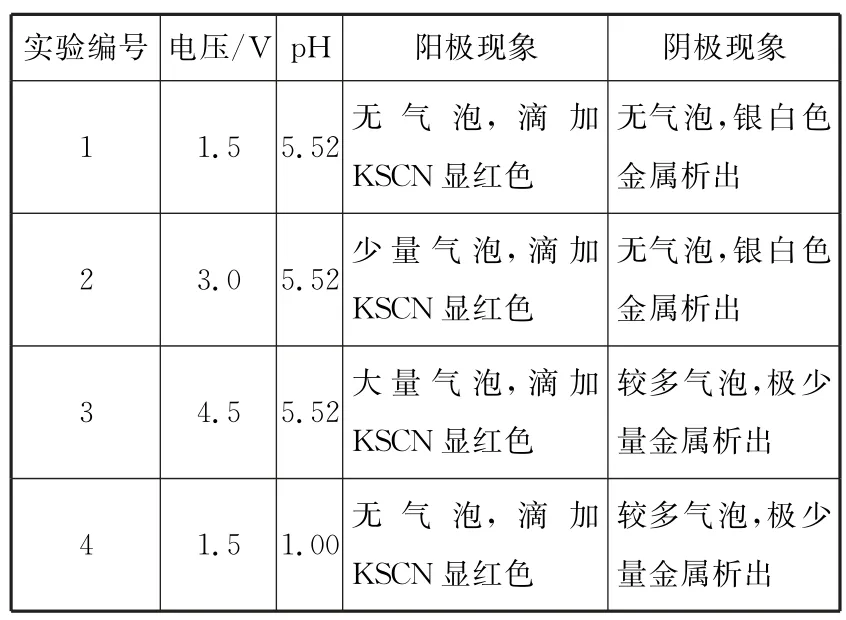
表2
①由实验1、2现象可以得出结论:在溶液pH 相同时,增大电压______,优先于______放电。
②由实验1、4现象可以得出结论:______。
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,某兴趣小组设计了如表3 所示实验方案。
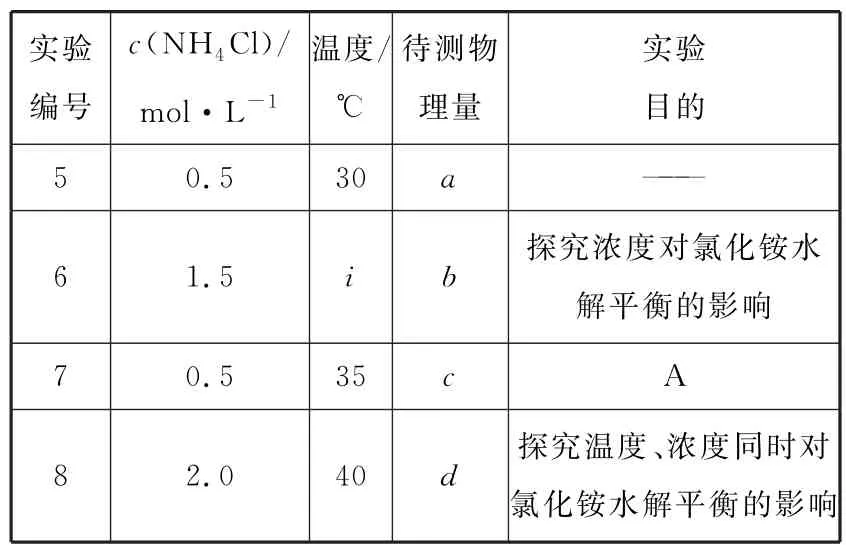
表3
(5)该实验限选药品和仪器:恒温水浴、pH 传感器、烧杯、0.1 mol.L-1硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量”是______。
②实验目的A 是______。
③上述表格中,b______d(填“>”“<”或“=”)。
10.(14分)将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
(1)已知:①2H2(g)+ O2(g)══2H2O(g) ΔH=- 484 kJ·mol-1
②2CH3OH(g)+3O2(g)══2CO2(g)+4H2O(g) ΔH=-1 353 kJ·mol-1
则CO2(g)+3H2(g)══CH3OH(g)+H2O(g) ΔH=______kJ·mol-1。
(2)在恒压密闭容器中通入CO2和H2的混合气体,制备甲醇过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如表4所示。
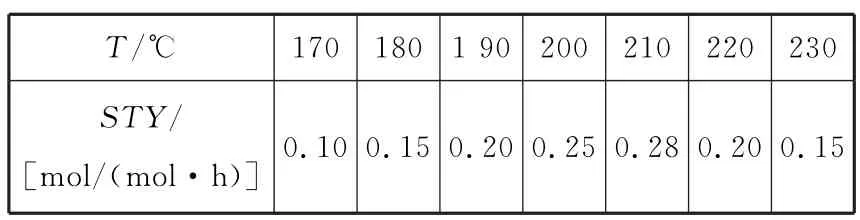
表4
①该反应最适宜的温度是______kJ。
②在220 ℃和170 ℃条件下,该反应速率之比:v(220 ℃)∶v(170 ℃)=______kJ。
③随温度升高,甲醇的时空收率先增大后减小,可能的原因是______kJ。
(3)CO2催化加氢制甲醇过程中,存在竞争的副反应主要是CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41 kJ·mol-1。在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[x(CH3OH)%=随着温度变化关系如图6所示。
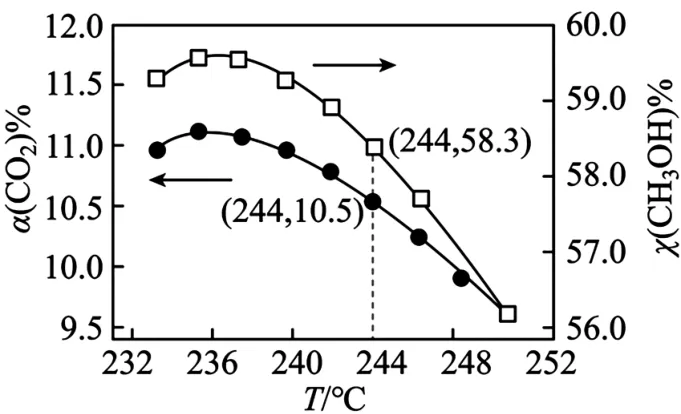
图6
①分析温度高于236 ℃时图中曲线下降的原因:______kJ。
②按1 mol CO2(g)、3 mol H2(g)投料反应,计算 244 ℃时反应生成CH3OH 的物质的量为______kJmol。 (保留两位有效数字)
③在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数Kp=______kJmol。( 列出计算式即可)
11.(15分)化合物I合成相关流程如下所示。
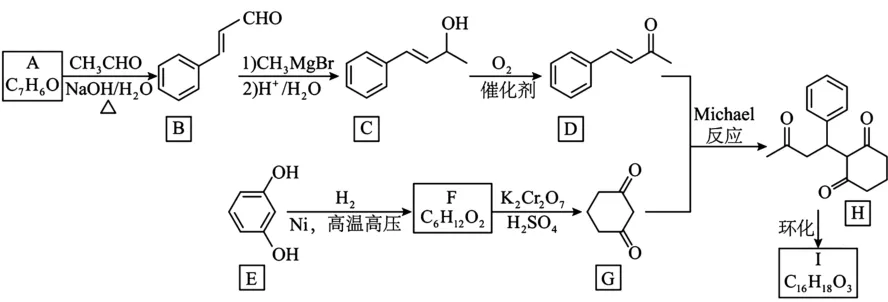
已知:①A 为芳香化合物。
回答下列问题:
(1)A 所含官能团的名称是______。
(2)C→D 反应方程式为______。
(3)E 的名称为______,由F生成G 的反应类型是______。
(4)已知I的分子中:①含有三个六元环;②不含甲基;③含有两个羰基。I的结构简式为______。
(5)同时满足以下条件的C 的同分异构体有______种。
①含有苯环,且苯环上有三个取代基;
②能发生银镜反应。
其中核磁共振氢谱有5 组峰,且峰面积之比为6∶2∶2∶1∶1的同分异构体的结构简式为。______(写一种)

