2024年高考化学模拟试题B卷
■安徽省望江县第二中学 江已舒
可能用到的相对原子质量:H1 C12 Li7 N14 O16 S32 Cl35.5 Fe56 Cu64 As75 Se79
一、选择题:本题包括7 小题,每小题6分。在每小题给出的四个选项中,只有一项符合题目要求。
1.青釉瓷是中国最早出现的一种瓷器,分析青釉瓷器文物发现:主体是石英,还有一定量的莫莱石(3Al2O3·2SiO2)及少量的Fe2O3、CaO 和 MgO。下列说法正确的是( )。
A.石英晶体存在硅氧四面体顶角相连的螺旋长链结构
B.陶瓷是由氧化物组成的传统无机非金属材料
C.CaO 遇水会生成Ca(OH)2,所以青釉器不可盛水
D.青釉瓷器呈青色是因为瓷体中含有Fe2O3
2.某神经类药物的结构如下所示。下列说法正确的是( )。
A.分子中存在2种含氧官能团
B.分子中最多有14个原子共平面
C.1 mol该物质与足量H2反应,最多消耗7 mol H2
D.1 mol该物质与足量NaOH 溶液反应,最多消耗3 mol NaOH
3.用下列实验装置(如图1)进行相应的实验,能达到实验目的的是( )。
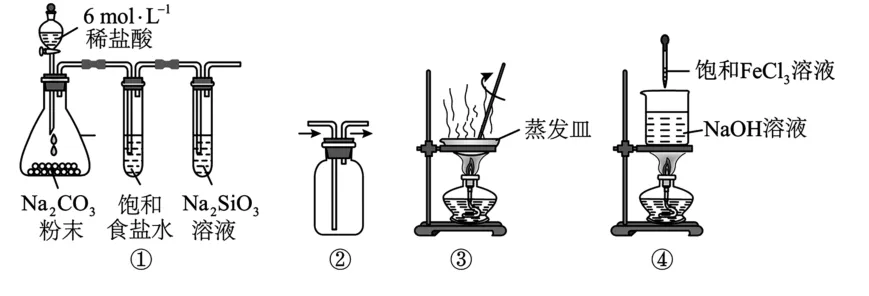
图1
A.用图1①装置验证非金属性:Cl>C>Si
B.按图1②所示的气流方向可用于收集Cl2
C.用图1③装置高温灼烧Ag2S制取Ag
D.用图1④装置制备氢氧化铁胶体
4.有机物M 是来源于植物的化合物,具有很强的生理活性,可用于治疗感冒和咳喘,结构式如下所示,其中短周期主族元素X、Y、Z、R的原子序数依次增大,Z和R 的常见单质均为无色无味的气体。下列说法正确的是( )。
A.第一电离能:R>Z>Y
B.由X、Y、Z、R 四种元素组成的化合物可能为离子化合物
C.有机物M 中,各原子均满足8电子稳定结构
D.元素Y、Z、R 的p电子总数均小于s电子总数
5.采用惰性电极,设计双阴极微生物燃料电池进行同步硝化和反硝化脱氮的装置如图2所示。下列说法不正确的是( )。
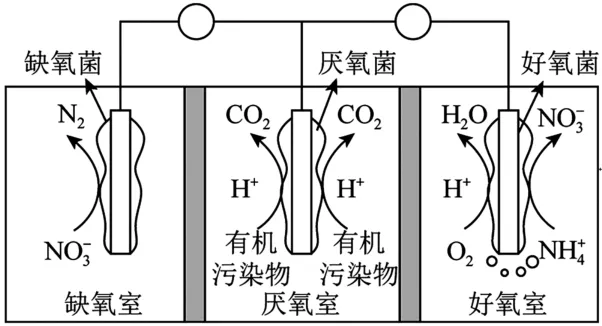
图2
A.缺氧室和好氧室电极均为燃料电池正极
C.若好氧室消耗标准状况下44.8 L O2,则至少有1 mol完全转化为
D.理论上,厌氧室消耗1 mol C6H12O6,外电路转移24 mol e-
6.某研究团队提出了以氧化石墨烯(GO)为催化剂设计的简易膜反应,其反应为,反应过程中能量变化如图3 所示,下列说法中正确的是( )。
A.反应中(除GO 外)既有极性键和非极性键的断裂,又有极性键和非极性键的形成
C.催化剂可降低反应的活化能,从而改变反应的焓变
D.氧化石墨烯的作用之一可能是吸附反应物形成更稳定的反应中间体
7.常温时,分别向一元酸HX 溶液和CuSO4溶液中滴加NaOH 溶液,-lgC与pH 的关系如图4 所示[C表示或c(Cu2+)]。已知常温时,Ksp[Cu(OH)2]=1.0×10-19.7。下列说法正确的是( )。
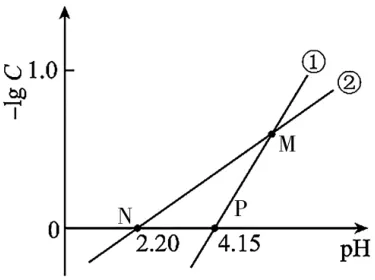
图4
B.一元酸 HX 的电离平衡常数Ka(HX)=10-3.2
C.对于曲线②的溶液,N 点水的电离程度大于M 点
D.M 点时,对于CuSO4溶液:2c(Cu2+)+c(Na+)+c(H+)=2c()+c(OH-)
二、非选择题:本题共4小题,共58分。
8.(14分)MnSO4·H2O 是一种易溶于水的微红色斜方晶体,实验室用SO2还原MnO2制备MnSO4。甲同学设计如图5 所示装置制备硫酸锰。请回答下列有关问题:
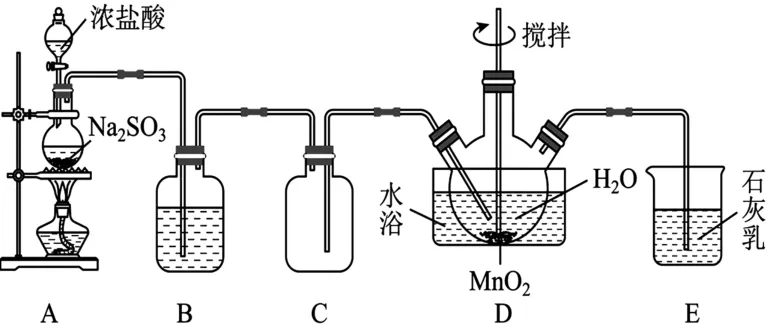
图5
(1)仪器组装好后首先进行的操作是______。
(2)装置B中的试剂为______,装置E 的作用为______。
(3)装置D 中发生反应的化学方程式为______。要从D中获得纯净的MnSO4·H2O,应在观察到______现象时停止通入SO2。
(4)装置D 中水浴温度应控制在80 ℃左右,温度不能过高的原因是______。
(5)乙同学认为甲同学的设计过于复杂,设计了仅用如图6所示装置制备硫酸锰:

图6
简述乙同学装置的优点(填写两点):______。
9.(15分)从废TiO2/WO3纳米薄膜中回收钛和钨等稀缺金属,既有利于资源综合利用,又避免污染环境。回收的工艺流程如下。
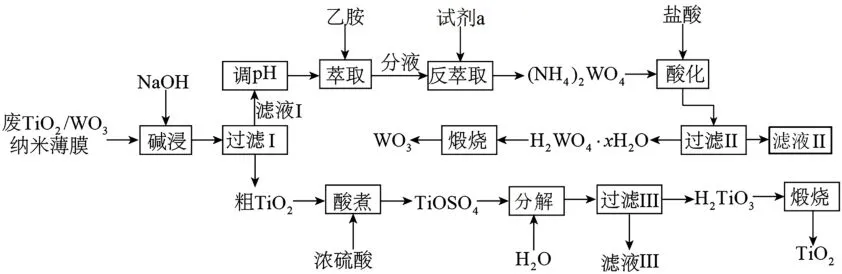
已知:
Ⅰ.乙胺(CH3CH2NH2)是无色极易挥发的液体,呈碱性,能与酸发生反应:CH3CH2NH2+H+══CH3CH2。
Ⅲ.TiOSO4易溶于水,属于强电解质。偏钛酸难溶于水,其化学式可表示为TiO(OH)2或H2TiO3,室温时Ksp[TiO(OH)2]=1.0×10-27。
回答下列问题:
(1)“碱浸”时发生反应的化学方程式为_____。“萃取”前,需要将“滤液Ⅰ”的pH调整到3.5左右,目的是。
(2)试剂a为_____(写名称)。“反萃取”过程中发生反应的化学方程式为。
(3)实验室煅烧偏钛酸,应将偏钛酸放在_____(填仪器名称)中。
(4)检验“过滤Ⅱ”所得H2WO4·xH2O是否洗涤干净的方法是_____。
(5)室温下测得“滤液Ⅲ”的pH=2,则此时“滤液Ⅲ”中c(TiO2+)=_____mol·L-1。
(6)如图7所示。TiO2晶胞中Ti4+位于O2-所构成的正八体的面体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心。
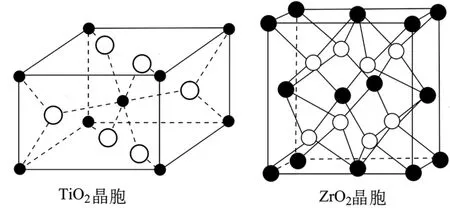
图7
①TiO2晶胞中O2-的配位数是_____。
②已知ZrO2晶胞的密度为ρg·cm-3,则晶体中Zr4+和O2-之间的最短距离为_____pm(列出算式。已知NA为阿伏加德罗常数的值,ZrO2的摩尔质量为Mg·mol-1)。
10.(14分)利用Ag作催化剂可实现乙烯高选择性制备环氧乙烷(),涉及反应如下。
主反应:2CH2═CH2(g)+O2(g)ΔH1
副反应:2CH2═CH2(g)+3O2(g2CO2(g) + 2H2O (g) ΔH2=-1 334.6 kJ·mol-1
(1)已知H2O(l)H2O(g) ΔH=+44kJ·mol-1,(g)的燃烧焓为-1 316.4 kJ·mol-1,则ΔH1=_____kJ·mol-1。
(2)一定条件下,向1 L 密闭容器中通入2 mol CH2═ CH2(g)和2 mol O2(g),平衡时的选择性为0.6,乙烯的平衡转化率为0.6,则该温度下主反应的平衡常数K=_____,能够提高 O 平衡产率的措施有_____(写一项即可)。
(3)以上过程反应机理如下:
反应Ⅰ:Ag(s)+O2(g)══Ag+O2-(s) 慢
反应Ⅱ:CH2═ CH2(g)+Ag+O2-(s)══(g)+Ag+O-(s) 快
反应Ⅲ:CH2═ CH2(g)+6Ag+O-(s)══2CO2(g)+2H2O(g)+6Ag(s) 快
一定能够提高主反应速率的措施有(填序号)。
A.升高温度
B.通入惰性气体
C.增大CH2═CH2浓度
D.增大O2浓度
(4)加入1,2-二氯乙烷会发生反应2Cl(g)+2Ag+O-(s)══2AgCl(s)+O2(g)。一定条件下,反应经过一定时间后,产率及选择性与1,2-二氯乙烷浓度关系如图8所示。
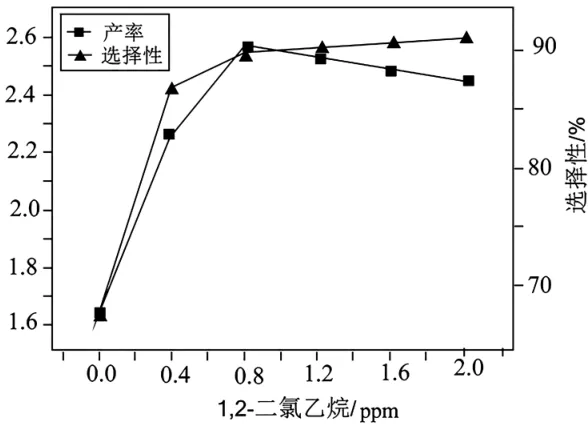
图8
(5)反应结束后,控制氨水浓度对失活催化剂(主要成分是AgCl)进行回收。25 ℃时,Ksp(AgCl)=10-9.74,Ag+(aq)+2NH3(aq)══K总=1010.46。
① AgCl (s) + 2NH3(aq) ══(aq)+Cl-(aq)K=(填数值)。
②1 L氨水中至少含有mol NH3才能回收1 mol AgCl。
11.(15分)有机物G 是一种治疗尿失禁的新药,具有解痉和抗胆碱作用,其合成路线如下。
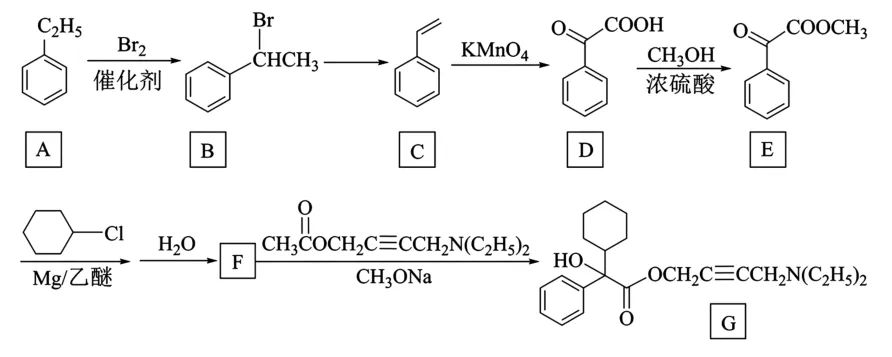
(1)A 的名称为______。
(2)B→C反应中所需的试剂是______。
(3)C→D 的反应类型为______。
(4)D→E 的反应方程式为______。
(5)F的结构简式为______。
(6)G 中含氧官能团的名称为______。
(7)E 有多种同分异构体,同时满足下列条件的同分异构体共有______种, 其中含有手性碳原子的物质的结构简式为______。
①分子中含有苯环;
②能与NaHCO3溶液反应产生气体;
③能发生银镜反应。
——由一道求配位数高考题引发的思考

