转录因子SOX3对卵巢颗粒细胞增殖和雌二醇分泌的影响
蔡 睿,张 浩,刘 壮,陈远华,谢芬芬,洪 强
卵泡作为脊椎动物卵巢的结构和功能单位,主要由卵母细胞、颗粒细胞和卵泡膜细胞组成[1]。卵母细胞可通过分泌一些旁分泌因子来调节颗粒细胞的发育,而颗粒细胞分泌类固醇激素并产生促进卵母细胞发育的生长激素,为卵母细胞的生长发育提供能量和物质需求[2]。因此,颗粒细胞的功能正常对卵泡正常发育和卵子发生至关重要。研究[3]表明颗粒细胞的增殖和凋亡失衡以及雌激素合成紊乱是导致卵泡闭锁和卵巢早衰的主要原因。
性别决定区Y框蛋白3(sex determining region Y-box3,SOX3)作为性别决定区Y框蛋白B1(sex determining region Y-box B1,SOXB1)亚家族一员,参与调控骨肉瘤、卵巢癌细胞的增殖活化,促进肿瘤发生[4-6]。前期研究[7]发现,斑马鱼中SOX3的缺失下调性腺型芳香化酶(Cyp19a1a)基因,导致卵巢中雌二醇合成能力下降,卵泡发育阻滞,生殖能力下降。该研究通过构建SOX3过表达慢病毒载体,感染并筛选获得SOX3稳定过表达的人卵巢颗粒细胞(human ovarian granulosa cells,KGN)细胞系,探讨SOX3对KGN的增殖活化和雌激素分泌的影响。
1 材料与方法
1.1 材料
1.1.1细胞、质粒 人胚肾细胞系(HEK 293T)为本实验室保藏;人卵巢颗粒细胞(KGN)细胞购于武汉普诺赛生命科技有限公司;慢病毒荧光标签载体(pLV-EF1a-GFP-2A-Puro)以及包装质粒(pGag/Pol、pRev、pVSV-G)购于上海吉玛制药技术有限公司。
1.1.2主要试剂 转染试剂RNAi-Mate(上海吉玛制药技术有限公司,货号:G04001);嘌呤霉素(上海碧云天生物技术有限公司,货号:ST551);NotI、BamHI限制性内切酶(上海玉博生物科技有限公司,货号:Fermentas FD0594、Fermentas FD0054);DNA聚合酶(上海生工生物股份有限公司,货号:B600001-0001);ClonExpress®Entry One Step Cloning Kit(南京诺唯赞生物科技股份有限公司,货号:C112-01);质粒提取试剂盒、DNA凝胶回收试剂盒(北京天根生化科技有限公司,货号:DP103-02、DP204-02);RNA提取试剂盒(山东思科捷生物技术有限公司,货号:AC0205-A);反转录试剂盒(湖南艾科瑞生物科技有限公司,货号:AG11711);TB Green®Fast qPCR Mix(大连宝生物工程有限公司,货号:RR430S);BCA蛋白浓度测定试剂盒、RIPA裂解、SDS-PAGE蛋白上样缓冲液、辣根过氧化物酶标记山羊抗兔IgG(H+L)(上海碧云天生物技术有限公司,货号:P0012、P0013B、P0015、A0208);DMEM/F12培养基、胰酶、胎牛血清(美国Gibco公司,货号:12634028、15090046、12484028);SOX3抗体(成都正能生物技术有限责任公司,货号:862515);GAPDH抗体(武汉爱博泰克生物科技有限公司,货号:AC001);山羊抗兔IgG二抗(武汉三鹰生物技术有限公司,货号:SA000001-2);ECL化学发光剂( 美国 Thermofisher,货号:34580);CCK-8试剂盒(北京兰杰柯科技有限公司,货号:BS350A);ELISA雌二醇检测试剂盒(武汉酶免生物科技有限公司,货号:MM-12505H1);PCR引物合成和目的基因测序(北京擎科生物科技股份有限公司),大肠埃希菌DH5a(德国merck公司,货号:CMC0007)。
1.1.3主要仪器 PCR仪(杭州朗基科学仪器有限公司,型号:4484075);荧光显微镜(日本尼康公司,型号:EVOS M7000);实时荧光定量PCR仪(美国SYGENE公司,型号:CFX Connect);化学发光检测仪(上海天能公司,型号:Tanon 2500);酶标仪(美国BioTek Epoch公司,型号:AMG-2201-020)。
1.2 方法
1.2.1PCR扩增获得SOX3基因 在NCBI数据库Gene-Bank中搜索人SOX3(NM_005634.3)基因的序列,根据数据库中搜索到的人SOX3基因序列来设计并合成PCR引物(表1),依据克隆需要,在正向引物和反向引物中分别加上慢病毒载体pLV-EF1a-GFP-2A-Puro的Not I和Bam HI限制酶两侧同源序列(表1下划线部分)。以KGN细胞的cDNA为模板,按照试剂操作说明进行PCR扩增,反应体系为50 μl,反应条件:95 ℃预变性3 min;94 ℃,30 s;55 ℃,30 s;72 ℃,1 min;30个循环;72 ℃延伸5 min。PCR反应完成后,经1%琼脂糖凝胶电泳检测后回收SOX3基因。

表1 SOX3基因PCR扩增引物序列
1.2.2SOX3过表达慢病毒载体的构建 取pLV-EF1a-GFP-2A-Puro慢病毒载体2 μg,用Not I和Bam HI限制酶对其进行双酶切,37 ℃酶切2 h,0.8%琼脂糖凝胶电泳,当酶切产物电泳到适当的位置,用刀片将目的条带区域切下,DNA凝胶回收试剂盒回收线性化载体。按照ClonExpress®Entry One Step Cloning Kit的操作说明,将回收的SOX3片段同源重组克隆到线性化的载体中,将重组产物转化到大肠埃希菌DH5a涂抹在氨苄青霉素抗性的平板上,37 ℃恒温箱培养过夜,从平板上挑取单个菌落置于10 ml的溶菌肉汤液体培养基中,37 ℃、220 r/min摇床培养过夜,随后进行质粒提取,用Not I和Bam HI进行双酶切鉴定,将双酶切正确的质粒进行测序。挑选测序完全正确的质粒用于后续实验。
1.2.3慢病毒转染和滴度测定 慢病毒转染:选取长势良好的HEK 293T细胞接种到10 cm的培养皿中,在37 ℃、5% CO2培养箱中培养至细胞密度达到70%~80%时进行转染。设置pLV-NC组(转染pLV-EF1a-GFP-2A-Puro、pGag/Pol、pRev、pVSV-G)和pLV-SOX3组(转染pLV-EF1a-GFP-2A-Puro-SOX3、pGag/Pol、pRev、pVSV-G),按照RNAi-Mate转染试剂的说明,转染到HEK 293T细胞,转染6 h后更换为新的完全培养基,继续培养48 h后收集含有慢病毒颗粒的细胞上清液,1 200 r/min离心30 min过滤收集慢病毒浓缩液,分装后冻于-80 ℃冰箱备用。滴度测定:将收集到的慢病毒原液,按101、102、103、104进行梯度稀释后接种到KGN细胞中,在37 ℃、5% CO2培养箱中培养72 h,通过荧光显微镜计数绿色荧光细胞的数量,结合稀释倍数计算病毒的滴度。
1.2.4筛选和建立稳定过表达SOX3的KGN细胞系 KGN细胞按照1.0×105细胞/孔接种于24孔板,待细胞密度达到70%~80%时,根据感染复数分别加入pLV-NC组和pLV-SOX3组的慢病毒和嘌呤霉素(5 μg/ml),培养12 h后更换为新的完全培养
基,继续培养48~72 h后在荧光显微镜下观察绿色荧光的表达情况。由于慢病毒载体带有嘌呤霉素抗性基因,故将培养基更换为含有嘌呤霉素(1 μg/ml)的培养基进行筛选,筛选2周后,带有绿色荧光的细胞即为稳定转染的细胞,将含有嘌呤霉素的培养基更换为新的不含嘌呤霉素的培养基,扩大培养直至获得稳定转染的细胞系。
1.2.5RT-qPCR检测细胞中SOX3mRNA的表达 收集pLV-NC组和pLV-SOX3组的细胞置于冰上,用RNA提取试剂盒提取细胞的总RNA,反转录为cDNA,以该cDNA为模板,进行RT-qPCR扩增,检测各组细胞中SOX3mRNA的表达情况,以β-actin为内参基因,采用2-ΔΔCT计算SOX3mRNA表达水平,引物序列见表2。

表2 RT-qPCR引物序列表
1.2.6Western blot法检测细胞中SOX3蛋白表达水平 收集pLV-NC组和pLV-SOX3组的细胞,PBS缓冲液洗涤2次,冰上用RIPA裂解液裂解60 min,期间每隔10 min颠倒混匀1次,离心收集上清液,加入5×Loading buffer后于100 ℃水浴10 min。随后进行12% SDS-PAGE电泳,半干法转移至PVDF膜上。采用封闭液(5%脱脂奶粉)室温封闭2 h后,分别加入SOX3一抗(1∶5 000)和GAPDH一抗(1∶7 000),4 ℃孵育过夜,TBST洗涤3次,加入辣根过氧化物酶标记的二抗(1∶10 000),室温摇床孵育2 h,TBST洗涤3次,将ECL化学发光试剂盒中的显影液覆盖至PVDF膜上,凝胶成像系统显影成像。用ImageJ软件对图像进行灰度扫描,进行统计学分析。
1.2.7CCK-8法检测细胞增殖能力 胰酶消化并收集pLV-NC组和pLV-SOX3组的细胞,进行计数。按照每孔体积100 μl,细胞密度为3 000细胞/孔接种到96孔板中,后置于细胞培养箱中培养,每组细胞设置6个复孔。在细胞接种后的24、48、72、96 h,向每孔滴加10 μl的CCK-8试剂,继续置于细胞培养箱中孵育1 h,随后用酶标仪测定在450 nm处的吸光度值,记录并统计分析。
1.2.8ELISA测定雌二醇浓度 胰酶消化并收集pLV-NC组和pLV-SOX3组的细胞,进行计数。按照每孔1 ml体积,细胞密度为1×105细胞/孔接种到12孔板中,后置于细胞培养箱中培养,每组细胞设置6个复孔。细胞贴壁后,将培养基更换为含有雄烯二酮(10 μg/ml)的培养基,继续置于细胞培养箱中培养24 h,随后收集上清液按照说明书进行雌二醇浓度的测定,同时将对应的两组细胞提取蛋白,按照BCA蛋白浓度测定试剂盒说明书进行测定,用测定的细胞蛋白浓度将雌二醇浓度均一化,记录并统计分析。
1.3 统计学处理所有的实验数据采用平均数±标准差表示。多组间的比较采用方差分析,两组间的比较采用t检验。采用线性回归分析绘制标准曲线。所有的图表均用GraphPad Prism 8.0软件绘制,P<0.05为差异有统计学意义。
2 结果
2.1SOX3的扩增及重组慢病毒表达载体的构建和鉴定SOX3基因的编码序列全长为1 341 bp,PCR产物经1%琼脂糖凝胶电泳,结果显示有明显的目的条带,且大小与预期结果一致(图1A),表明SOX3基因扩增成功。将SOX3基因克隆至pLV-EF1a-GFP-2A-Puro载体上,获得了慢病毒表达载体pLV-EF1a-GFP-2A-Puro-SOX3(图1B)。随后用NotI和BamHI双酶切鉴定pLV-EF1a-GFP-2A-Puro-SOX3慢病毒载体,结果显示,酶切条带与预期一致(图1C),基因测序结果显示上述慢病毒载体中SOX3的序列与NCBI数据库中SOX3序列一致(图1D)。以上结果表明SOX3过表达慢病毒载体pLV-EF1a-GFP-2A-Puro-SOX3构建成功。

图1 pLV-EF1a-GFP-2A-Puro-SOX3慢病毒载体的构建和鉴定
2.2 慢病毒转染和稳转细胞系建立的情况将已成功构建的慢病毒表达质粒和包装质粒(pGag/Pol、pRev、pVSV-G)(图2A)共同转染到HEK 293T细胞,荧光显微镜下观察转染的HEK 293T细胞,结果显示HEK 293T细胞GFP高表达,即慢病毒成功包装(图2B)。病毒滴度测定结果表明pLV-SOX3实验组病毒滴度为1×108TU/ml,pLV-NC对照组病毒滴度为7×108TU/ml。随后用慢病毒感染KGN细胞,获得稳定表达的细胞系(图2C)。
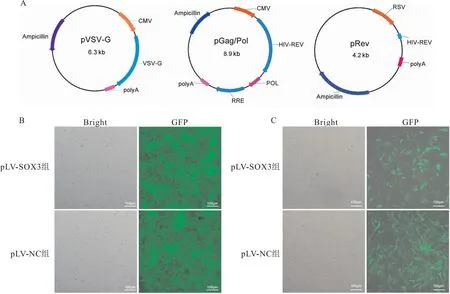
图2 慢病毒转染和SOX3稳定过表达KGN细胞系的建立
2.3 RT-qPCR和Western blot检测的SOX3 mRNA和蛋白表达水平RT-qPCR检测结果表明pLV-SOX3组的SOX3 mRNA水平较pLV-NC组上调(t=3.10,P<0.05)(图3A)。Western blot检测结果显示,与pLV-NC组(0.40±0.01)相比,pLV-
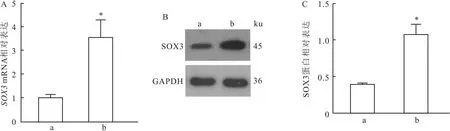
图3 SOX3 mRNA和蛋白表达水平的比较
SOX3组SOX3蛋白水平增加(t=7.88,P<0.05)(图3B、C)。以上结果表明KGN细胞经pLV-EF1a-GFP-2A-Puro-SOX3慢病毒感染后,SOX3的mRNA和蛋白水平升高。
2.4 过表达SOX3对KGN细胞增殖能力的影响CCK-8法检测结果显示,与pLV-NC组相比,pLV-SOX3组在72 h和96 h时细胞的增殖能力明显上升(t=8.82、23.76,均P<0.01)。见图4。

图4 CCK-8检测SOX3过表达后不同时间KGN细胞的增殖能力
2.5 过表达SOX3基因对KGN细胞雌二醇分泌的影响ELISA检测结果显示,与pLV-NC组相比,pLV-SOX3组细胞培养液中雌二醇浓度升高(t=3.33,P<0.05)(图5),表明过表达SOX3促进了KGN细胞雌二醇的分泌。
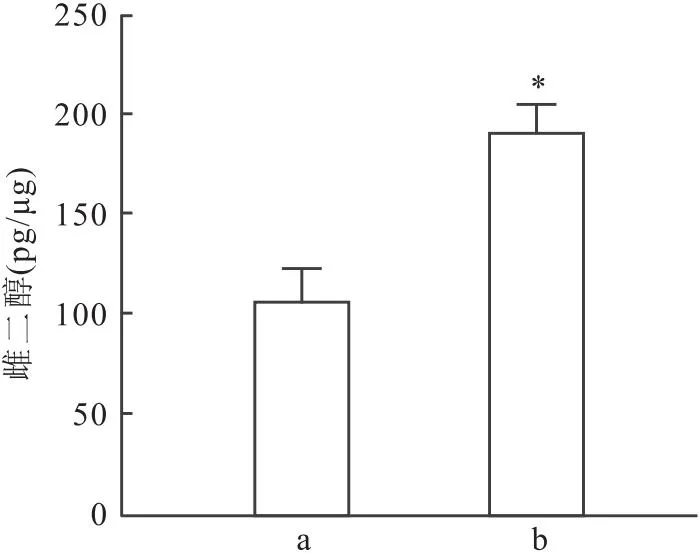
图5 ELISA检测的各组KGN细胞雌二醇浓度的比较
3 讨论
卵巢早衰( premature ovarian failure,POF) 作为一种内分泌代谢紊乱性疾病,主要表现为卵巢功能衰竭,以雌激素缺乏和卵泡闭锁为主要特征。POF不但可以导致不孕症,同时还可能增加患骨质疏松症、冠状动脉粥样硬化性心脏病和神经退行性疾病等慢性疾病发生的风险[8],给妇女造成心理创伤。研究[9]表明卵泡发育与颗粒细胞的增殖和类固醇激素生成密切相关,颗粒细胞能够分泌雌二醇、黄体酮和胰岛素样生长因子,促进卵母细胞生长,为卵母细胞的发育提供能量和营养物质,从而维持雌性动物的生殖功能;颗粒细胞功能紊乱会导致卵泡发育异常和卵泡闭锁,进而促进卵巢早衰的发生。
SOX3基因家族的HMG盒是由79个氨基酸组成的DNA结合结构域,目前已经鉴定出30多个成员,主要参与维持个体内环境稳定、器官发生等过程[10]。研究[11-13]表明SOX3基因调控区发生基因组重排或染色体插入易位将导致人类XX男性性逆转。SOX3在小鼠的性腺体细胞中表达,SOX3缺失会导致雌性小鼠卵泡发生闭锁、畸形的卵母细胞增多以及生殖力下降[14]。在罗非鱼中SOX3的缺失会导致卵子发生和卵母细胞生长过程被抑制[15]。因此,SOX3对卵泡发育有着重要作用。本研究构建SOX3过表达慢病毒载体,通过转染筛选后建立稳定过表达SOX3的人KGN细胞系,并从mRNA和蛋白水平证明其可稳定过表达SOX3。CCK-8检测结果表明过表达SOX3促进了人KGN的增殖能力,ELISA检测结果显示过表达SOX3促进了卵巢颗粒细胞雌二醇的分泌能力。以上的结果均表明SOX3对卵巢颗粒细胞的增殖活化和雌二醇分泌有着重要的促进作用。
综上所述,SOX3作为一个重要的转录调控因子,参与维持卵巢颗粒细胞的功能,在卵泡发育和卵巢早衰过程中具有关键的调节作用。靶向过表达SOX3可能是治疗卵巢早衰的有效途径。本研究为POF的临床治疗提供了新的方向,为后续继续对于SOX3在卵泡闭锁和卵巢早衰中作用机制的研究奠定了基础,但其中具体的调控机制仍需进一步研究。

