双氢青蒿素对非小细胞肺癌细胞诱导的CD8+T细胞抗肿瘤免疫应答的影响
王南楠,刘 宇,凌惠娟,牛 可,朱亚玉,陈礼文
肺癌是一种发病率和病死率均高的疾病。据统计[1],每年全球大约有200万例新增肺癌病例和180万肺癌死亡病例,其中约一半发生在亚洲。在2020年,中国约有85万例新确诊肺癌病例和71.5万例肺癌死亡病例[2]。肺癌中80%~85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)。中晚期NSCLC患者主要使用放化疗、免疫治疗和靶向药物治疗等手段,这些全身治疗方法虽然能给患者带来较好的治疗效果,但也存在明显的毒副作用。目前,从中草药中开发毒性低、疗效高的抗癌药物是包括NSCLC在内的肿瘤治疗药物研究的热点。
青蒿素是一种从已知的中草药黄花蒿中提取出的化合物,双氢青蒿素(dihydroartemisinin,DHA)是该化合物的第一代衍生物[3],1973年屠呦呦 等[4]用硼氢化钠还原青蒿素并合成了DHA,它具有强大的抗疟活性以及低毒性和安全性。近年来,青蒿素及DHA等药物被发现在包括肺癌在内的多种癌症中发挥抗癌作用,但其具体的抗癌机制仍需进一步探究。该研究旨在探讨DHA对NSCLC细胞生长及其诱导的CD8+T细胞免疫应答的调控作用。
1 材料与方法
1.1 材料
1.1.1主要材料 NSCLC细胞系A549细胞(上海富恒生物技术有限公司);外周血来源于同一健康志愿者;RPMI-1640培养基(上海源培生物科技股份有限公司,货号:L210KJ);胎牛血清(美国Gibco公司,货号:10091148);CCK-8试剂盒、0.25%胰酶消化液、1%青-链霉素、二甲基亚砜DMSO(上海碧云天生物技术有限公司,货号:C0037、C0201、ST488S、ST038);DHA(美国Selleck公司,货号:S2290);人外周血淋巴细胞分离液(Ficoll)、0.1%结晶紫染液(北京索莱宝科技有限公司;货号:P8900、G1062);CD3单抗(德国Nobimpex公司,货号:B104-0005);抗人CD3-FITC、抗人穿孔素-PE和抗人颗粒酶素B-PC5.5(美国BioLegend公司,货号:300405、308195、372211);抗人CD8-APC(武汉Elabscience公司,货号:E-AB-F1110E);固定破膜剂(美国赛默飞世尔科技公司,货号:88-8824);丝裂霉素C(美国GlpBio公司,货号:GC12353);重组人白介素(interleukin-2,IL-2) (美国Peprotech公司,货号:200-02);
1.1.2主要仪器 CO2细胞培养箱(美国Thermo公司,型号:HF90/HF240);多功能酶标仪(济南爱来宝仪器设备有限公司,型号:ST-960);流式细胞仪(美国贝克曼库尔特公司,型号:CytoFLEX)
1.2 方法
1.2.1实验药物配置 DHA用DMSO充分溶解并配置成50 mmol/L的母液,-20 ℃保存;IL-2开盖前以10 000~12 000 r/min离心30 s,用PBS充分溶解,配置成50 000 U/ml的溶液,-20 ℃保存。
1.2.2A549细胞培养 A549细胞使用含10%的胎牛血清和1%青-链霉素的RPMI-1640培养基在37 ℃、5%CO2的培养箱中培养,待到细胞密度长至80%~90%左右进行传代,后续实验采用第3代细胞。
1.2.3CCK-8实验 将A549细胞以5×103个/孔接种于96孔板中,置于培养箱中贴壁过夜,对照组和DHA组分别加入DMSO和不同浓度的(25、50、100 μmol/L)DHA培养24、48、72 h,配置CCK-8试剂与RPMI-1640培养基混合溶液(1∶10),弃去96孔板中的旧培养基,在3个不同待测时间均加入100 μl/孔的CCK-8混合液,置于37 ℃培养箱反应1 h,酶标仪检测各孔450 nm处的吸光度值并计算细胞抑制率和半抑制浓度(half maximal inhibitory concentrate,IC50),根据IC50分析和实验结果选择最适宜的浓度和处理时间,后续实验DHA处理组均采用该浓度和时间。
1.2.4集落形成实验 将A549细胞分为对照组和DHA组,铺到6孔板上,贴壁过夜后,分别予以DMSO和50 μmol/L(即A549细胞IC50临近浓度)的DHA处理24 h,胰酶消化,用RPMI-1640培养基重悬,调整细胞浓度为1×103个/孔并接种于新6孔板中,37 ℃培养箱中培养8 d,弃去旧培养基,1 ml/孔甲醇固定30 min,0.1%结晶紫染液1 ml/孔染色30 min,染色结束后拍照,用ImageJ软件计算集落形成数,实验重复3次。
1.2.5A549细胞与淋巴细胞共培养 10 μg/ml丝裂霉素预处理对照组、DHA组(50 μmol/L)A549细胞2.5 h,胰酶消化重悬后调整细胞浓度为5×104个/ml,加入提前用1 μg/ml CD3单抗预包被的12孔板中,放入培养箱中等待A549细胞贴壁。用EDTA管抽取健康志愿者新鲜血液20 ml,缓慢加入Ficoll分离液中并形成明显的分层界面,室温下2 500 r/min离心20 min。离心后用无菌巴氏吸管小心吸取白膜层,即淋巴细胞层,PBS洗涤细胞后离心3次,每次1 500 r/min、10 min,得到外周血单个核细胞(peripheral blood mononuclear cells,PBMC)。将PBMC用RPMI-1640培养基重悬并接种于培养皿中,培养箱静置培养1.5 h后吸取上清液并分离出淋巴细胞,调整细胞浓度为5×105个/ml,加入经预处理的A549细胞并建立1 ml共培养体系,每2 d添加200 U/ml的IL-2并进行1次半量换液,培养2周。
1.2.6流式细胞术检测CD8+T细胞的数量及功能 吸取上述共培养的12孔板中培养液,1 000 r/min离心5 min后去上清液,加入配置好的CD8-APC、CD3-FITC抗体稀释液(1∶20),避光孵育15 min。使用固定破膜试剂对T淋巴细胞进行固定破膜,然后加入颗粒霉素B-PC5.5和穿孔素-PE抗体稀释液(1∶20),避光条件下室温反应15 min,PBS重悬细胞,于流式细胞仪上机完成流式细胞检测,实验重复3次。
2 结果
2.1 DHA对A549细胞生长的影响CCK-8法检测结果显示,与0 μmol/L的DMSO对照组抑制率(2.01%)相比,25、50和100 μmol/L的DHA对A549细胞24 h增殖的抑制率分别为23.56%、53.50%和91.26%,均高于对照组(t=6.75、18.43、33.17,均P<0.01)。见图1A。计算出A549细胞的IC50为46.26 μmol/L。接着比较IC50临近浓度(50 μmol/L)DHA处理A549细胞在不同时间的细胞抑制率,结果显示24、48、72 h的细胞抑制率分别为53.50%、63.84%和69.91%,呈现时间依赖性增加(t=61.35、12.35、7.33,均P<0.01)。见图1B。进一步采用集落形成实验检测DHA对A549细胞的作用,结果显示,DHA处理24 h后的A549细胞集落形成明显减少(t=-8.97,P<0.01)。见图1C、D。以上结果表明DHA以时间依赖方式和浓度依赖方式抑制A549细胞的生长。
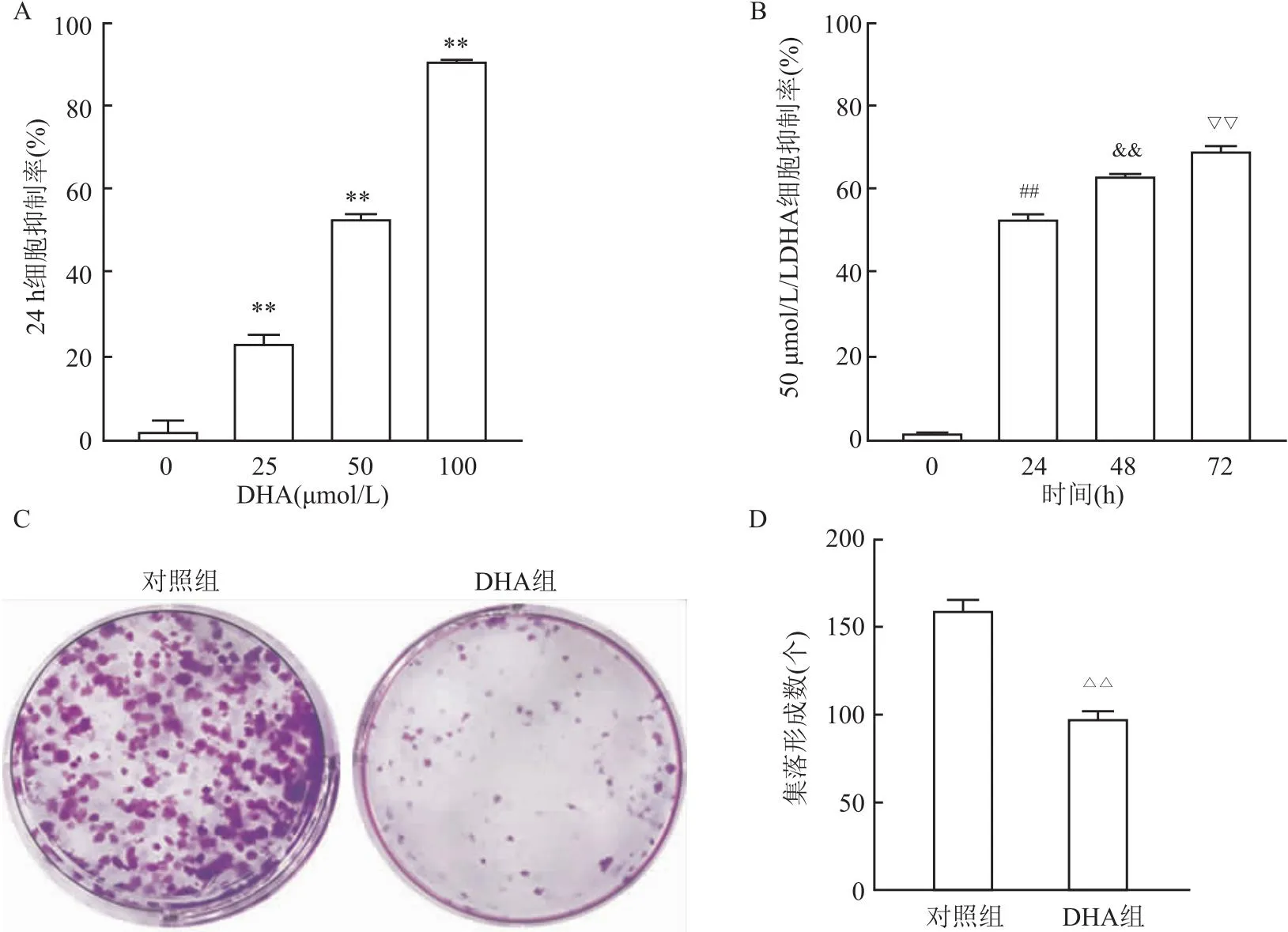
图1 DHA对 A549细胞的生长的影响
2.2 DHA处理对A549细胞诱导的CD8+T细胞增殖的影响流式细胞术检测结果显示,与对照组相比,50 μmol/L DHA处理组的CD8+T细胞数量上升。见图2A。对照组和DHA处理组的CD8+T细胞的比例分别为51.95%±2.77%和73.58%±5.77%,其差异具有统计学意义(t=5.86,P<0.01)。见图2B。表明DHA预处理的NSCLC A549细胞能够刺激CD8+T细胞的生长。

图2 流式细胞术检测两组CD8+T细胞比例
2.3 DHA处理对共培养体系中CD8+T细胞的抗肿瘤免疫应答的影响流式细胞术检测结果显示,对照组和DHA处理组表达穿孔素的CD8+T细胞比例分别为0.62%±0.54%和4.46%±0.05%。见图3A、B。表达颗粒酶B的CD8+T细胞比例分别为2.63±0.56%和9.67±0.70%。见图3C、D。与对照组相比,DHA处理组的CD8+T细胞表达的穿孔素和颗粒酶B水平均明显提升(t=13.58、12.35,

图3 流式细胞术检测CD8+T细胞功能
均P<0.01)。以上结果均表明DHA预处理的NSCLC A549细胞能够诱导CD8+T细胞的抗肿瘤免疫功能。
3 讨论
本研究结果表明,DHA能够抑制NSCLC的生长和集落形成能力。Liao et al[5]研究表明,DHA能够通过将NSCLC A549细胞的细胞周期停滞于G1期来抑制细胞增殖并诱导细胞凋亡。Han et al[6]研究结果表明,DHA能诱导细胞铁死亡从而刺激内质网应激和DNA损伤,最终促进癌症免疫原性细胞死亡,同时,DHA还能激活免疫细胞,在NSCLC荷瘤小鼠中表现出优异的抗癌疗效。胡冰琪 等[7]研究表明,DHA能够抑制NSCLC的迁移、侵袭和血管生成拟态。这些都证明了DHA能够通过多种机制发挥抗肿瘤作用。此外,DHA还对多种肿瘤具有抗癌效果。例如,Rac1 siRNA可通过抑制核因子κB活化来促进DHA对结肠癌的抗癌作用[8],DHA还能通过增加肝癌细胞内活性氧的水平从而促进肝癌细胞凋亡[9]。另外,DHA还能通过调节细胞周期蛋白的信号传导来抑制胃癌细胞的生长和侵袭[10]。以上研究均表明DHA具有广泛抑制肿瘤的作用,很可能是癌症治疗的新方向。
CD8+T细胞在抗肿瘤免疫应答中起到重要作用,CD8+T细胞的浸润增加表明可能产生有效的抗肿瘤免疫反应。本研究结果显示DHA处理的A549细胞能够明显提升CD8+T细胞的比例,这表明DHA处理的A549细胞能够诱导抗肿瘤免疫。Hu et al[11]研究表明,在建立的NSCLC小鼠模型中,DHA能够通过抑制共信号分子CD276的表达来抑制NSCLC的增殖和侵袭,且对健康组织无明显毒副作用,另外,该研究还表明,DHA能够通过阻断B7-H3来诱导肿瘤中CD8+T细胞的浸润。Han et al[12]实验结果也表明,在结直肠癌中,DHA以诱导细胞铁死亡的方式抑制肿瘤生长并增强了CD8+T细胞的肿瘤浸润能力,此外,DHA还能够增强程序性死亡受体配体-1免疫检查点抑制剂的疗效。这些研究结果均表明DHA能够刺激肿瘤微环境中CD8+T细胞的浸润,与本研究结果一致。
本研究还表明DHA处理的A549细胞能够刺激CD8+T细胞表达穿孔素和颗粒酶B,诱导CD8+T细胞的抗肿瘤免疫应答。活化的细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)是体内最有效的免疫效应细胞,能通过多种途径发挥抗肿瘤免疫效应。一般认为,肿瘤免疫中CTL主要通过两种途径诱导肿瘤细胞死亡,即穿孔素-颗粒酶途径和Fas-FasL途径[13]。Zhang et al[14]研究结果显示,在黑色素瘤肺转移的小鼠模型中,DHA增加了肿瘤中CTL的浸润及其颗粒酶B分泌的水平,研究结果在一定程度上与本研究一致。也有其他研究[15]证明,在胰腺癌中,适当浓度的DHA有利于T细胞亚群的扩增并上调穿孔素和颗粒酶B的表达。但DHA诱导CD8+T细胞免疫应答的具体机制仍不清楚,细胞因子在其中发挥的作用也仍待进一步研究。
综上所述,本研究表明DHA能够抑制NSCLC细胞的增殖,同时DHA促进了NSCLC A549细胞CD8+T细胞抗肿瘤免疫应答。该研究结果为DHA在NSCLC治疗中的应用提供了实验依据,DHA可能会成为肿瘤免疫治疗的新策略。

