髓系特异性Spi1基因敲除小鼠的构建和基因鉴定
吴旭铭,王卉卉,朱向玲,周园园,王安琪,张慧茹,刘 崇,涂佳杰
脾病灶形成病毒前病毒整合癌基因-1/富含嘌呤盒1(spleen focus forming virus proviral integration oncogene,Spi-1/purine rich box-1,PU.1)是鼠红白血病中基因转录上调的一种原癌基因。人类的Spi1基因位于11号染色体,在骨髓和B淋巴细胞的发育过程中发挥重要作用。转录因子PU.1是E26转化特异性转录因子家族的一员,该家族成员在多种人体组织中普遍表达,各成员发挥不同的生物学功能。PU.1蛋白有272个氨基酸,N-末端含有一个转录激活结构域,C-末端含有一个DNA结合结构域[1]。目前病理条件下PU.1的研究主要集中在免疫系统相关的癌症,其在系统性自身免疫性疾病中的作用尚不清楚[2]。最近的研究[3-5]表明PU.1参与多种自身免疫性疾病的发展,包括类风湿性关节炎(rheumatoid arthritis,RA)、实验性自身免疫性脑脊髓炎和系统性红斑狼疮,并通过影响多种免疫细胞的功能来影响这些疾病的过程。课题组前期研究[6]表明,PU.1可直接靶向巨噬细胞和成纤维样滑膜细胞中的FMS样酪氨酸激酶3从而促进关节炎的发生发展。PU.1在多种免疫细胞中的特异性作用为RA的发病机制提供了新的思路和潜在的治疗靶点。构建Spi1基因敲除小鼠对充分阐明 PU.1的病理作用机制及药物靶点的明确具有重要意义。该研究利用CRISPR/Cas9技术和Cre/LoxP系统构建髓系特异性Spi1基因敲除小鼠,对后代子鼠进行基因型鉴定和蛋白水平验证从而验证小鼠构建结果,为进一步以PU.1为靶点的疾病和药物研究提供基因工程动物模型。
1 材料与方法
1.1 实验动物Spi1flox/+小鼠与赛业(苏州)生物科技有限公司联合构建;Lyz2-Cre+小鼠由该公司赠送,生产许可证号:SCXK(苏)2018-0003。实验动物通过安徽医科大学临床药理研究所动物实验伦理委员会批准,伦理审查批准号为PZ-2022-023,并在安徽医科大学临床药理研究所动物实验中心无特定病原体级动物房饲养繁殖。
1.2 主要材料GenCrispr NLS-Cas9-EGFP Nuclease(南京金斯瑞生物科技,货号:Z03393);sgRNA、Donor载体由赛业(苏州)生物科技有限公司合成;孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)(武汉艾美捷科技有限公司,货号:HOR-272);人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)(上海羽哚生物科技有限公司,货号:YLY0803);M16培养基(美国Sigma-Aldrich公司,货号:M7292);2×HotStrat Taq PCR Master Mix、50×TAE Buffer、Gelred核酸染料10 000×、100 bp Ladder DNA Marker(北京博迈德基因技术有限公司,货号:MT205、EL102-01、EL108、MD112);琼脂糖Agarose(德国BioFroxx公司,货号:1110GR100);RPMI 1640培养基(上海逍鹏生物科技有限公司,货号:C3010-0500);磷酸盐缓冲液 PBS pH7.2(上海源培生物科技股份有限公司,货号:B31OKJ);Western blot抗体:Anti-PU.1/Spi1抗体(英国Abcam公司,货号:ab230336);β-actin抗体(美国Affinity公司,货号:#T0022);辣根过氧化物酶偶联亲和山羊抗兔IgG(H+L)、辣根过氧化物酶偶联亲和山羊抗小鼠IgG(H+L)(武汉三鹰生物技术有限公司,货号:SA00001-2、SA00001-1)。
1.3 主要仪器CO2培养箱(上海博旅仪器有限公司,型号:P-90A);荧光定量PCR仪(杭州朗基科学仪器有限公司,型号:T20);多功能水平电泳槽(上海天能科技有限公司,型号:HE-120);Tanon 1600系列全自动凝胶图像分析系统(上海天能科技有限公司,型号:Tanon 1600)。
1.4 方法
1.4.1Spi1flox/+小鼠构建 根据Spi1Gene ID(20375)小鼠基因组序列信息,发现Spi1基因有5个转录本,根据Spi1基因的结构,推荐选择第2号外显子(Exon 2)所在的转录本为敲除区域。利用CRISPR/Cas9技术对Spi1基因进行改造,在Exon 2两侧各放置同向Loxp元件。利用美国麻省理工学院CRISPR Design软件(http://crispr.mit.edu)设计筛选得到一对先导RNA(single guide RNA,sgRNA),即gRNA1(GAGTGAGTCTCCACGGCTTT)和gRNA2(AGGTCGAGCTCCGCGCTCCC)。根据sgRNA序列设计并合成Donor载体。筛选10只3~4周C57BL/6雌鼠,注射5 IU PMSG,46~48 h后再注射5 IU HCG;注射HCG 12 h后将雌鼠与成年的可育雄鼠交配,使雌鼠受精;次日将雌鼠安乐死后,从输卵管内收集受精卵,放置37 ℃恒温5 %的CO2培养箱内备用;将30 ng/μl Cas9蛋白、2 pmol/μl靶向Spi1基因的sgRNA和15 ng/μl含有Loxp位点的Donor供体载体混合体显微注射到C57BL/6J小鼠的受精卵中,注射共计280枚受精卵,将注射完毕的受精卵转移到M16培养基中,并放入37 ℃恒温5 %的CO2培养箱内,培养0.5~1 h后进行移植;选取适龄的可育母鼠与输精管结扎后绝育的雄鼠交配得到假孕母鼠,移植受精卵到假孕的C57BL/6J母鼠的子宫中,共计移植10只代孕鼠,19~20 d后获得F0代。将阳性F0代(Spi1flox/flox)小鼠与C57BL/6J小鼠交配,得到稳定的F1代Spi1flox/+小鼠。
1.4.2Spi1flox/flox/Lyz2-Cre+小鼠获得 将Spi1flox/+小鼠雌雄自交获得Spi1flox/flox小鼠。Spi1flox/flox与Lyz2-Cre+小鼠交配,得到Spi1flox/+/Lyz2-Cre+小鼠。将Spi1flox/+/Lyz2-Cre+小鼠与Spi1flox/flox交配,最终得到Spi1flox/flox/Lyz2-Cre+小鼠和Spi1flox/flox/Lyz2-Cre-小鼠。Spi1flox/flox/Lyz2-Cre+小鼠为髓系特异性Spi1基因敲除小鼠(myeloid-specificSpi1knockout mice,KO小鼠);Spi1flox/flox/Lyz2-Cre-小鼠作为野生型(wild type mice,WT)小鼠。
1.4.3PCR鉴定Spi1flox/+和KO小鼠基因 剪取适龄小鼠鼠尾3 mm,置于无DNA污染的1.5 ml EP管,每支EP管加入50 μl鼠尾裂解液[25 mmol/L NaOH,0.2 mmol/L EDTA(pH=8.0)],95 ℃振荡恒温金属浴30 min。3 000 r/min离心5 min后加入50 μl[4 mmol/L Tris-Hcl缓冲液 (pH=8.0)],于涡旋震荡器上震荡并充分混匀。3 000 r/min离心5 min,吸取上清液至新的EP管中作为DNA模版。PCR扩增反应体系:DNA模板2 μl、正反向引物各1 μl(10 μmol/L)、2×HotStrat Taq PCR Master Mix 12.5 μl,去离子水补齐至25 μl。其中LoxP基因型鉴定正向引物:5’-GTGTGGACATGTGAGAGTGAGTCT-3’,反向引物:5’-TCTCTTATTATCCACTGCACCGTT-3’;Lyz2-Cre基因型鉴定正向引物:5’-CCCAGAAATGCCAGATTACG-3’,反向引物:5’-CTTGGGCTGCCAGAATTTCTC-3’。PCR扩增程序:94 ℃ 预变性3 min;94 ℃ 变性30 s,60 ℃退火35 s,72 ℃延伸35 s,35个循环;72 ℃ 5 min终止反应。琼脂糖凝胶电泳:取1.2 g琼脂糖溶于60 ml 1×TAE缓冲液中,微波沸腾3次,待稍冷却后加入10 μl核酸染料,倒入模具凝固后得到琼脂糖凝胶。取10 μl PCR扩增产物及5 μl DNA Marker进行电泳,120 V,30 min,用Tanon 1600系列全自动凝胶图像分析系统分析成像并保存。
1.4.4小鼠免疫细胞分离 小鼠处死后用75 %酒精消毒,取出股骨和胫骨,用生理盐水冲出骨髓细胞,细胞筛过滤除去残存肉沫,1 500 r/min离心5 min,弃上清,加入含10 ng/ml M-CSF 的1640培养基,培养7 d获得骨髓来源巨噬细胞(bone marrow-derived macrophages,BMDMs);剪开小鼠腹部皮肤,用注射器抽取磷酸盐缓冲液(phosphate buffered solution,PBS)约6~8 ml注入腹腔,5 min后用眼科镊稍提起腹腔,用1 ml注射器吸出,1 500 r/min离心5 min弃上清获得腹腔原位巨噬细胞(peritoneal macrophage,PM);取出胸腺剪碎研磨,细胞筛过滤,离心弃上清液获得胸腺T细胞。
1.4.5Western blot检测PU.1表达水平 将分离出的BMDMs、PM和胸腺T细胞制备成蛋白样本进行聚丙烯酰胺凝胶电泳,转膜,封闭,置于封闭液稀释的PU.1(1∶1 000)及内参β-Actin(1∶10 000)抗体中4 ℃孵育过夜,洗膜除去残留的一抗,分别置于封闭液稀释的辣根过氧化物酶偶联亲和山羊抗兔IgG(H+L)(1∶100 000)和辣根过氧化物酶偶联亲和山羊抗小鼠IgG(H+L)(1∶100 000),室温孵育2 h,洗膜除去残留的二抗,暗室显影。
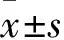
2 结果
2.1Spi1flox/flox小鼠获得及鉴定结果采用CRISPR/Cas9基因编辑技术将Spi1flox/+小鼠LoxP位点放置于Spi1基因Exon2区域两侧,构建策略如图1。Spi1flox/flox基因型小鼠由Spi1flox/+基因型小鼠雄雌自交获得,采用flox引物鉴定时仅扩增出220 bp条带的小鼠基因型为Spi1flox/flox纯合子,仅扩增出159 bp条带的小鼠基因型为Spi1+/+纯合子,同时扩增出220 bp和159 bp条带的小鼠基因型为Spi1flox/+杂合子(图2)。结果表明Spi1flox/flox小鼠构建成功。

图1 Spi1flox/flox小鼠构建策略

图2 Spi1flox/flox小鼠和Spi1flox/flox/Lyz2-Cre+小鼠基因型鉴定
2.2KO小鼠获得及鉴定结果为获得KO基因型小鼠,首先将Spi1flox/flox与Lyz2-Cre+小鼠交配获得Spi1flox/+/Lyz2-Cre+小鼠,再将其与Spi1flox/flox交配,最终获得KO基因型小鼠。PCR鉴定结果显示,采用flox引物鉴定时仅扩增出220 bp条带的小鼠基因型为Spi1flox/flox纯合子,采用Lyz2-Cre引物鉴定时可扩增出700 bp的小鼠基因型为Lyz2-Cre+,无条带的小鼠基因型为Lyz2-Cre-(图2)。
2.3 KO小鼠免疫细胞中PU.1的表达分离WT和KO小鼠的BMDMs、PM和胸腺T细胞,Western blot检测PU.1表达,结果显示,与WT组比较,KO组小鼠BMDMs中PU.1不表达(P<0.001);PM中PU.1也不表达(P<0.001);T细胞中PU.1表达水平与WT小鼠差异无统计学意义(图3)。表明髓系特异性Spi1基因敲除小鼠构建成功。

图3 小鼠PU.1表达的比较
3 讨论
目前基因敲除技术在基础实验研究中广泛应用,但全基因敲除过程中常导致小鼠胚胎致死[7]。条件性基因敲除技术与全基因敲除技术相比显然有着明显的优势和更为广泛的应用前景,其中基于Cre-loxP系统的条件性基因敲除小鼠在改善小鼠胚胎致死的同时也为在特定的细胞亚群中研究基因功能提供了可能。
LoxP序列是从大肠埃希菌P1噬菌体中发现的长度为34 bp的碱基序列,由两个13 bp的反向重复序列和中间8 bp的间隔序列组成[8]。Cre重组酶可以特异性识别细胞内基因或DNA上的LoxP序列,并根据其位置和序列之间的关系介导不同的特异性重组反应。应用Cre-LoxP系统构建条件性基因敲除小鼠,主要是构建具有LoxP序列的目的基因突变小鼠和构建带有Cre酶基因的转基因Cre小鼠,将两种小鼠杂交后经筛选可得到细胞内同时存在Cre重组酶基因和LoxP序列的小鼠,通过条件性表达Cre重组酶并与细胞内LoxP序列特异性识别,删除相应的基因或基因片段,从而完成条件性基因敲除小鼠的构建[8]。
本实验首先利用CRISPR Design工具,结合Spi1Gene ID(20375)小鼠基因组序列信息,设计针对Exon2的sgRNA,再根据sgRNA序列设计Donor载体。将Cas9蛋白和转录好的sgRNA以及纯化后的Donor载体片段显微注射到受精卵中,随后将胚胎转移到假孕动物中以产生F0代。最后将阳性F0代与C57BL/6J交配获得稳定的F1代Spi1flox/+小鼠,F1代小鼠之间杂交得到Spi1flox/flox小鼠。将Spi1flox/flox小鼠与带有骨髓细胞特异性表达Cre酶的Lyz2-Cre+小鼠杂交获得Spi1flox/+/Lyz2-Cre+小鼠,再将其与Spi1flox/flox小鼠杂交即可获得Spi1flox/flox/Lyz2-Cre+小鼠。
转录因子PU.1对多种骨髓细胞的分化和功能是必需的[9-10],并在病理情况下如血液系统相关疾病[11-12]和自身免疫性疾病[3-5]中发挥重要作用。巨噬细胞从髓系祖细胞分化伴随着E26转化特异性转录因子PU.1的表达增加;PU.1表达减少导致髓系祖细胞增殖增加和分化受损[9]。PU.1结合大多数受IL-1抑制的靶基因,在炎症应激期间调节造血干细胞(hemopoietic stem cell,HSC)周期活动从而影响血液系统对炎症信号的反应[11]。在自身免疫性疾病类风湿性关节炎中,PU.1可直接靶向巨噬细胞和成纤维样滑膜细胞中的FMS样酪氨酸激酶3从而促进关节炎的发生发展[6]。因此,构建Spi1基因敲除小鼠对充分阐明 PU.1的病理作用机制及药物靶点的明确具有重要意义。
综上所述,本研究成功构建了髓系特异性Spi1基因敲除小鼠,可为探讨PU.1在自身免疫性疾病及肿瘤中的作用机制提供动物模型基础。

