肝细胞特异性Sirt3基因敲除小鼠模型的构建
许雅萍,王语涵,陈婷婷,李 南,高萍萍,李 玲,王 华,孙妩弋
沉默信息调节因子3(silence information regulator 3,Sirt3)是一种烟酰胺腺嘌呤二核苷酸(nicotina mide adenine dinucleotide,NAD)依赖性的去乙酰化酶,属于Sirtuins蛋白家族[1]。肝细胞作为肝脏中主要的实质细胞,其介导碳水化合物、脂质和蛋白质代谢、解毒和免疫细胞激活,以维持肝脏内稳态[2]。研究[3-6]表明,肝细胞在接受肝脏损伤和炎症信号后会发生凋亡、坏死、自噬等,并通过释放各种细胞炎性介质,参与药物性肝损伤、病毒性肝病、肝纤维化等疾病的发生发展。
Sirt3作为一种重要的去乙酰化酶,可通过维持肝细胞线粒体完整性和清除胞内活性氧抑制氧化应激,从而调控肝细胞凋亡、坏死等过程,在多种肝脏疾病中发挥重要调节作用[7-8]。研究[9]表明,正常小鼠Sirt3全身敲除后体内出现异常的氧化应激,但在肠上皮细胞中特异性敲除Sirt3基因后小鼠表现正常,而造模后与正常小鼠相比可明显加速肠道癌变,提示细胞条件性敲除Sirt3对于研究疾病的病理机制十分必要。因此,该研究中,利用Cre-loxP重组酶系统的基因敲除技术,以原代肝细胞为对象,建立了肝细胞特异性Sirt3基因敲除小鼠模型,该模型成功建立后可在转基因小鼠体内稳定遗传,为进一步在各类肝脏疾病中阐述肝细胞Sirt3基因发挥的作用提供良好的实验动物模型基础。
1 材料与方法
1.1 材料
1.1.1实验动物 体质量为20~25 g的雄性Sirt3flox/flox小鼠、Alb-Cre转基因小鼠各8只均购自江苏集萃药康生物科技股份有限公司,均为C57BL/6J遗传背景。本研究获得安徽医科大学临床药理研究所动物实验伦理委员会批准(编号:PZ-2023-008)。本研究的实验动物均由安徽医科大学临床药理研究所SPF级动物房饲养和繁育,对饲养环境进行了精确的控制,保持在大约25 ℃的温度和70%左右的湿度。实验动物自由饮食和饮水。实验动物的使用许可证号:SYXK(皖)2020-001。
1.1.2 主要试剂2×Taq PCR Master Mix(货号:MT201)、50×TAE(货号:EL102-01)、DNA marker(货号:MD112)均购自北京博迈德基因技术有限公司;蛋白酶K(货号:V900887-100MG)购自美国Sigma Aldrich公司;基因鉴定引物购自上海生工生物工程股份有限公司;Super Red核酸染料(货号:BS354B)购自北京兰杰柯科技有限公司;RIPA蛋白裂解液(货号:P0013C)、苯甲基磺酰氯(phenylmethyl sulfonylfluoride,PMSF)(货号:ST506-2)、5×电泳加样缓冲液(货号:P0015L)均购自上海碧云天生物技术公司;抗β-actin抗体(货号:T0022)、抗Sirt3抗体(货号:AF5135)均购自美国Affinity公司;抗Albumin抗体(货号:66051-1-Ig)、辣根过氧化物酶山羊抗兔二抗(货号:SA00001-2)和鼠二抗(货号:SA00001-1)均购自美国Proteintech公司;ECL化学发光试剂盒(货号:BL520B)购自北京Biosharp公司;Alexa Fluor 488标记的山羊抗鼠IgG荧光二抗(货号:711-546-152)、Alexa Fluor 647标记的山羊抗兔IgG荧光二抗(货号:715-606-150)均购自美国Jackson ImmunoResearch公司。
1.1.3 主要仪器化学发光凝胶成像分析系统(上海天能科技有限公司,型号:Tanon-5200);冰冻切片机(德国LEICA公司,型号:CM 1950);通用型电泳仪(北京六一生物科技有限公司,型号:DYY-7C);石蜡切片机(美国Thermo Fisher Scientific公司,型号:MICROM HM 325);玻片扫描仪(山东济南丹吉尔电子有限公司,型号:Pannoramic MIDI);激光共聚焦显微镜(德国LEICA公司,型号:TCS SP8); Themal Cycler PCR仪(美国BIO-RAD公司,型号:T100)。
1.2 方法
1.2.1肝细胞特异性Sirt3敲除小鼠模型的构建策略与流程Sirt3基因位于Chr7染色体上,有10个转录子,根据Sirt3基因的结构,将Sirt3-201转录本的外显子2~3作为敲除区域,该区域含有起始密码子ATG编码序列,敲除该区域会导致蛋白质功能的缺失。本研究使用Cre-loxP系统进行实验,以Sirt3flox/flox小鼠和Alb-Cre小鼠进行配繁。Sirt3flox/flox小鼠是在Sirt3基因的2号和3号外显子插入了loxP位点的实验鼠,而Alb-Cre小鼠则是具有肝细胞特异性表达Cre重组酶的实验鼠。通过同源重组,Alb-Cre重组酶可以特异性敲除Sirt3基因,因为它具有识别loxP位点的能力(图1A)。在构建过程中,首先将Sirt3flox/flox小鼠与Alb-Cre+/+小鼠交配,产生了基因型为Sirt3flox/-/Alb-Cre+/-的小鼠,然后,这些小鼠与Sirt3flox/flox小鼠再次交配,生成了子代,其基因型为Sirt3flox/flox/Alb-Cre+/-小鼠(Sirt3Δhep小鼠)和Sirt3flox/flox/Alb-Cre-/-小鼠(Sirt3flox/flox小鼠)。见图1B。

图1 肝细胞特异性Sirt3基因敲除小鼠模型的构建策略(A)与流程图(B)
1.2.2PCR鉴定小鼠基因型 在小鼠4周时,将鼠尾剪下,加入鼠尾裂解液300 μl,蛋白酶K 20 μl,在55 ℃水浴中过夜,第2天,12 000 r/min离心1 min,取出上清液,加入400 μl预冷的无水乙醇,轻轻吹打混合,使其在管内沉淀出白色絮状DNA后,12 000 r/min离心5 min,弃去上清液。将70 %预先冷却的乙醇400 μl混合,12 000 r/min离心5 min,弃去上清液,仔细吸干残余乙醇,再打开离心管盖,室温静置2 h,使其完全挥发。加入30 μl复温的TE溶液使DNA溶解,混合均匀后放入4 ℃冰箱,备用。
PCR反应体系:12.5 μl 2×Taq Mix、9.5 μl去离子水、Sirt3或Alb-Cre基因鉴定引物(10 μmol/L)各1 μl和提取的小鼠DNA(100 ng/μl)1 μl。loxP和Alb-Cre的PCR扩增程序为:95 ℃、5 min;98 ℃、30 s,65 ℃(-0.5 ℃/循环)、30 s,72 ℃、45 s,20个循环;98 ℃、30 s,55 ℃、30 s,72 ℃、45 s,20个循环;72 ℃、5 min。基因鉴定引物序列见表1。在PCR扩增后,将产物进行琼脂糖凝胶电泳分析,并将凝胶置于化学发光凝胶成像分析系统中进行拍照观察。

表1 肝细胞特异性Sirt3基因敲除小鼠的基因型鉴定引物序列表
1.2.3免疫荧光双染检测小鼠肝细胞中Sirt3表达 取6周龄的Sirt3Δhep小鼠和Sirt3flox/flox小鼠肝组织,多聚甲醛固定过夜。OCT包埋后,进行冰冻切片。PBS洗3次,使用PBS稀释的Triton X-100室温通透30 min,PBS洗3次,5% BSA/PBS封闭液室温封闭1 h。加入抗Albumin(1∶150)、抗Sirt3抗体(1∶100),4 ℃孵育过夜,PBS洗3次,加入荧光二抗(1∶400)在室温下孵育30 min,PBS洗3次,并用激光共聚焦显微镜拍照观察。
1.2.4小鼠原代肝细胞的分离提取 利用改良版两步灌流法提取原代肝细胞,将6周龄的两组小鼠麻醉后消毒,打开腹腔。暴露肝门静脉,平行插入留置针,用37 ℃、0.5 mmol/L的EGTA灌洗液Ⅰ按5 ml/min流速进行肝灌注约25 ml,灌入的同时剪开下腔静脉,随后用灌流液Ⅱ(含胶原酶Ⅳ的DMEM高糖培基)匀速灌流约25 ml至肝软塌至出现皲裂。剪下肝放置培养皿中,加入15 ml完全培养基,撕裂肝包膜,形成肝细胞混悬液,用70 μm细胞网滤过,收集滤液。400 r/min离心5 min,弃上清液,重复多次,即得小鼠原代肝细胞。
1.2.5Western blot检测Sirt3的表达 在上述分离获得的Sirt3Δhep小鼠和对照组Sirt3flox/flox小鼠的原代肝细胞中,加入裂解液,提取总蛋白,同时提取小鼠的心、脾、肺和肾组织总蛋白。制备10%SDS-聚丙烯酰胺凝胶,上样电泳,将其置于PVDF薄膜上,然后用牛奶封闭,孵育抗Sirt3抗体(1∶1 000)、β-actin抗体(1∶1 000),置于冰箱4 ℃过夜,在进行TPBS洗脱之后,将二抗(1∶2 000)在室温下孵育2 h,并且使用化学发光成像系统进行显影。通过使用ImageJ软件分析结果,测量了条带的灰度值,并计算出各组目的条带与内参β-actin的比值,以反映目的蛋白的相对表达水平,并对各组之间的差异进行了比较。
1.2.6HE染色 取小鼠肝、心、脾、肺和肾组织进行包埋、切片,将石蜡切片放入二甲苯溶液中去除石蜡后,依次用100%、95%、85%、70%的乙醇水化,苏木精染色5 min,用流动水冲洗,0.1%的盐酸乙醇进行分化,然后用流动水冲洗,在伊红染液中2 s后,再用流动水冲洗,最后依次经70%、85%、95%、100%乙醇进行脱水,二甲苯透明,中性树脂封片后在玻片扫描仪下观察。
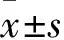
2 结果
2.1 肝细胞特异性Sirt3基因敲除小鼠的基因型鉴定结果Sirt3flox/flox/Alb-Cre小鼠与Sirt3flox/flox小鼠交配产生子代基因型鉴定结果见图2。在DNA样本中,若存在Sirt3flox/flox,则只扩增出423 bp长度的片段;若存在Sirt3flox/-,则同时扩增出342 bp的片段;若样本含有Cre基因,那么会扩增出340 bp的片段。正如图2A所示,小鼠编号1、3、4、5、7、8和9都携带着423 bp长度的Sirt3flox/flox基因;而在图2B中,小鼠编号1、2、3、5、7、8和9都有携带340 bp长度的Cre基因的特征。在这些实验中,编号为1、3、5、7、8和9的是Sirt3flox/flox/Alb-Cre小鼠,即Sirt3Δhep小鼠,而编号4的是Sirt3flox/flox小鼠。
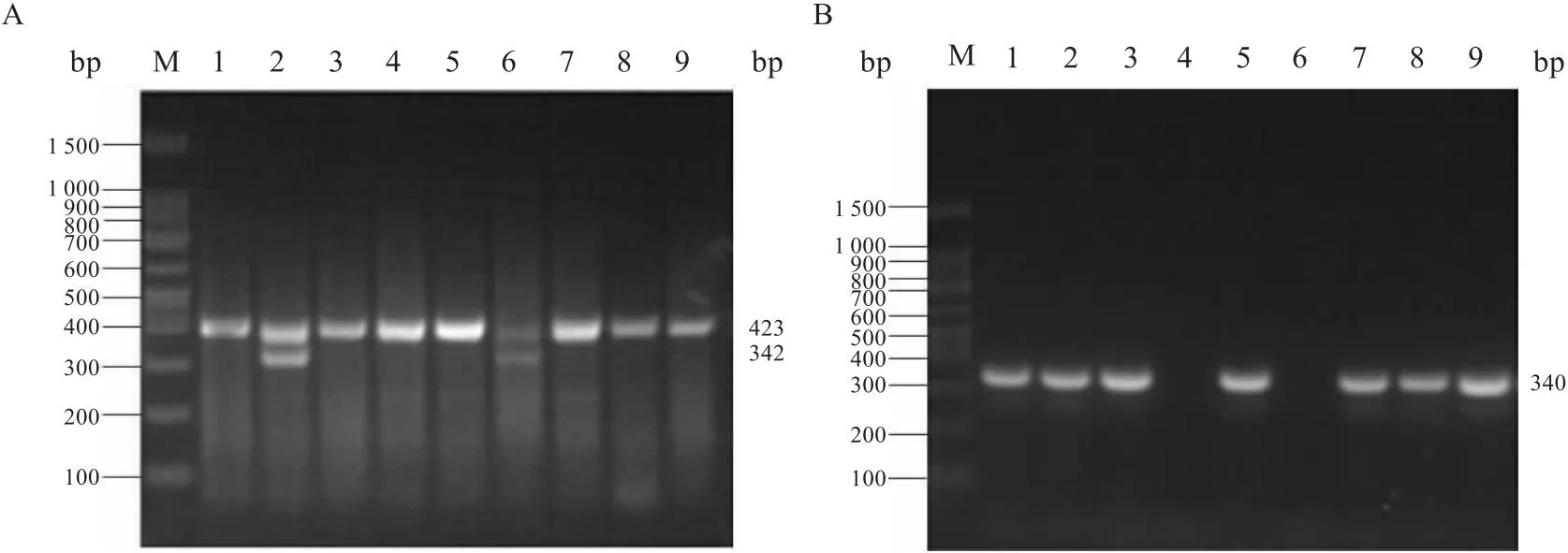
图2 Sirt3flox/flox/Alb-Cre小鼠基因型PCR鉴定结果
2.2Sirt3Δhep小鼠肝细胞中Sirt3的表达情况由于白蛋白是肝细胞特异性标记蛋白,为了验证Sirt3在Sirt3Δhep小鼠肝细胞中被敲除,首先使用免疫荧光双染法检测Sirt3和白蛋白在小鼠肝组织中的共定位情况,其中红色荧光蛋白标记为白蛋白,绿色荧光蛋白标记为Sirt3。图3结果显示,Sirt3flox/flox小鼠肝细胞中Sirt3荧光强度较强,有明显表达,而Sirt3Δhep组小鼠肝细胞中Sirt3蛋白基本不表达,提示肝细胞Sirt3基因敲除成功。
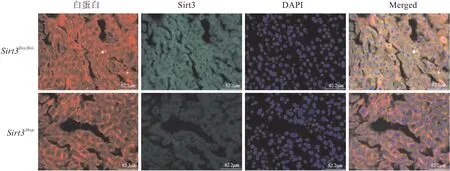
图3 免疫荧光双染检测小鼠肝细胞中Sirt3和白蛋白表达情况
2.3 Western blot检测小鼠肝细胞中Sirt3蛋白的表达情况为进一步确证Sirt3在Sirt3Δhep小鼠肝细胞中被敲除,通过Western blot检测Sirt3蛋白在小鼠原代肝细胞中的表达。结果如图4所示,与Sirt3flox /flox小鼠相比,Sirt3Δhep组的小鼠肝细胞中Sirt3蛋白表达减少,下降约90%(t=32.861,P<0.01),提示肝细胞特异性Sirt3敲除小鼠模型成功构建。
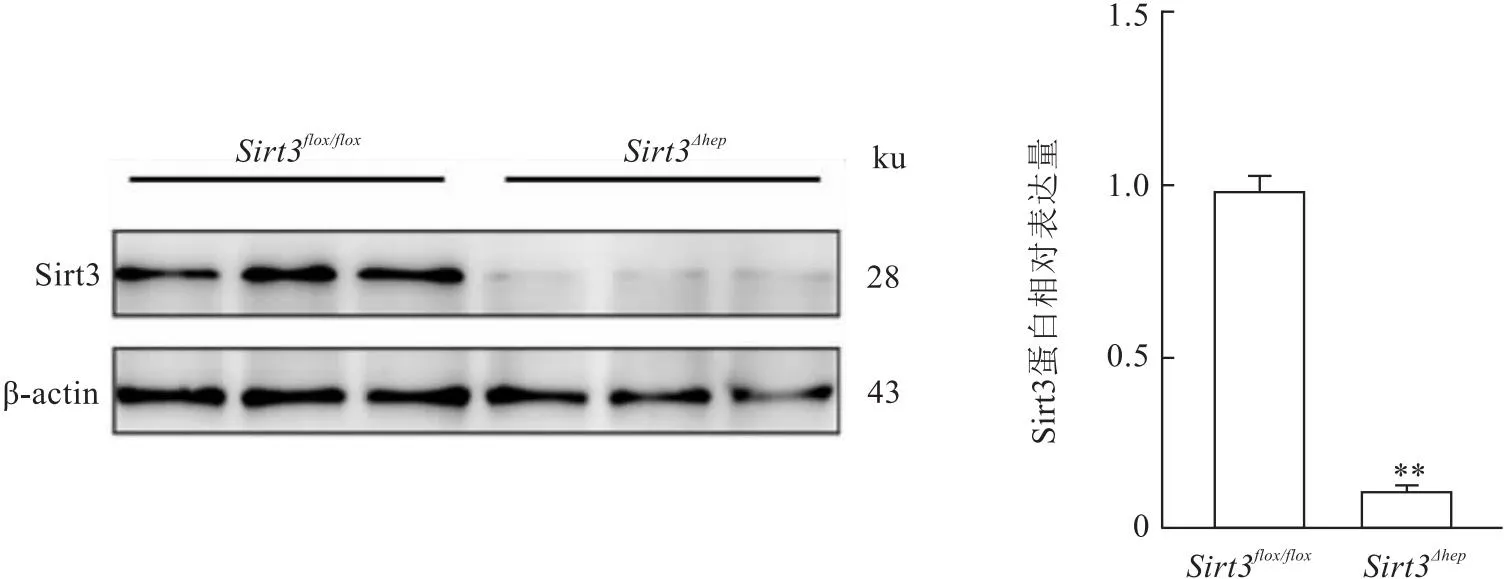
图4 Sirt3在两组小鼠原代肝细胞中蛋白表达的比较
2.4 Western blot检测小鼠心、脾、肺、肾组织中Sirt3蛋白的表达情况为了观察Sirt3Δhep小鼠其他主要脏器组织中Sirt3表达有无变化,分别提取心脏、脾、肺、肾组织蛋白,Western blot检测Sirt3蛋白表达。如图5所示,Sirt3flox/flox组与Sirt3Δhep组小鼠的心、脾、肺及肾脏中均有Sirt3蛋白表达;与Sirt3flox/flox小鼠相比,Sirt3Δhep组小鼠的心、脾、肺及肾脏中Sirt3蛋白表达量无明显差异(t=0.000、0.211、1.234、0.353,均P>0.05),提示构建的Sirt3Δhep小鼠Sirt3蛋白的表达在其他脏器中不受影响。

图5 Sirt3在其他组织器官中蛋白表达的比较
2.5Sirt3Δhep小鼠组织的HE染色结果肝组织HE染色显示,两组小鼠肝脏细胞形态正常、排列规则且结构完整(图6A),肝细胞的核呈现为圆形并位于中央,肝窦保持正常状态。肝细胞索以放射性方式排列,其细胞质着色一致,且没有发现炎症细胞的渗透。提示肝细胞特异性敲除Sirt3基因对肝组织的形态结构及病理特征并无明显影响。

图6 小鼠各脏器组织HE染色图
进一步观察肝细胞特异性敲除Sirt3基因对其他主要组织器官的影响,HE染色结果如图6B所示,两组小鼠的心肌纤维结构特征完整、形态清楚、排列整齐;脾脏组织结构清晰,边缘区清晰结构完整;肺部的组织构造显示正常,肺泡之间的间隔分布比较均匀,没有出现渗出或其他炎症迹象;而肾脏形态完整,结构清晰可见,肾小球和肾小囊的囊腔大小正常,提示各组织形态学无明显改变。以上结果提示肝细胞特异性敲除Sirt3基因对肝脏及主要器官的形态结构无明显影响。
3 讨论
由于C57BL/6小鼠遗传背景清晰,且其应用范围广泛,除了被应用于各类模型的造模,也被用于制备不同的基因工程小鼠,以更深入地进行相应基因功能性及药理学、药效学研究。研究人员通过Cre-loxP系统建立不同的基因敲除C57BL/6小鼠模型[10-11],可以为不同类型疾病的研究提供良好的模型基础。
已有研究[12]结果显示,全身敲除Sirt3(Sirt3KO)小鼠在高脂饮食中表现出更严重的高脂血症和脂肪性肝炎,提示Sirt3在肝脏疾病中可能具有十分重要的作用,然而也有研究[13]显示,全身敲除Sirt3的小鼠也出现了胰岛、心脏功能的损害,因此,全身敲除Sirt3的小鼠对于研究肝细胞Sirt3在肝脏疾病中的作用可能会受到其他疾病的影响,故全身敲除Sirt3小鼠在该研究领域中的应用受到限制[14]。因此,建立肝细胞特异性Sirt3敲除小鼠模型十分必要。
已有研究通过采用基因编辑技术[15]成功创建了仅在肝细胞中敲除Sirt3基因的小鼠模型。使用的Cre重组酶能够识别并定位Sirt3基因两端的两个loxP位点,并能够切除这两个位点之间的Sirt3基因序列,从而敲除Sirt3基因。本研究对4周左右的小鼠进行鉴定,成功筛选出Sirt3Δhep和Sirt3flox/flox小鼠。免疫荧光双染法和Western blot法检测显示Sirt3flox/flox小鼠肝细胞中Sirt3蛋白表达正常,而Sirt3Δhep小鼠肝细胞中Sirt3蛋白明显降低,提示肝细胞特异性Sirt3敲除小鼠模型构建成功。HE染色结果显示,两组小鼠的肝脏组织形态学及病理特征并无明显差异,心脏、脾脏、肺及肾脏等组织形态学也均无明显差异,提示肝细胞特异性敲除Sirt3对心、脾、肺和肾的器官的形态结构无明显影响。本研究成功建立了肝细胞特异性Sirt3基因敲除鼠模型,实现了Sirt3在肝细胞中的特异性敲除,可以为未来关于Sirt3在肝脏疾病和其他各种疾病中作用的研究,以及相关的分子调控机制提供可靠的实验动物模型,这将有助于将来对Sirt3的功能和机制更深入地研究,并为疾病的治疗和预防提供理论基础。

