滑膜液中PI3K/AKT/mTOR信号轴介导巨噬细胞极化对膝骨关节炎促炎反应的作用
蒋 总,郭腾逊,姚晓玲,兰维娅,唐 芳,马武开,刘 佳
膝骨关节炎(knee osteoarthritis,KOA)是多种因素介导的炎症性肌肉骨骼系统疾病,研究[1]表明滑膜炎与KOA密切相关,是KOA进展的主要因素,也可预测关节结构损伤。而巨噬细胞极化介导滑膜炎导致的滑膜肥大、增生和炎症细胞浸润是软骨退变的关键因素,也是KOA的主要致病因素[2]。抑制巨噬细胞极化减轻滑膜炎可能是延缓KOA进展的关键因素。
巨噬细胞极化可分为M1、M2两种,M1型巨噬细胞极化产生白细胞介素(interleukin,IL)-1、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促进炎症反应,而M2极化产生IL-4、IL-10等抑炎因子[3]。M1与M2型巨噬细胞比例失衡,特别是高表达M1型巨噬细胞极化介导的滑膜炎是导致KOA进展的主要因素之一,与KOA的严重程度显著相关[4]。研究[5]报道通过调控PI3K/AKT/mTOR信号通路可抑制KOA的滑膜炎,保护关节软骨。因此,该研究旨在通过收集KOA患者以及正常人的滑膜液,分析PI3K/AKT/mTOR信号通路与巨噬细胞极化的关系,为临床防治KOA提供新见解。
1 材料与方法
1.1 材料
1.1.1病例资料 本研究KOA的滑膜液样本来自2022年12月—2023年1月就诊于贵州中医药大学第二附属医院的女性患者[年龄50~70(59.5±7.0)岁]。KOA诊断由风湿病医生根据KOA(ICD-10编码:M17.0)的诊断标准进行诊断,选取经放射学检查后根据Kellgren-Lawrence (KL)分级为Ⅱ级、Ⅲ级且有关节腔滑液的6名患者为KOA组。排除有其他自身免疫疾病相关的关节炎、代谢相关性关节炎、感染性关节炎、肿瘤相关关节炎、或近3个月有膝关节损伤病史的关节炎患者。同时通过年龄、身体质量指数(body mass index,BMI)匹配招募正常女性3人(50~70岁)为对照组。于关节腔内注射灭菌注射用水,充分混匀后抽取膝关节滑膜液,严格按照无菌原则在密闭环境中进行。本研究经贵州中医药大学第二附属医院医学伦理委员会批准(批号:KYW2022020),所有受试者在参与研究前均签署了书面知情同意书。
1.1.2主要材料与仪器 一抗胞内磷脂酰肌醇激酶(phosphatidylinositol 3-kinase,PI3K)、p-PI3K、蛋白激酶B(protein kinase B,AKT)、p-AKT3、诱导性一氧化氮合酶(inducible nitric oxide,iONS)、山头抗兔二抗(武汉爱博泰克生物科技有限公司,货号:A0265、AP0854、A11016、AP0637、A3774、AS014);雷帕霉素靶蛋白C1(mammalian target of rapamycin C1,mTORC1)(美国CST,货号:2983T);PE抗人-CD86、CD80、CD163、CD206(北京安诺伦生物科技有限公司,货号:B357748、B332514、B357816、B358504);IL-1、IL-6、IL-10、TNF-α、转化生长因子-β(transforming growth factor-β,TGF-β) ELISA试剂盒(江苏晶美生物科技有限公司,货号:F0177-B、F0049-B、F0065-B、F0121-B、F1767-B);TRIzol(美国invitrogen,货号:ab137872)RPMI-1640培养基(上海源培生物科技股份有限公司,货号:L210KJ);RIPA裂解液、蛋白磷酸酶抑制剂、RNase and DNase AWAY(上海碧云天生物技术股份有限公司,货号:P0013B、P1045、R0123);2×T5 Fast qPCR Mix(SYBR Green I)、GoldenstarTMRT6 cDNA Synthesis Kit Ver.2(北京擎科生物科技股份有限公司,货号:TSE002、TSK302M)。精密恒温培养箱(上海一恒科学仪器有限公司,型号:BPH-9042);蛋白电泳仪、蛋白湿转仪、实时荧光定量PCR仪、水平电泳槽、核酸蛋白凝胶成像仪、曝光仪(美国Bio-Rad Laboratories公司,型号:Mini-Sub Cell GT、Mini Trans-Blot®Cell、IQ5、PowerPac Basic、Gel Doc XR+、732BR1158);酶标仪(美国Molecular Devices公司,型号:cMAXPlus)。
1.2 方法
1.2.1流式细胞检测滑膜液中M1、M2型巨噬细胞标志物 将KOA患者和健康对照组新鲜的滑膜液用100目细胞筛过滤后收集细胞悬液,1 000 r/min离心5 min,收集重悬细胞加入RPMI 1640培养基悬浮后,加入15 ml淋巴分离液、重悬后细胞平铺到分离液液面上方,收集交界面的巨噬细胞,加入5 μl巨噬细胞标记物(CD86、CD80、CD163、CD206),震荡混匀、室温下避光孵育20 min、加入1 ml PBS混匀,1 000 r/min离心5 min,同时设置空白对照,加入PBS重悬细胞后上流式细胞仪检测。通过流式细胞术检测结果,将所有滑膜液中M1阳性细胞的平均百分比(CD80、CD86)除以M2阳性细胞(CD163、CD206)的平均百分比计算M1/M2比率,以判定KOA滑膜液中巨噬细胞极化的类型。
1.2.2ELISA检测滑膜液中IL-1、IL-6、IL-10、TNF-α、TGF-β表达 根据ELISA试剂盒说明书,室温平衡试剂盒,稀释标准品封板后置于37 ℃温育30 min,取出封板膜后弃去液体,加满洗涤液静置30 s后弃去洗涤液,重复5次,加入酶标试剂,再次37 ℃温育30 min,加入洗涤液清洗5次,加入显色剂震荡混匀,37 ℃避光显色10 min后加入终止液,酶标仪中以450 nm波长依序测量各孔的吸光度。
1.2.3RT-PCR检测PI3K、AKT3、mTORC1、iNOS mRNA的表达 PI3K、AKT3、mTORC1是PI3K/AKT/mTOR信号通路发生细胞转录、增殖的关键因子,iNOS是PI3K/AKT/mTOR信号通路的关键下游因子,通过RT-PCR检测探索PI3K/AKT/mTOR信号通路在滑膜液中的机制。按照TRIzol试剂盒提取滑膜液中总的RNA,分光光度法计算各样本中RNA的浓度和纯度,按照试剂盒说明书进行反转录。在PCR仪中进行扩增,条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环进行扩增,通过2-△△CT法计算相对表达量,引物序列表见表1。

表1 引物序列表
1.2.4Western blot检测PI3K、p-PI3K、AKT、p-AKT3、mTORC1、iNOS蛋白表达 将滑膜液装入1.5 ml离心管中3 000 r/min离心5 min,洗涤2次后收集细胞,加入RIPA裂解液、蛋白磷酸酶酶抑制剂充分裂解细胞后13 000r/min离心20 min,进行电泳、转膜(转移时间根据蛋白分子量大小确定,1 kDa/min+30 min),封闭,加入1:1 000的一抗PI3K、p-PI3K、AKT3、p-AKT3、mTORC1、iNOS和GAPDH抗体4 ℃孵育过夜,冲洗3次后用加入1∶2 000 HRP标记的羊抗兔二抗室温孵育1 h后放入曝光仪中曝光检测,使用GAPDH作为内参,通过目标蛋白灰度值/内参总灰度值计算相对蛋白表达。
1.3 统计学处理数据以均数±标准差表示,符合正态分布且方差齐的两组间比较使用t检验,否则用Mann-WhitneyU进行统计分析。所有统计资料使用SPSS 25.0进行统计分析,使用GraphPad Prism 9作图软件作图,P<0.05为差异有统计学意义。
2 结果
2.1 人口学特征纳入KOA的患者中KL分级Ⅱ级和Ⅲ级各3例,平均年龄为59.5岁,病程平均30.3个月,平均BMI为23.9。对照组中年龄平均为56.3岁,平均BMI为20.7。KOA患者与正常受试者在BMI、年龄上差异无统计学意义。见表2。

表2 研究人群的基本特征
2.2 不同滑膜液的镜下特点KOA组滑膜液外观呈淡黄色,稍浑浊,可见部分淋巴细胞(图1A)。对照组为清亮、透明,未见明显细胞浸润(图1B)。提示KOA患者滑膜液存在炎症性改变。

图1 两组滑膜液的光学显微镜下图
2.3 M1型巨噬细胞极化在KOA滑膜液中占主导作用通过流式细胞术检测巨噬细胞M1(CD80、CD86)和M2(CD163、CD206)在KOA患者与对照组的滑膜液巨噬细胞的状态发现,KOA滑膜液中CD80与CD86细胞阳性率增加(均Z=-2.353、-2.353,均P<0.001),而对照组中CD163与CD206细胞阳性率高于KOA组(图2A)(均Z=-2.353、-2.353,均P<0.01)。与对照相比,KOA滑膜液样品细胞中的M1/M2比值更高(t=35.756,P<0.001)(图3)。提示在KOA中M1型巨噬细胞极化占有主导作用。
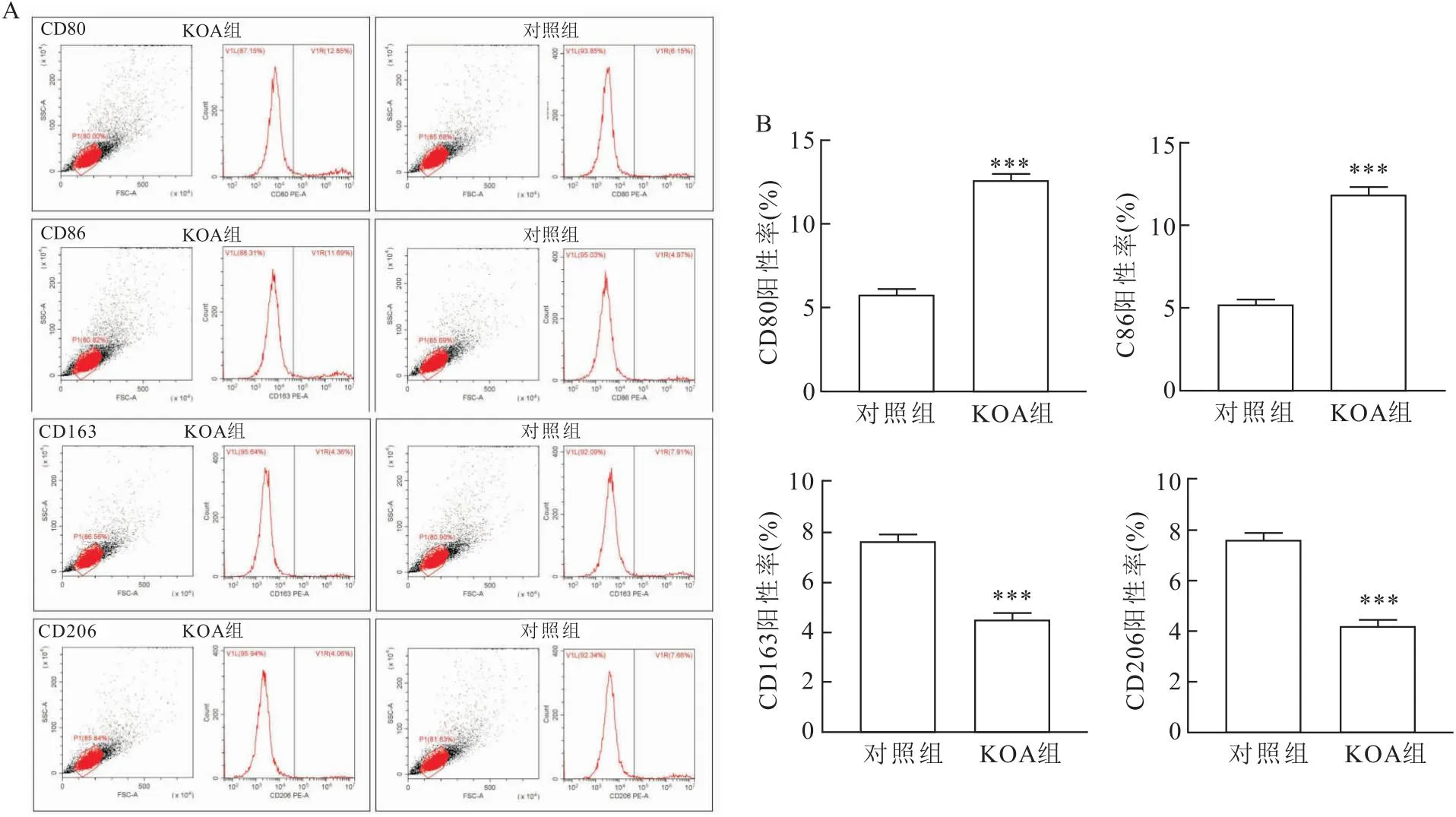
图2 不同组别滑膜液中巨噬细胞标志物比较

图3 两组M1/M2比值的比较
2.4 不同组别滑膜液中细胞因子IL-1、IL-6、TNF-α、IL-10和TGF-β的浓度比较在ELISA选定的细胞因子面板中,KOA滑膜液中M1型巨噬细胞促炎因子IL-1、IL-6、TNF-α的表达明显高于对照组细胞(t=-35.728、-17.679,Z=-2.353,均P<0.001)。与之相反,M2型巨噬细胞抑炎因子TGF-β和IL-10在KOA 滑膜液中低于对照组(t=214.452,Z=-2.353,均P<0.001)。见图4。这说明M1巨噬细胞极化在KOA滑膜液的炎症作用中起主要作用。

图4 各组滑膜液中细胞因子浓度的比较
2.5 KOA滑膜液中PI3K/AKT/mTOR信号通路关键因子PI3K、AKT3、mTORC1 mRNA表达情况通过RT-PCR进行检测发现PI3K、AKT3、mTORC1在KOA滑膜液中表达高于对照组(Z=-2.353、-2.353,t=4.869,均P<0.01),说明PI3K/AKT/mTOR信号通路在KOA滑膜液中被激活。PI3K/AKT/mTOR信号通路下游靶点因子iNOS在KOA滑膜液中表达也升高(t=7.360,P<0.01)。见图5。说明PI3K/AKT/mTOR信号通路激活介导下游炎症因子释放可能是KOA滑膜液炎症反应产生的主要原因。
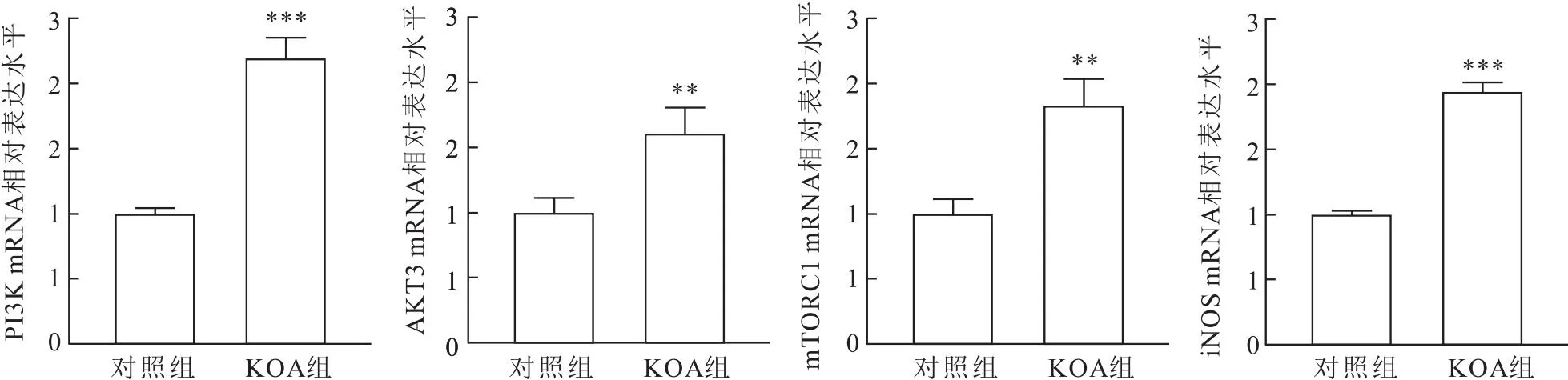
图5 PI3K/AKT/mTOR通路关键因子mRNA相对表达的比较
2.6 KOA滑膜液中PI3K、AKT3、mTOR和iNOS蛋白表达上调Western blot 检测结果显示,与对照组相比,KOA组滑膜液中PI3K/AKT/mTOR通路关键蛋白PI3K、p-PI3K、AKT3、p-AKT3、mTORC1均上调(Z=-2.364、-2.438,t=-6.177,Z=-2.438,t=-7.965,均P<0.01),通路下游iNOS蛋白表达也上调(t=-7.647,P<0.01)(图6)。

图6 两组滑膜液中蛋白相对表达及条带图
3 讨论
滑膜在维持关节软骨内稳态方面起着重要作用,是关节功能正常的重要保障。随着研究的深入,发现[6]滑膜炎伴随KOA的整个过程,滑膜炎有可能是导致KOA发生的重要原因,滑膜炎产生的炎症反应可以直接作用于关节软骨,导致关节软骨结构发生改变,加速关节退变的过程[6]。
巨噬细胞极化介导的滑膜炎导致滑膜增厚并伴有肥大和增生、血管密度增加、炎症细胞浸润(淋巴细胞和巨噬细胞)是KOA的共同特征[8]。早在2015年,Daghestani[9]使用显像剂99mTc-EC20证明KOA患者体内滑膜巨噬细胞极化存在,且其数量与KOA的严重程度和影像学的改变密切相关,通过动物实验也证明巨噬细胞极化可以促进骨关节炎的进展[10],表明巨噬细胞极化与KOA发病密切相关。李兵 等[11]通过关节内注射单碘乙酸溶液诱导OA大鼠模型发现,OA大鼠模型组M1/M2比值明显升高,通过双氯芬酸钠干预促进M2巨噬细胞极化下调M1/M2有利于减轻OA大鼠的疼痛和软骨退化。本研究发现M1型巨噬细胞极化在KOA中占有主要地位,M1/M2比值升高,M1型巨噬细胞极化标记物CD80、CD86阳性率增加,提示M1型巨噬细胞极化介导的滑膜炎很可能是导致KOA软骨退变的主要因素。
PI3K/AKT/mTOR信号轴在细胞增殖与凋亡、转录和迁移过程中发挥关键作用,同时也是巨噬细胞极化的关键因子,活化后可抑制巨噬细胞向M1极化。P13K可被细胞因子、生长因子、激素等细胞外的各种信号激活[12],并与细胞内含有PH结构域的AKT和丙酮酸脱氢酶激酶1(phosphoinositide dependent kinase-1,PDK1)结合,促使PDK1磷酸化AKT蛋白从而导致AKT活化,磷酸化的AKT可激活mTOR,活化的mTORC1激活NF-κB诱导IL-1、IL-6、TNF-α、iNOS过表达,使滑膜产生炎症并诱导M1型巨噬细胞极化,进一步使软骨细胞损伤,导致关节软骨退变及局部炎症级联反应从而导致KOA的发生[13]。其次,活化的mTORC1可促使部分炎症因子如IL-1、IL-6、TNF-α、基质金属蛋白酶作用于巨噬细胞促进M1型巨噬细胞极化,M1型巨噬细胞极化反过来可上调IL-1、IL-6、TNF-α的表达导致关节软骨炎症反应、软骨破坏降解。最后,IL-1、IL-6、TNF-α等的表达会使PI3K/AKT/mTOR通路负向调控mTORC1产生大量的炎症造成软骨退变,软骨中高表达的IL-1、IL-6反过来又会促进M1型巨噬细胞极化[14],使“PI3K/AKT/mTOR通路激活→M1型巨噬细胞极化→炎症反应→PI3K/AKT/mTOR通路激活”始终处于一个循环反应中,最终导致KOA患者关节软骨退变。本研究显示KOA患者滑膜液中PI3K、AKT3和mTORC1表达升高且促炎因子IL-1、IL-6、TNF-α升高,提示PI3K/AKT/mTOR信号通路可能与KOA的滑膜液产生相关,并且可能与滑膜炎、巨噬细胞极化密切相关,这与之前的报道相一致[15]。提示PI3K/AKT/mTOR信号通路可能调控巨噬细胞极化参与OA的发病。
综上所述,本研究表明,在KOA滑膜液中,M1型巨噬细胞极化占据主要地位,M1巨噬细胞极化介导的炎症反应可能是滑膜炎产生的主要原因,同时PI3K/AKT/mTOR信号通路活化可能介导了M1型巨噬细胞极化参与KOA炎症反应。今后的研究中,可以进一步探索是否可以通过阻断PI3K/AKT/mTOR信号通路,抑制M1型巨噬细胞极化,从而减轻滑膜炎,达到治疗KOA的目的。

