HMGB1在三叉神经痛中的作用
沈 莲,吴贝贝,王烈成,王元银
三叉神经痛(trigeminal neuralgia,TN)是一种常见的神经病理性疼痛[1],严重影响患者的生活质量,其发病机制目前仍不明确。临床上治疗TN的方法主要有药物治疗、手术治疗、伽马刀放射治疗、中医治疗等[2],但大多数效果不佳或副作用大。因此,TN的靶向治疗一直是临床上巨大的挑战。高迁移率族蛋白B1(high-mobility group box-1,HMGB1)是一种高度保守的核蛋白,因其在聚丙烯酰胺凝胶电泳中速度快而得名[3]。HMGB1作为一种损伤相关模式分子参与级联反应并成为神经痛的研究热点,目前已在骨癌疼痛及坐骨神经痛中有相关研究[3-4]。HMGB1由胶质细胞或神经元释放后,与Toll样受体4(Toll-like receptor 4,TLR4)结合激活下游核因子κB(nuclear factor kappa-B,NF-κB)通路,进而引起背根神经痛[5]。而HMGB1在TN中研究甚少,该研究通过眶下神经缩窄术构造大鼠TN模型探索HMGB1对TN的作用,以期对TN的靶向治疗提供方向。
1 材料与方法
1.1 材料
1.1.1主要材料和仪器 PCR引物由上海生工生物工程股份有限公司提供;Von Frey毛刷(美国North Coast公司,货号:NC12775);Tissue RNA Purification Kit Plus(上海奕杉生物科技有限公司,货号:RN002plus);PrimeScriptTMRT试剂盒及TB Green Premix Ex TagⅡ(日本TaΚaRa生物科技有限公司,货号:RR047A、RR820A);HMGB1抑制剂Glcyrrhizin(美国MedChemexpress生物科技公司,货号:HY-N0184);SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术有限公司,货号:P0012AC);HMGB1抗体(武汉三鹰生物技术有限公司,货号:10829-1-AP);TLR4抗体、NF-κB p65抗体、NF-κB p-p65抗体(江苏亲科生物研究中心有限公司,货号:AF7017、AF5006、AF2006,);水合氯醛(上海麦克林生化股份科技有限公司,货号:C804539);超微量分光光度计(美国Thermo Scientific公司,型号:NanoDrop 2000/2000c);荧光定量PCR仪(美国ABI公司,型号:9700);高速低温组织研磨仪(武汉赛维尔生物科技有限公司,型号:KZ-III-F)。
1.1.2实验动物 选取体质量200 g左右的成年雄性Sprange-Dawley(SD)大鼠,共50只,维持型饲料饲养,可自由饮水和摄食,饲养间温度25 ℃,12 h昼夜交替。术前3 d对大鼠使用Von-frey毛刷刺激丝进行适应性训练,剔除反应迟钝或敏感大鼠。所需实验动物由安徽医科大学实验动物中心提供,实验遵循动物实验伦理(伦理学批号:LLSC20190705)。
1.2 方法
1.2.1实验分组 将SD大鼠随机分为4组:空白(Sham)组、手术(chronic constriction injury,CCI)组、CCI+生理盐水(normal saline,NS)组及CCI+甘草酸(glcyrrhizin,GL)组。第1部分实验探索HMGB1在TN大鼠三叉神经节(trigeminal ganglion,TG)中的表达及其可能机制,组别为CCI组和Sham组,每组10只。第2部分实验探索HMGB1抑制剂GL对三叉神经痛的影响,组别为CCI组、CCI+NS组及CCI+GL组,每组10只。
1.2.2大鼠模型建立 使用0.1 mg/ml的水合氯醛按每100 g注射0.35 ml的剂量对雄性SD大鼠予以全身麻醉,术区碘伏消毒,CCI组大鼠行眶下神经缩窄术,即大鼠左侧颧弓前1/3下方靠鼻旁做5 mm斜行切口,血管钳钝性分离肌肉和筋膜,用玻璃分针分离出眶下神经,5-0外科线结扎眶下神经,两结扎处线相距约2 mm,松紧度适宜,保证仅眶下神经受压迫,而不阻断血流。用3-0外科线缝合皮肤,术区涂布金霉素眼膏预防感染。Sham组大鼠除眶下神经不结扎,其余处理方式同CCI组。其中CCI+GL组自手术第1天起每天予以50 mg/kg腹腔注射1次GL,连续2周。GL按每100 mg溶于50 ml NS比例配置,混匀,现配现用。CCI+NS组自术后第1天起每天予以等量NS腹腔注射,连续2周。按上述进行实验分组,每组大鼠5只用于机械痛阈测定,剩余大鼠在术后第14天,予以过量水合氯醛处死,收集大鼠术侧TG,-80 ℃冰箱保存,用于后续实验。
1.2.3机械痛阈测定 为了减少干扰因素,测试前先将大鼠置于安静环境中适应0.5 h,在术前1 d及术后第0、2、4、6、8、10、12、14、16、18、20天检测各组大鼠术侧的机械阈值,使用Von-frey毛刷刺激丝由小到大的强度顺序对大鼠进行机械痛阈检测。每个强度的毛刷刺激丝重复10次,每次间隔30 s。大鼠出现如下任一反应称为阳性反应:快速缩头、逃避或攻击、搔抓刺激部位或洗脸的动作。10次刺激中有6次及6次以上阳性反应时,此时毛刷所对应的数值为该只大鼠此时的机械疼痛阈值,其余情况按顺序更换大一号强度刺激丝测定大鼠机械痛阈。
1.2.4实时荧光定量PCR(RT-qPCR)检测TG中HMGB1、TLR4和NF-κB p65 mRNA表达 使用Tissue RNA Purification Κit Plus试剂盒提取mRNA;使用超微量分光光度仪检测样本浓度和纯度,保留A260/A280在1.9~2.0间的样本,使用PrimeScriptTMRT进行cDNA合成,TB Green Premix Ex Taq Ⅱ进行PCR的扩增;荧光定量PCR仪检测TG中HMGB1,TLR4及NF-κB p65的mRNA表达情况,使用2-ΔΔCT计算其相对表达水平。实验所用荧光定量PCR基因引物序列见表1。

表1 qRT-PCR基因引物序列表
1.2.5Western blot检测TG中HMGB1、TLR4和NF-κB p65 及其磷酸化p65(p-p65) 蛋白表达 收集大鼠术侧TG组织,称重后加入RIPA裂解液,配平,置于高速低温组织研磨仪按4 ℃、12 000 r/min研磨15 min,直至组织成匀浆,吸取上清液至EP管中,加入蛋白上样缓冲液,100 ℃加热10 min使蛋白充分变性,-80 ℃冰箱保存。制备凝胶,恒压80 V上样电泳,恒流260 mA转至PVDF膜上,置于5%脱脂奶粉中,室温下摇床封闭2 h。封闭完成后,TBST摇床洗膜5次。一抗稀释后,将PVDF膜置于一抗HMGB1抗体(1∶1 000),TLR4抗体(1∶1 000),NF-κB p65抗体(1∶1 000),NF-κB p-p65抗体(1∶1 000)稀释液中,4 ℃摇床孵育过夜,TBST漂洗PVDF膜,置于二抗稀释液辣根过氧化物酶标记山羊抗兔IgG (1∶1 000)中室温孵育2 h,再次漂洗,配置显影液,曝光成像,使用ImageJ进行图像处理。
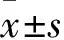
2 结果
2.1 机械痛阈测试结果术前1 d及术后0 d,CCI组与Sham组大鼠的机械阈值差异无统计学意义(t=0.63、0.01,P>0.05)。从术后第2天开始,CCI组大鼠机械痛阈较Sham组降低(t=4.34、6.63、7.36、6.99、8.14、8.75、9.10、9.83、8.30、8.64,均P<0.01);在术后第14天,CCI组大鼠机械疼痛阈值达到最低值(t=7.81,P<0.001);在术后第20天,CCI组大鼠机械痛阈仍处于较低水平,提示大鼠TN模型构造成功。见图1。
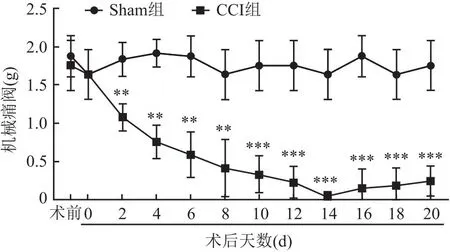
图1 Sham组和CCI组大鼠不同时间点术侧机械痛阈的比较
2.2 HMGB1在Sham组及CCI组大鼠TG中mRNA和蛋白表达量的变化RT-qPCR和Western blot检测结果显示,术后第14天,CCI组大鼠术侧TG中HMGB1的mRNA和蛋白表达量较Sham组升高(t=11.42、3.37,均P<0.05)。见图2。

图2 Sham组和CCI组大鼠术后14 d术侧TG中HMGB1的mRNA和蛋白表达的比较
2.3 TLR4在Sham组及CCI组大鼠TG中mRNA和蛋白表达量的变化RT-qPCR和Western blot检测结果显示,术后第14天,CCI组大鼠术侧TG中TLR4的mRNA和蛋白的表达量较Sham组升高(t=31.07、10.61,均P<0.01)。见图3。

图3 Sham组和CCI组大鼠术后14 d术侧TG中TLR4的mRNA和蛋白表达的比较
2.4 NF-κB p65和p-p65在Sham组及CCI组大鼠TG中mRNA和蛋白表达量的变化RT-qPCR结果显示,术后第14天CCI组大鼠术侧TG中p65的mRNA的表达量较Sham组升高(t=4.43,P<0.05)。见图4A。Western blot结果显示术后第14天,CCI组大鼠术侧TG中p65的蛋白表达量较Sham组差异无统计学意义(t=0.11,P>0.05);CCI组大鼠术侧TG中p-p65的蛋白表达量较Sham组升高(t=10.81,P<0.01)。见图4B。
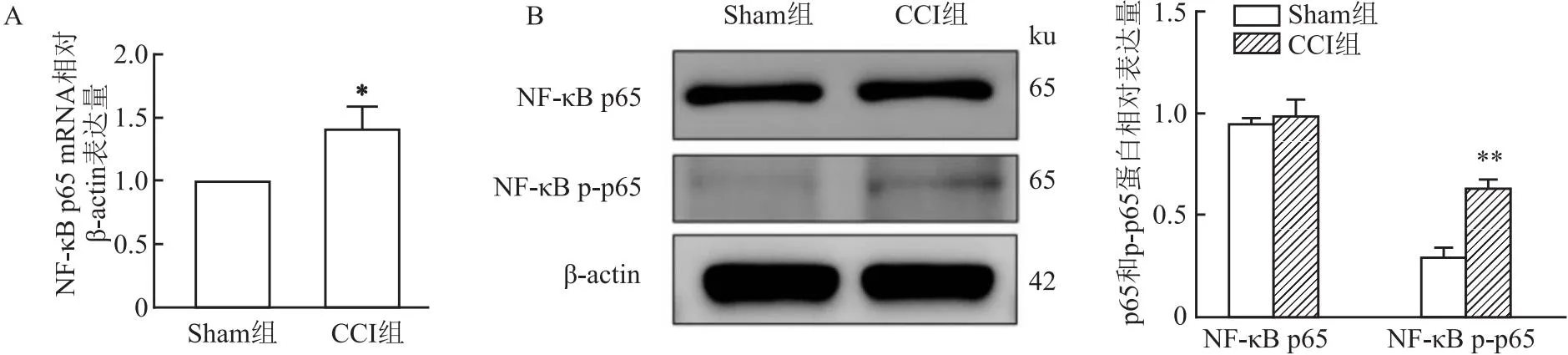
图4 Sham组和CCI组大鼠术后14 d术侧TG中NF-κB p65及p-p65的mRNA和蛋白表达的比较
2.5 HMGB1抑制剂GL对大鼠术侧机械痛阈的影响在术后的第0~4天,三组大鼠机械痛阈均下降且差异无统计学意义(P>0.05)。在术后的第6天开始,CCI+GL组大鼠术侧机械阈值开始高于CCI组和CCI+NS组(tCCI=3.42,tCCI+NS=3.57,均P<0.05);CCI组与CCI+NS组大鼠术侧机械痛阈差异无统计学意义。在术后第10天,CCI+GL组大鼠术侧机械痛阈开始升高,而CCI组与CCI+NS组仍继续下降(tCCI=4.03、4.92、5.40、6.42、6.82、6.55,tCCI+NS=4.51、4.92、6.11、6.34、5.78、5.63,均P<0.01)。见图5。行为测试结果表明,抑制HMGB1表达可以提高大鼠TN模型中术侧的机械痛阈。
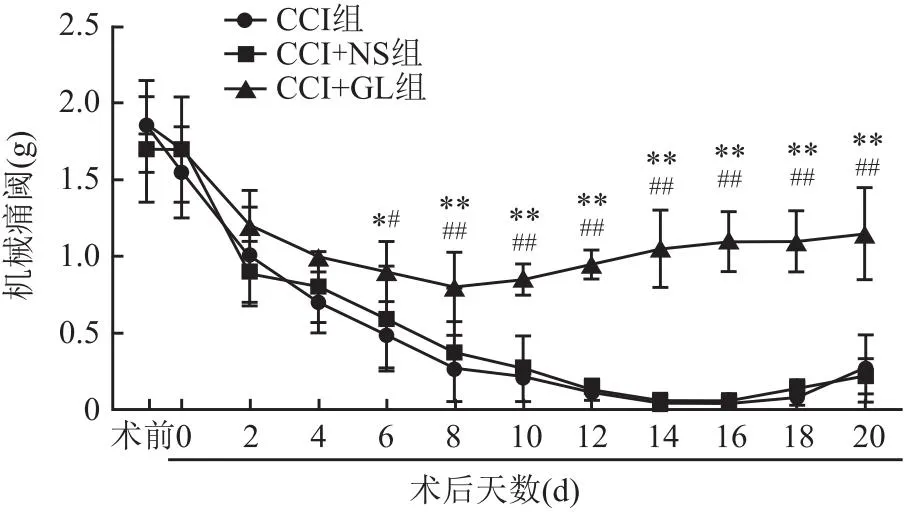
图5 各组大鼠的术侧机械阈值的比较
2.6 GL对HMGB1的mRNA和蛋白表达量的影响RT-qPCR和Western blot检测结果显示,与CCI组及CCI+NS组相比,在术后第14天,CCI+GL组大鼠术侧TG中HMGB1的mRNA和蛋白表达量降低(tCCI=4.53、33.13,tCCI+NS=4.83、6.60,均P<0.01)。见图6。CCI组与CCI+NS组大鼠术侧TG中HMGB1表达差异无统计学意义(t=1.74、1.93,P>0.05)。表明GL成功抑制大鼠HMGB1的mRNA和蛋白表达。

图6 各组大鼠术后14 d术侧TG中HMGB1的mRNA和蛋白表达的比较
2.7 GL对TLR4的mRNA和蛋白表达量的影响RT-qPCR和Western blot检测结果显示,与CCI组和CCI+NS组相比,在术后第14天,CCI+GL组大鼠术侧TG中TLR4的mRNA和蛋白表达量降低(tCCI=25.23、17.60,tCCI+NS=4.83、23.99,均P<0.01)。CCI组与CCI+NS组大鼠术侧TG中TLR4的mRNA和蛋白表达量差异无统计学意义(t=0.03、2.76,均P>0.05)。见图7。
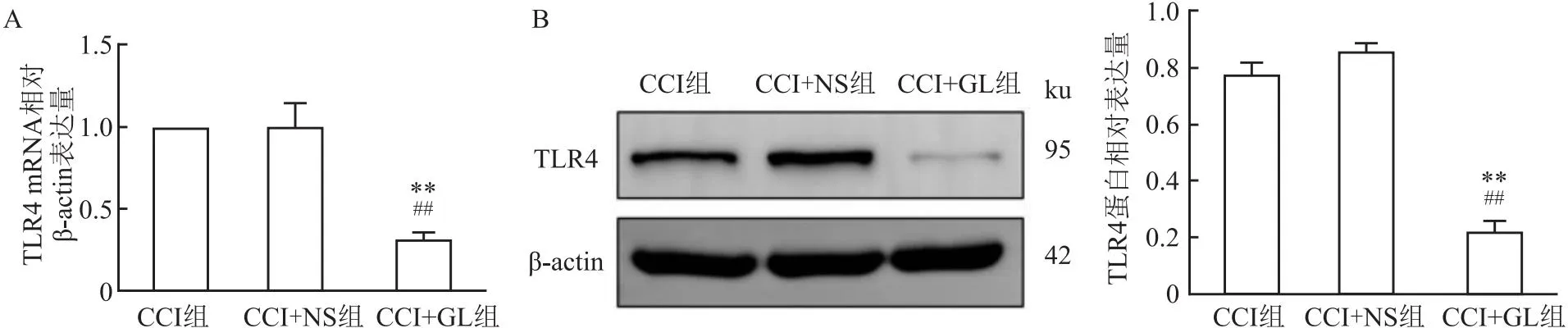
图7 各组大鼠术后14 d术侧TG中TLR4的mRNA和蛋白表达的比较
2.8 GL对NF-κB p65及p-p65的mRNA和蛋白表达量的影响RT-qPCR结果显示,与CCI组及CCI+NS组相比,在术后第14天,CCI+GL组大鼠术侧TG中p65 mRNA表达量降低(tCCI=14.48,tCCI+NS=3.91,均P<0.05)。见图8A。Western blot检测结果显示,在术后第14天,CCI+GL组大鼠术侧TG中p-p65蛋白表达量降低(tCCI=30.66,tCCI+NS
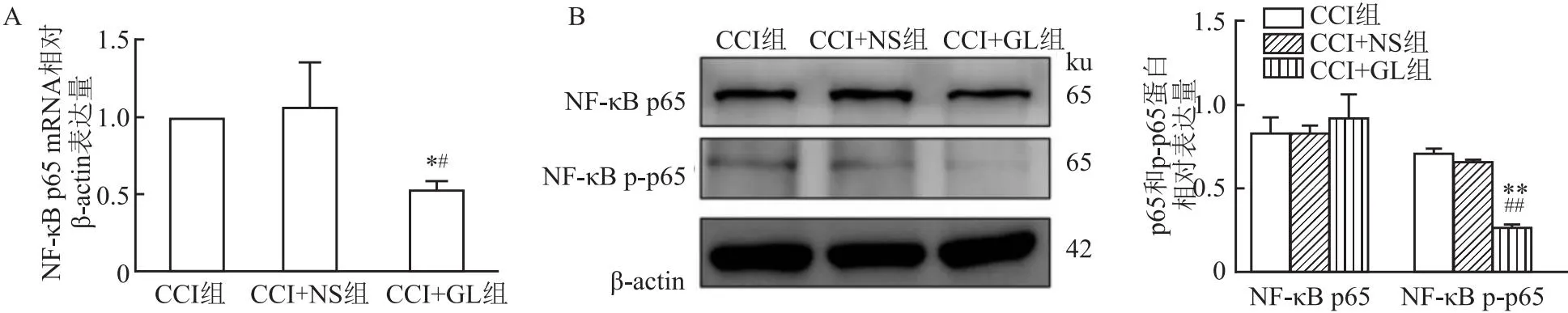
图8 各组大鼠的术侧TG中NF-κB p65及p-p65的mRNA和蛋白表达的比较
=35.46,均P<0.01),而p65蛋白无统计学差异;CCI组与CCI+NS组大鼠术侧TG中p-p65蛋白表达差异无统计学意义(t=0.29,P>0.05)。见图8B。
3 讨论
目前原发性TN发病机制不明确,核磁共振影像学显示三叉神经受到压迫性损伤,因此推测三叉神经可能由于受到血管压迫,引起神经脱髓鞘改变,进而引起神经过度兴奋从而导致神经痛[6]。本研究采用大鼠眶下神经缩窄术模拟神经压迫性损伤,构造TN大鼠疼痛模型,行为学测试[7]显示经眶下神经缩窄术后大鼠术侧机械阈值降低,提示造模成功。
HMGB1是HMG蛋白中研究最广泛的蛋白之一,它由带正电荷的A盒和B盒以及带负电荷的酸性末端组成,其氨基酸残基89~108段可与TLR4结合,促进炎症反应和基因转录。HMGB1在受损的脊髓背角和周围神经疼痛模型中均上调,提示HMGB1可能在慢性疼痛的发生和维持中起到至关重要的作用[5]。研究[8]显示在空白组小鼠鞘内注射重组HMGB1抗体可引起疼痛超敏反应,而坐骨神经结扎组小鼠给予抗HMGB1抗体鞘内注射可显著逆转部分机械痛觉超敏反应。本研究中,眶下神经缩窄术组大鼠机械痛阈升高,同时术侧TG中HMGB1的mRNA和蛋白表达量均升高,与前人研究结果一致[9]。GL是甘草的根和茎的主要活性成分,已广泛用于肝炎、肿瘤等疾病的治疗。GL具有抗炎护肝等作用,是一种天然的HMGB1抑制剂[10]。研究[11]显示,在脂多糖激活的BV2小胶质细胞中HMGB1表达量升高,而GL可以抑制HMGB1表达量升高。在本研究中,连续两周腹腔注射HMGB1抑制剂GL后,大鼠术侧机械痛阈虽然在术后的前8 d降低,但较对照组降低幅度减缓,且仍高于对照组,同时从第10天开始,机械痛阈上升。以上结果提示,HMGB1与TN有关,抑制HMGB1可以缓解TN的疼痛。
TLR4是Toll样受体(TLRs)家族之一,在星形胶质细胞和小胶质细胞等多种细胞表面表达,与神经痛发生密切相关[12]。当损伤的神经元或者胶质细胞将HMGB1释放到细胞外后,可与TLR4结合,启动炎症转导通路,激活NF-κB通路,核因子κB磷酸化入核增加[13]。在胶原抗体诱导的小鼠关节炎模型中,TLR4基因敲除小鼠鞘内注射重组HMGB1后没有出现明显的机械痛阈升高[14]。本研究分子学检测结果表明,GL可以使得HMGB1、TLR4、NF-κB p65磷酸化降低。因此推测HMGB1可能通过TLR4/NF-κB通路调控疼痛的发展。
综上所述,大鼠TN模型中HMGB1上调,GL可以抑制HMGB1上调,HMGB1可能通过TLR4/NF-κB调控TN。因此,HMGB1可能是治疗TN的一个潜在的分子靶点,后续将继续探索HMGB1的致痛机制,为TN的治疗提供新的思路。

