胆盐水解酶的研究现状
岳婷婷,侯红漫
(大连工业大学生物与食品工程学院,辽宁大连 116034)
胆盐水解酶的研究现状
岳婷婷,侯红漫
(大连工业大学生物与食品工程学院,辽宁大连 116034)
阐述了胆盐水解酶(BSH)的功能、特性以及对宿主微生物产生的影响;介绍了胆盐水解酶基因、基因调节及同系物;讨论了胆盐水解酶未来研究方向和应用的前景。
胆盐水解酶;胆盐水解酶基因;次级胆汁酸
0 引 言
众所周之,人体血清胆固醇含量过高是引发动脉粥样硬化和心脑血管疾病的重要因素之一。经常食用含有益生菌的发酵制品有助于降低血清胆固醇,选择在胃肠道中有效的发挥降胆固醇作用的益生菌菌株是当前重要的研究课题之一。
胆盐水解酶(Bile Salt Hydrolase,BSH)是微生物生长、繁殖过程中产生的一种代谢产物。该酶能水解结合胆盐形成氨基酸和游离胆汁酸,从而降低血清中胆固醇含量。本文介绍了有关胆盐水解酶的催化机理,探索了胆盐水解酶产生的生态意义,简要阐述了胆盐水解酶对人类生理上的影响,对今后胆盐水解酶的研究工作和合理应用提供一些建议和帮助。
1 胆盐水解酶特性
1.1 胆盐水解酶降胆固醇概述
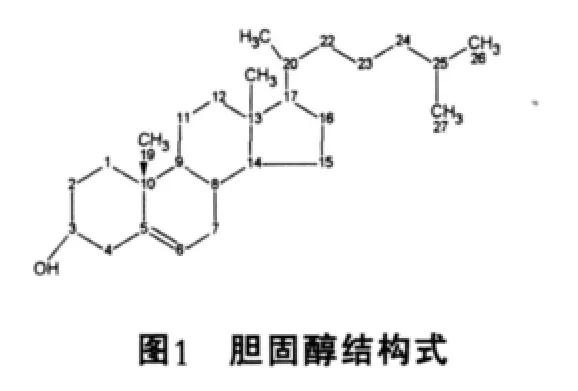
胆固醇是一种环戊烷多氢菲核27碳化合物,分子结构式如(图1)所示。正常人血清胆固醇含量为1.50~2.50 g/L。在肝脏中,胆固醇的主要去路是转变成胆酸。胆酸衍生的甘氨胆酸和牛磺胆酸是人类的主要胆汁酸,具有促进脂类的消化与吸收和抑制胆汁中胆固醇的析出的作用。
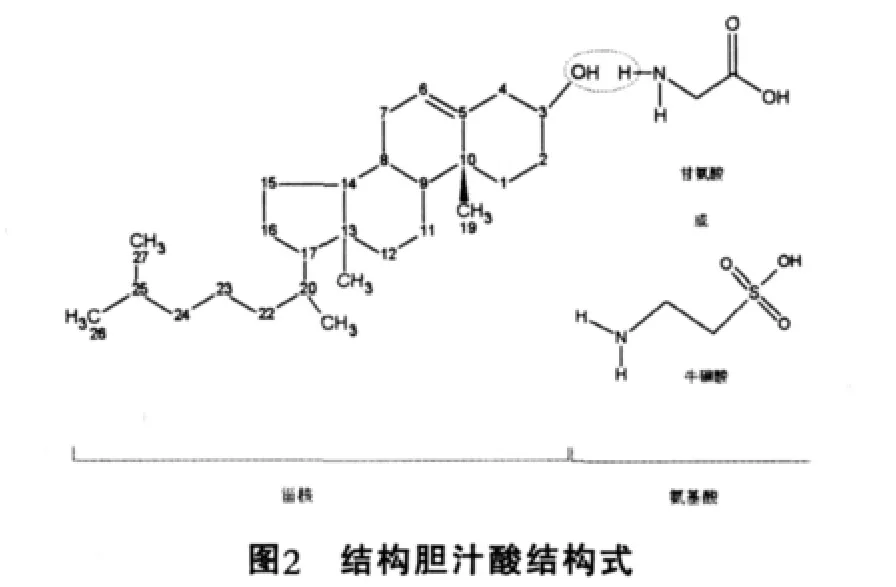
胆汁酸按其结构可分为两类:一类是游离胆汁酸,包括胆酸,脱氧胆酸,鹅脱氧胆酸和石胆酸;另一类是上述胆汁酸分别与甘氨酸和牛磺酸相结合的产物,成为结合胆酸(图2),主要是甘氨胆酸,牛磺胆酸,甘氨鹅脱氧胆酸和牛磺鹅脱氧胆酸。从来源分可分为两类:由肝细胞合成的胆汁酸称为初级胆汁酸,包括胆酸,鹅脱氧胆酸及其与甘氨酸和牛磺酸的结合产物;初级胆汁酸发生7α-脱羟基作用,形成脱氧胆酸和石胆酸称为次级胆汁酸(图3)。
胆盐水解酶是微生物在生长代谢过程中的代谢产物,它可以水解结合胆盐形成游离胆汁酸和氨基酸,游离胆汁酸与胆固醇形成复合物共沉淀下来,从而降低胆固醇含量(图4)。大量研究表明,BSH具有降低血清中胆固醇的作用。Verstrate认为乳酸菌的高胆盐水解酶活力这一特征在降胆固醇含量方面起着重要作用。Ahn认为乳酸菌的BSH在降低胆固醇方面具有重要作用[1]。

1.2 胆盐水解酶特性
胆盐水解酶已经从很多微生物中提取并鉴定(表1),通常为胞内酶,对氧不敏感,最适pH表现为弱酸性(一般为5~6)。胆盐水解酶催化结合胆盐的水解,胆盐的解离是指酶水解C-24 N末端与氨基酸结合的酰胺键。这个反应是底物限制性反应并在大肠中完成。胆盐水解酶(BSH)属于胆酰甘氨酸水解酶系,与球形杆菌青霉素V酰胺酶有一些共同的保守性氨基酸的活性位点(Cys2,Arg18,Asp21,Asn175和Arg228)和高度相似的氨基酸序列。青霉素V酰胺酶的Tyr82与BSH Asn82的保守性很可能是因为它们各自底物所需求的空间不同所导致的[2]。结构显示Cys2残基位于N-末端酰胺键亲核攻击的位点上。长双歧杆菌和双歧杆菌的BSH Cys2残基的定向诱变和一些BSH的巯基抑制作用都说明了这个残基在催化中的重要性[3]。BSH氨基酸顺序的排列显示了在所有BSH的Cys2残基都是保守的。广泛的底物特异性有一个潜在的功能,产气荚膜杆菌胆盐水解酶基因编码产物(CBAH-1)的底物结构域能结合缺少保守性的残基,而这些残基可以通过与其他BSH氨基酸多重序列比对进行预测。 在产气荚膜杆菌的CBAH-1中固醇官能团和羧基上的氢键一样最初是通过疏水性相互作用相连接的。CBAH-1的结晶结构并未显示出对牛磺/甘氨官能团特异识别,但在一些BSH的动力学数据表明轭合物对底物特异性很重要(表1)。因此,对不同菌种的BSH进行额外的结晶化和定向诱变(最好对Cys2的诱变)对解释底物特异性的动力学观测是非常有帮助的[4]。
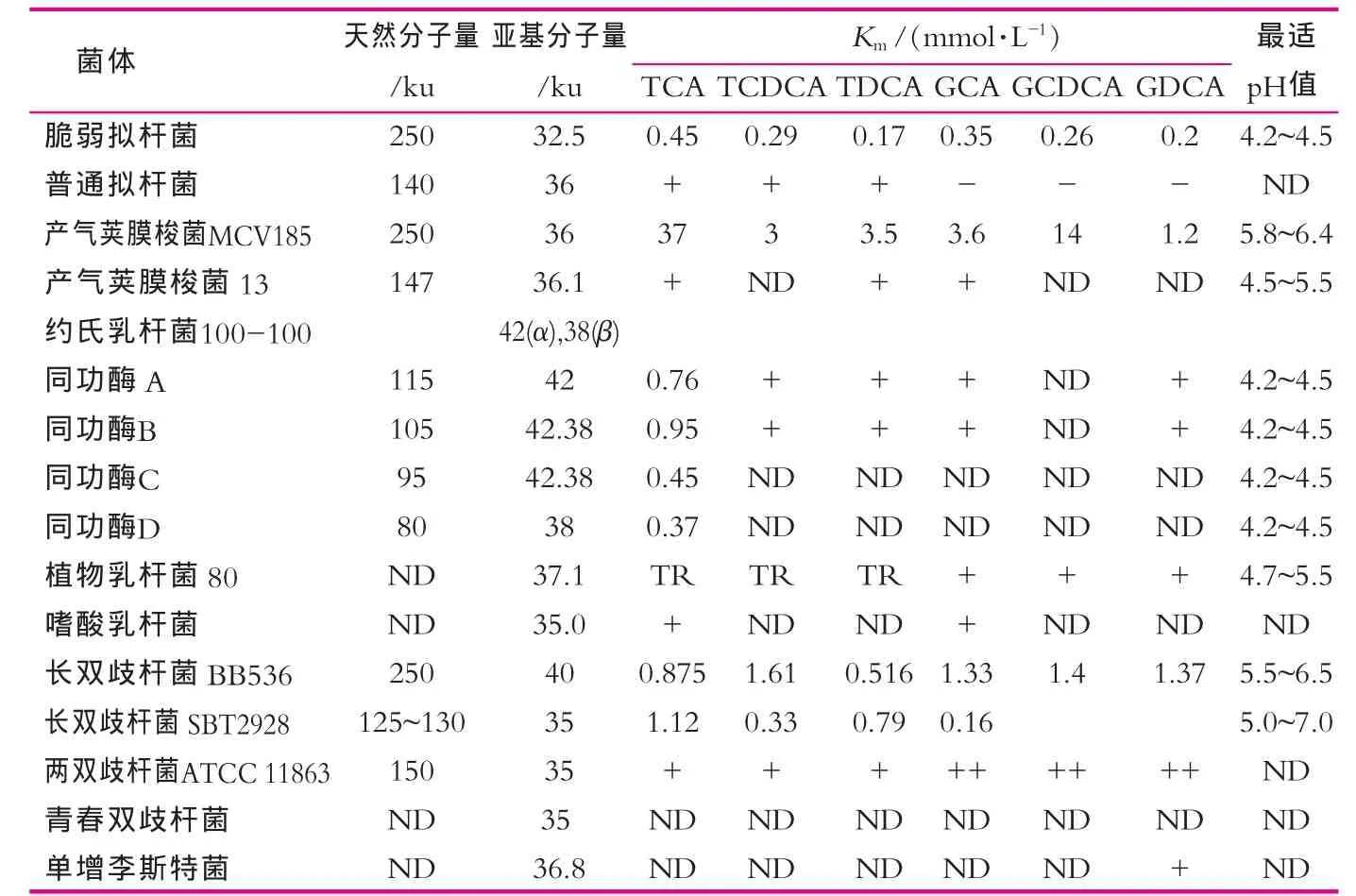
表1 人类肠细菌BSH特性
1.3 胆盐水解酶生产菌
乳酸杆菌,双歧杆菌,肠道球菌,梭状芽孢杆菌和拟杆菌属均能检测到BSH活性。乳酸杆菌和双歧杆菌为益生菌;肠道球菌,梭状芽孢杆菌和拟杆菌属是也是肠道内的共生菌群。迄今为止,在缺少胆盐的环境下生长的细菌(如乳酸乳球菌和嗜热链球菌)中还检测到有活性的BSH[5,6]。除了拟杆菌属的两株菌之外,其余所有的BSH阳性菌均是革兰氏阳性菌。其余所有肠道内革兰氏阴性菌检测发现,既没有BSH活性,而且基因也不具有bsh同源性[7]。
革兰氏阳性肠道致病菌单增李斯特菌不是正常的肠道菌,但具有BSH活性[6]。有1%~10%的人体内有单增李斯特菌,但并没有病症的出现,所以推断该菌是界于致病菌和共生菌之间的[8]。粪肠球菌是人类肠道内的正常菌群,它是一种条件性致病菌,在致病基因片段上发现bsh同系物(EF0040,AAM75246)[9],但是这个基因片段的功能特性还尚未清楚。麦芽黄单胞菌是一种革兰氏阴性条件病原体,它能引起许多疾病,但是大多数患者能通过呼吸系统的作用自然康复。Dean等从该菌中分离纯化出一种具有胆盐水解活性的蛋白质[10],N-末端序列显示该蛋白质与其他特性BSH并不一样。它可能不是“真”的BSH,它的缺乏bsh同源性将会给BSH蛋白家族带来较大的分歧。
2 胆盐水解酶对菌体的意义
BSH可以提高高等动物下胃肠道菌体的群集。BSH的生理学意义还没有完全的了解,而且在不同的种属间也会存在差异。有人推测胆盐的解离可能是一种解毒机制。De Smet等发现在植物乳杆菌发现甘氨酸结合胆盐的解离率明显高于牛磺酸结合胆盐。人类肠道内乳酸菌分泌的BSH通常对甘氨酸轭合物有较高的亲和力[11]。体外实验显示,在各种pH值条件下牛磺氨酸结合胆盐对细菌细胞的毒害都很微弱,而甘氨酸结合胆盐在酸性pH值条件下对细菌细胞的毒害很强。因此,在低pH值条件下(如胆汁进入十二指肠,胃酸回流的部位,乳酸菌作用下的肠道环境)BSH降低甘氨酸结合胆盐的毒害性的作用就更加重要[12]。
病原体抵抗胆盐毒性的办法就是移居在肠道内。近期,在单增李斯特菌的BSH发现一种异常的致病因子。经过染色体组比对分析,在与单增李斯特菌非常相似的无害李斯特菌中发现缺失了一种bsh基因[13]。这个基因被PrfA正向调节,PrfA是单增李斯特菌中一种为数众多的毒性基因的转录激活因子。这个bsh基因的缺失导致在或体内对胆盐的抗性的减少和侵染力明显减少。这些结果说明了BSH活性对于李斯特菌在活体内的存活和在肠道和肝的感染力是非常重要的。单增李斯特菌BSH活性能提高存活力和毒力的机制还尚不清楚。
另外,解离可能是为一些菌种提供细胞内的碳,氮和硫的一种途径。这已经在拟杆菌属和长双歧杆菌中得到了证实[14,2]。事实上,长双歧杆菌的bsh基因与编码谷氨酰胺合成腺苷酰基转移酶(glnE)的基因发生共转录,glnE是氮调节酶系的组成部分。基于这个观点,结合胆汁酸的水解提供了氨基氮,也为表面上看似生理上没有联系的基因的协同调控提供了一个可能的解释[2]。牛磺酸的利用也是非常广泛的,可以在有氧和无氧条件下作为能源物质[15]。甘氨酸可以作为特定梭菌属Stickland反应的能源物质[16]。Stickland反应是一种氨基酸发酵的形式,就是一个氨基酸提供电子被另一个不同的氨基酸获得。另一种假说就是BSH是一种去垢剂,它可以撞击蛋白质,微生物在有刺激的外界环境下可以存活[17]。但是De Smet等在用不同的去垢剂培养乳酸菌后对这个假说并没有得到证实[11]。
BSH在肠道菌的广泛分布加上它广泛的底物特异性,遗传调节,和特定菌株的多重亚基的存在,使得在结合胆汁酸水解对菌体本身的生理益处出现了不一致的报道。BSH帮助哺乳动物肠道内细菌的群集决定性机制,尤其是关于菌体发病机理的研究将会受到广泛的关注。
3 胆盐水解酶基因,基因调节及同系物
3.1 胆盐水解酶基因及基因调节
在产气荚膜杆菌,植物乳杆菌,约氏乳杆菌,两歧双歧杆菌,长双歧杆菌,和单增李斯特菌中克隆出编码BSH的基因,并在大肠杆菌中得到表达。最近通过微生物染色体组分析已经鉴定出同系物并推测出bsh基因。编码BSH的基因和基因调节因种属的不同而不同。目前已经报道了植物乳杆菌,约氏乳杆菌,单增李斯特菌和两歧双歧杆菌中单顺反子的BSH基因。一个从产气荚膜杆菌克隆出的编码BSH(CBAH-1)的基因片段在大小和氨基酸序列上与从另一株不同的产气荚膜杆菌有着明显的不同。编码CBAH-1的基因的失活会导致BSH活性的部分减少 (在野生型中86%BSH活性),表明了产气荚膜杆菌bsh基因的多重性。此外,CBAH-1是以有活性的同源四聚体存在的[18]。尽管目前对从产气荚膜杆菌获得的bsh基因的基因组和基因调节还不明确,但以上这些观察,加上对细胞内和细胞外BSH的观测,为多重亚基提供了更多的证据。在约氏乳杆菌和嗜酸乳杆菌已经测出有关胆盐解离的多顺反子操纵子编码的3个基因(cbsT1,cbsT2,cbsHβ),cbsT1和cbsT2编码牛磺胆酸盐/CA主要超家族成员的反向运输蛋白,而cbsHβ则编码BSH β-亚型[19]。另外,在约氏乳杆菌100-100中发现了一种未知细胞外因子,它可以激活BSH的活性并可以在停滞期时促进结合胆盐的吸收[20]。
3.2 益生菌bsh基因同系物
根据益生菌细菌的基因序列数据库,在所有的肠道菌中鉴定出了bsh同系物(表2)。值得注意的是,有些菌(植物乳杆菌WCFS1)具有一种以上的不同的bsh同系物。这对之后的BSH同系物的多重性的讨论有重要的意义。所有的菌种的序列分析显示bsh区域在染色体上的位置是不同的[21]。
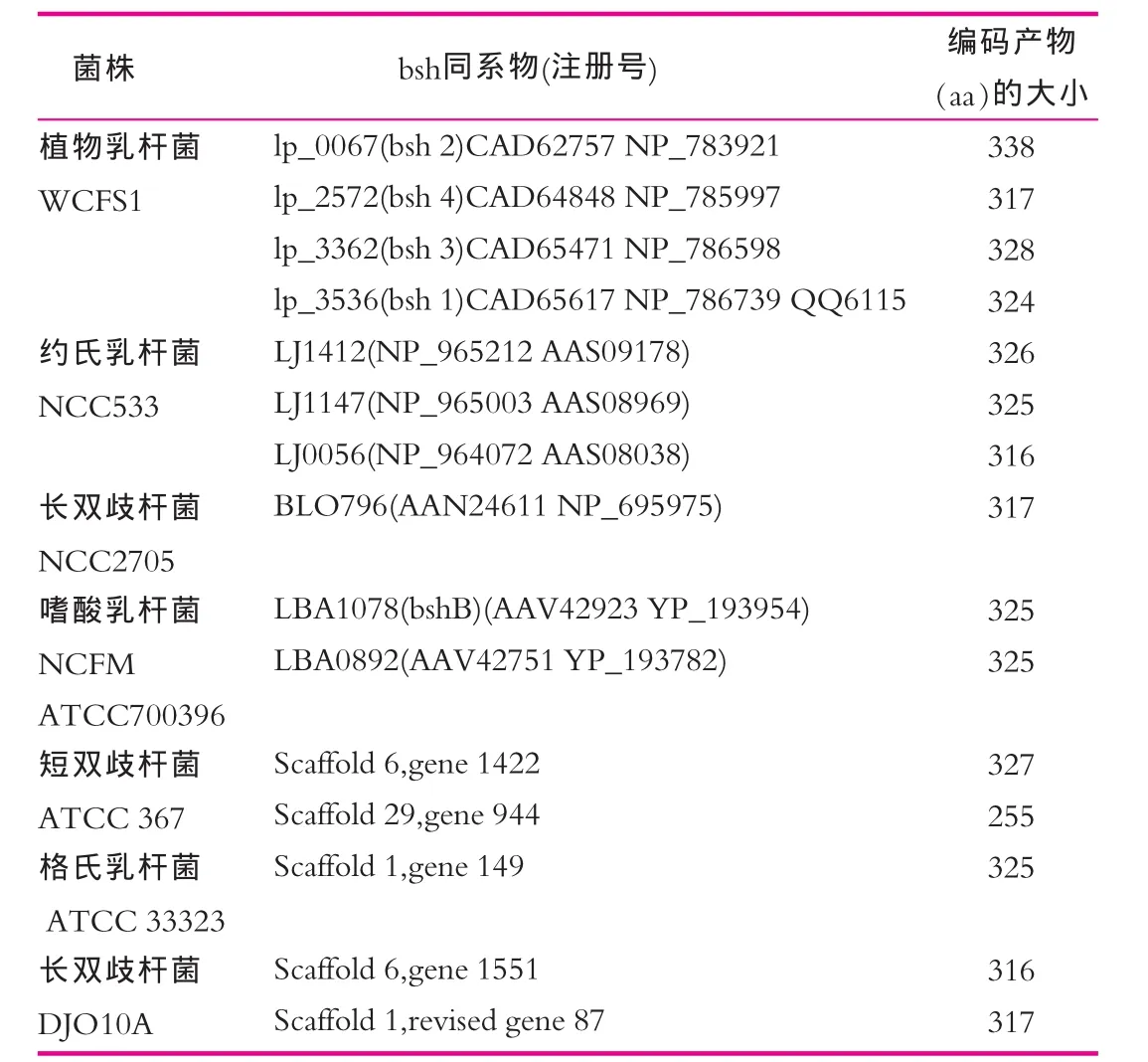
表2 益生菌中bsh基因同系物[7]
3.3 bsh基因的平行传递
在一些独自隔离生长的菌种中发现了不同的BSH表型,从中可以推断bsh基因可以后天获得。Elkin等人对嗜酸乳杆菌KS-13和约氏乳杆菌100-100进行了研究,发现他们的bsh基因与其周围的基因序列相比,在bsh上几乎没有侧翼[22]。另外,约氏乳杆菌100-100 bsh基因下游编码一组内含子组II蛋白,这类蛋白质具有反转录酶的活性,具有成熟酶,核酸内切酶的功能,还可以是cDNA更容易移动和连接到基因组中去。内含子组II蛋白通常会连接在可动的遗传因子上,进而bsh基因的平行传递。嗜酸乳杆菌NCFM完全基因组序列的测定揭示了这个菌种具有两种bsh基因(bshA,bshB),这两种基因各自编码的蛋白的相似性确远远低于其他乳酸菌的BSH,说明这两个基因的来源是不同的[23]。
单增李斯特菌的bsh基因在非致病菌无害李斯特菌中并没有发现,而侧翼区两者的组成都是相同的。另外,单增李斯特菌的bsh基因的G+C含量比相邻的基因低(36%:38~41%),但是同植物乳杆菌bsh基因G+C含量相近,而且编码的蛋白与乳酸杆菌的BSH有着高度的同源性(有67%的同一性)[6]。这些观察加上在生命循环中与乳酸杆菌享有相同的微环境(肠道,衰弱的机体,食物和蔬菜),有力的表明了李斯特菌的基因很可能是从乳酸杆菌中获得的。
还有值得注意的是长双歧杆菌SBT2928中bsh基因的侧翼是反向重复序列,这个反向重复序列可能起着基因的平行传递的作用[2]。Kim等研究表明bsh基因在所有双岐杆菌属测试菌株中都显示了高度的保守性,并且bsh基因的G+C含量反映了基因组的所有G+C含量。目前为止,并没有有关其他高G+C含量革兰阳性菌的BSH活性的相关报道,但在所有的双岐杆菌中均发现了BSH活性,说明在双岐杆菌属基因组中bsh基因很可能是一个平行进化同源基因[24]。
综上所述,BSH存在于胃肠道环境下所有的双岐杆菌属和乳酸杆菌中,但这bsh基因也可被其他肠道菌从这些菌中获得(如单增李斯特菌)。
4 胆盐水解酶对人体的影响
血清中胆固醇水平增高是诱发冠心病、动脉粥样硬化等心血管疾病的重要危险因子。口服益生菌能显著降低血清中胆固醇水平达22%~33%或防止高脂肪喂小鼠的血清胆固醇水平的增高。这种降胆固醇作用可部分归功于BSH活性。BSH水解胆盐从而降低胆固醇水平,但是水解产物却可能产生对人体不利的影响。
4.1 牛磺酸,硫化氢和结肠癌
胆汁酸结合甘氨酸和牛磺酸可以做为微生物新陈代谢的底物。和甘氨酸不一样,牛磺酸含有酸性硫酸基,水解后一部分被解离,一部分异化生成硫化氢[25,26]。硫化氢具有较高的毒性并且能加速结肠细胞的更新[27]。还能抑制结肠细胞丁酸盐的代谢,而丁酸盐是肠道内关键的营养物质和细胞更新的调节者[27]。饮食较多肉类则胆汁酸中的牛磺酸轭合物的水平和结肠内产生的硫化氢会明显增高[28]。
4.2 次级胆汁酸与疾病
在人类的排泄物中,次级胆汁酸(脱氧胆酸和石胆酸)含量是相对较高的。因此,在人体结肠细菌胆盐的生物转化是非常重要的。7α-脱羟基作用只发生在游离胆汁酸上。所以肠细菌起7α-脱羟基作用的一个前提就是通过BSH将甘氨酸/牛磺酸结合胆汁酸水解。
血清,胆汁和粪便中高含量的脱氧胆酸会增加患胆结石和结肠癌疾病的危险。排泄物中胆酸7α-脱羟基作用的菌量增多会使胆汁中脱氧胆酸的含量升高,这是胆结石病人的一个症状。使用抗生素可以明显减少这种病人排泄物中胆酸7α-脱羟基作用菌,减少胆汁中的脱氧胆酸,降低胆汁中的胆固醇饱和指数[28]。此外,胆汁中过量的脱氧胆酸会减少胆固醇结晶的成核时间[33]。多数的动物实验表明脱氧胆酸是致癌作用的启动子。还有一些研究者争论胆汁酸在人体内可能会使DNA损坏成为致癌物[30]。而石胆酸是一种很好的维生素D受体的激活剂。肠的表皮细胞内这个受体的激活可以激活基因使石胆酸代谢[31]。这可能就是肠道表皮细胞限制石胆酸毒性的保护机制。
益生菌中的BSH活性是否是人们所期待的?综上所述,有力的说明了微生物BSH具有解毒作用,可以提高肠道存活率。BSH活性可以最大程度的提高益生菌在宿主肠道环境中的存活率,同时也提高了益生菌对人体的有利效应,这个结果是人们所期待的。
胆盐的解离会对宿主带来一些负面的影响(如前描述),关于BSH-阳性益生菌充当药物的安全性越来越受到人们的关注。大部分益生菌没有脱羟基作用来解离胆盐的能力,所以大部分益生菌产生的有活性的BSH产物被解离和随粪便排出(因人结肠pH值和肠道通过时间的不同而不同)[5,32]。另外有研究表明,防止肠道内其他细菌作用而使解离产物进一步修饰是有可能的(梭状芽胞杆菌和真细菌类两种菌株具有脱羟基活性)。首先,Jones等将一株BSH阳性菌植物乳杆菌包埋在人工膜中来水解胆盐,实验表明微囊包埋菌株可以有效的防止生理环境下高浓度胆盐对菌株的破坏,水解产物也包在膜里[33]。第二,Kurdi等人的研究揭示了在肠道内BSH作用胆盐水解产物为胆汁酸,主要为游离胆汁酸,只要给双岐杆菌属和乳酸菌菌株提供能量,游离胆汁酸就会积累。大量的积累会加强细胞外pH值的降低,表明肠道pH值的降低因子是乳酸杆菌在体内作用产生胆汁酸积累[34]。
综上所述,BSH活性对益生菌在肠道环境下生存提供了有利的条件。菌株的微胶囊化,淘汰没有对未解离胆盐进一步修饰功能和在医药方面产生副作用的菌株,都是BSH活性研究的方面。
5 展 望
未来的研究中为了更好的了解BSH的功能,要对高产胆盐水解酶益生菌进行合理的选择,虽然已明确BSH能明显的促进菌株在肠道内对胆盐的耐受性,提高存活率和持久性,还应进一步确定胆盐水解酶在胃肠道微生物中所发挥的具体作用;研究利用基因工程技术,更简单、快速的找到高产BSH的益生菌株;研究利用胆盐水解活性菌株给药的方法,来控制血清胆固醇也是非常令人期待的。食用含有益生菌的食物的生物方法比其他降胆固醇的方法更天然,更会被现代的健康理念所接受。
[1]王玉文.开菲尔源干酪乳杆菌产胆盐水解酶的研究[D].中国农业大学,2006.
[2]TANAKA H,HASLUBA H,KOK J,et al.Bile Salt Hydrolase of Bifidobacterium longum:Biochermical and Genetic Characterization[J].Appl Environ Microbiol,2000,66:2502-2512.
[3]ELKINS C A,MOSER S A,SAVAGE D C.Genes Encoding Bile Salt Hydrolases and Conjugated Bile Salt Transporters in Lactobacillus Johnsonii 100-100 and Other Lactobacillus species[J].Microbiology,2001,147:3403-3412.
[4]JASON M RIDLON,DAE-JOONG KANG,PHILLIP B HYLEMON.Bile Salt Biotransformations by Human Intestinal Bacteria[J].J Lipid Research,47:241-259.
[5]KIM G B,LIM Y S,BAEK Y J,et al.Deconjugation of Bile Salts by Lactobacillus acidophilus[J].Int Daity J,2003,13:303-311.
[6]GAHAN C G M,HILL C.The Contribution of Three Bile-associated loci(bsh,pva,and btlB)to Gastrointestinal Persistence and Bile Tolerance of Listeria monocytogenes[J].Infect Immun,2005,73:894-904.
[7]BEGLEY MAIRE,HILL COLIN G M,GAHAN CORMAC.Bile Salt Hydrolase Activity in Probiotics[J].American Society for Microbiology,2006,72(3),1729-1738.
[8]CABANES D,DEHOUX P,LECUIT M,et al.Listeria monocutogenes Bile Salt Hydrolase is a PrfA-regulated Virulence Factor Involved in the Intestinal and Hepatic Phases of Listeriosis[J].Mol Microbiol,2002,45:1095-1106.
[9]BAGHDAYAN A S,GILMORE M S..Modulation of Virulence Within a Pathogenicity Island in Vancomycin-resistant[J].Enterococcus faecalis Nature,2002,417:746-750.
[10]DEAN,M CERVELLATI,CASANOVA E,et al.Characterization of Cholylglycine Hydrolase From a Bile-adapted Strain of Xanthomonas maltophilia and its Application for Quantitative Hydrolysis of Conjugated Bile Salts[J].Appl Environ Microbiol,2002,68:3126-3128.
[11]DE SMET,L VAN HOORDE,M VANDE WOESTYNE,et al.Significance of Bile Salt Hydrolytic Activities of Lactobacilli[J].J Appl Microbiology,1995,79:292-301.
[12]牛治霞,刘恩梅,李晓东等.益生菌中胆盐水解酶(BSH)研究进展[J].中国乳品工业,2007,35(9):35-39
[13]GLASER P,FRANGEUL L,BUCHRIESER C,et al.Comparative Genomics of Listeria species[J].Science,2001,294:849-852.
[14]VAN ELDERE J,CELIS P,DE PAUW G,et al.Tauroconjugation of Cholic Acid Stimulates 7α-dehydroxylation by Fecal bacteria[J].Appl Environ Microbiol,1996,62(2):656-661.
[15]COOK A M,DENGER K.Dissimilation of the C2 Sulfonates[J].Arch Microbiol,2002,179:1-6.
[16]LENGELER J W,DREWS G,SCHLEGEL H G.Biology of the Prokaryotes[M].New York:Blackwell Science,1999,756-758.
[17]ADAMOWICZ M,P M KELLEY,K W NICKERSON.Detergent(Sodium Dodecyl Sulfate)Shock Proteins in Escherichia coli[J].J Appl Bacteriol,1991,137:229-233.
[18]ROSSOCHA M,SCHULTZ-HEIENBROK R,VON MOELLER H,et al.Conjugated Bile Acid Hydrolase is a Tetrameric N-terminal Thiol Hydrolase with Specific Recognition of its Cholyl but not of its Tauryl Product[J].Biochemistry,2005,44(15):5739-5748.
[19]ELKINS C A,SAVAGE D C.CbsT2 from Lactobacillus johnsonii 100-100 is a Transport Protein of the Major Facilitator Superfamily that Facilitates Bile Acid Antiport[J].Mol Microbiol Biotechnol,2003,6(2):76-87.
[20]LUNDEEN S G,SAVAGE D C.Multiple Forms of Bile Salt Hydrolase from Lactobacillus sp.Strain 100-100[J].J Bacteriol,1992,172(22):7217-7220.
[21]BEGLEY MAIRE,HILL COLIN,GAHAN CORMAC G M.Bile Salt Hydrolase Activity in Probiotics[J].American Society for Microbiology,2006,72(3),1729-1738.
[22]ELKINS C A,MOSER S A,SAVAGE D C.Genes Encoding Bile Salt Hydrolases and Conjugated Bile Salt Transporters in Lactobacillus johnsonii 100-100 and Other Lactobacillus species[J].Microbiology,2001,147:3403-3412.
[23]MC AULIFFE O,CANO R J,KLAENHAMMER T R.Genetic Analysis of Two Bbile Salt Hydrolase Activities in Lactobacillus acidophilus NCFM[J].Appl Environ Microbiol,2005,71:4925-4929.
[24]KIM G B,MIYAMOTO C M,MEIGHEN E A,et al.Cloning and Characterization of the Bile Salt Hydrolase Genes(bsh)from Bifidobacterium bifidium Strains[J].Appl Environ Microbiol,2004,70:5603-5612.
[25]LAUE H,FRIEDRICH M,COOL A M.Dissimilatory Sulfite Reductase(Desulfoviridin)of the Taurine-degrading,Nnon-sulfate-reducing Bacterium Bilophila Wadsworthia RZATAU Cntains a Fused DsrBDsrD Subunit[J].J Bacteriol,2001,183(5):1727-1733.
[26]LIE T J,CLAWSON M L,GODCHAUX W,et al.Sulfidogenesis from 2-aminoethanesulfonate(Taurine)Fermentation by a Morphologically Unusual Sulfate-reducing Bacterium,Desulforhopalus singaporensis sp.[J].nov App Environ Microbiol,1999,65(8):3328-3334.
[27]CHRISTL S U,EISNER H D,DUSEL G,et al.Antagonistic Effects of Sulfide and Butyrate on Proliferation of Colonic Mucosa:a Potential Role for these Agents in the Pathogenesis of Ulcerative Colitis[J].Dig Dis Sci.1996,41(12):2477-2481.
[28]MAGEE E A,RICHARDSON C J,HUGHES R,et al.Contribution of Dietary Protein to Sulfide Production in the Large Intestine:an in Vitro and a Controlled Feeding Study in Humans[J].Am J Clin Nutr,2000,72:1488-1494.
[29]BERR F,KULLAK-UBLICK G A,PAUMGARTNER G,et al.7αdehydroxylating Bacteria Enhance Deoxycholic Acid Input and Cholesterol Saturation of Bile in Patients with Gallstones[J].Gastroenterology,1996,111(6):1611-1620.
[30]BERNSTEIN H,BERNSTEIN C,PAYNE C M.Bile Acids as Carcinogens in Human Gastrointestinal Cancers[J].Mutat Res,2005,589(1):47-65.
[31]ADACHI R,HONMA Y,MASUNO H,et al.Selective Activation of Vtamin D Receptor by Lithocholic Acid Acetate,a Bile Acid Derivative[J].J Lipid Res,2005,46(1):46-57.
[32]TAKAHASHI T,MOROMI M.Absence of Cholic Ccid Droxylase Activity in the Strains of Lactobacillus and Bi?dobact[J].Dairy Sci,1994,77:3275-3286.
[33]JONES M L,CHEN H,OUYANG W,et al.Microencapsulated Genetically Engineered Lactobacillus plantarum 80(pCBH1)for Bile Acid Deconjugation and its Implication in Lowering Cholesterol[J].J Biomed Biotechnol,2004,1:61-69.
[34]KURDI P H,VAN VEEN H W,TANAKA H,et al.Cholic Acid is Accumulated Spontaneously,Driven by Membrane ΔpH,in Many Lactobacilli[J].J Bacteriol,2003,182:6525-6528.
Study of the bile salt hydrolase
YUE Ting-ting,HOU Hong-man
(College of Biology and Food Engineering of Dalian Polytechnic University,Dalian 116034,China)
This review explained the function of bile salt hydrolase(BSH)lowering cholesterol,and the characteristics of BSH and the impact activity of BSH on bacterium and the human;introduced genetic organization and regulation of BSH,homologues of bsh in bacterium;discussed the future direction and applied prospect of BSH.
bile salt hydrolase;genome;secondary bile acid
Q556
A
1001-2230(2010)02-0033-05
2009-09-22
辽宁省教委创新团队项目(20061015)。
岳婷婷(1984-),女,研究生,从事食品微生物研究。
侯红漫
book=37,ebook=61

