猪脑心肌炎病毒的分离与鉴定*
张岭岭,王金凤,王 娇,赵泽坤,孙继国,袁万哲
(河北农业大学动物科学院,保定071000)
脑心肌炎病是由脑心肌炎病毒(Encephalomyocarditis virus,EMCV)引起猪及多种哺乳动物脑炎、心肌炎以及心肌周围炎的一种急性传染病。该病也是一种人畜共患病,不仅给养猪业带来巨大的经济损失,也危害了人类的健康。脑心肌炎病毒属于微RNA病毒科心病毒属,是有囊膜的单股正链RNA病毒[1]。此病毒最先是1945年从佛罗里达州一只患急性致死性心肌炎的黑猩猩体内分离得到[2],随后研究发现该病毒感染牛、大象、烷熊、袋鼠、拂拂、称猴、猩猩、非洲绿猴、松鼠、长颈鹿甚至蚊子等多种动物[3-7],一般呈隐性感染。1985年,巴拿马首次报道EMCV能够感染猪并引起猪急性致死性心肌炎[8]。随后,在意大利、希腊、塞浦路斯、比利时、法国、英国等国也报道了该病的暴发流行[9-11]。我国对EMCV的研究起步较晚,EM CV感染在我国猪群中已广泛存在,仅2001年—2004年间的抗体阳性率就已达75.84%[12],这应引起国内养猪业的高度重视。本试验采用无EMCV污染的BHK-21细胞,对保定市发生的具有EMCV典型临床症状和剖检特征,并将PCR检测为阳性的病料进行了EMCV毒株的分离和鉴定,以期获得EMCV河北地方流行毒株,从而为探索EMCV的流行病学数据、相关疾病的致病机理、筛选疫苗毒株和制定综合防控措提供依据。本试验成功分离到1株EMCV,将其命名为BD2株。
1 材料与方法
1.1 材料
1.1.1 病料来源 病料采自河北省养猪场EMCV疑似病死仔猪的脾脏及淋巴结。
1.1.2 细胞系 BHK-21细胞由河北农业大学兽医卫生检验实验室保存、提供。
1.1.3 主要试剂 新生牛血清,杭州四季青生物工程材料有限公司产品,56℃灭活30 min,置—20℃保存备用。
10×DMEM浓缩液:将GIBCOTM DMEM(Invitrogen Corporation,NY,USA)粉剂按厂家说明书配制,过滤除菌,4℃保存,使用时进行10倍稀释。
2×104 U/mL青霉素链霉素液(双抗):青霉素、链霉素各2×106单位溶于100 mL三蒸水中,过滤除菌,分装后,—20℃冻存备用。
500 mmol/L Hepes贮存液:1.2 g Hepes溶于10 mL三蒸水中,经121℃高压灭菌15 min,置—20℃冻存备用。
75 g/L NaHCO3:7.5 g NaHCO3溶于100 mL三蒸水中,115℃高压灭菌20 min,4℃保存备用。
10×Na2EDTA-胰酶溶液(25 g/L):Na2EDTA 0.2 g,NaCl 8.0 g,KCl 0.2 g,Na2HPO4°12H2O 2.89 g,KH2PO4 0.2 g,溶于90 mL三蒸水中,再加入2.5 g胰酶(Amresco Inc.)(1∶250),完全溶解后,加三蒸水补足至100 mL,NaHCO3调节pH至7.2~7.4,过滤除菌,分装,置—20℃保存备用,使用时1∶10稀释。
100 mL/L FBS DMEM培养基:于264 mL三蒸水中加入80 mL 5×DMEM溶液,40 mL FBS,2 mL 2×104U/mL
青链霉素液,4 mL 500 mmol/L Hepes贮存液,用75 g/L NaHCO3溶液调节pH值至7.2~7.4左右,4℃保存备用。
无FBS DMEM培养基:于304 mL三蒸水中加入80 mL 5×DMEM溶液,2 mL 2×104U/mL青链霉素液,4 mL 500 mmol/L Hepes贮存液,用75 g/L NaHCO3溶液调节pH值至7.2~7.4左右,4℃保存备用。
总RNA提取试剂TRIZOL、Marker:购自天根生物试剂有限公司
RNA酶抑制剂(RNasin)、Taq DNA聚合酶、dNTPs、反转录酶AMV Reverse Transcriptase:购自北京全式金生物科技公司。
10 mg/mL EB贮存液:实验室保存。
50×TAE(T ris-HCl):实验室保存。
10 g/L琼脂糖凝胶电泳:称取1.0 g琼脂糖溶于100 mL 1×TAE电泳缓冲液中,溶化后加入5 mL 10 mg/mL EB。
贮存液:使凝胶中EB终浓度达到0.5 mg/mL。
1.1.4 主要仪器 二氧化碳培养箱;Forma Scientific;倒置显微镜:日本Nikon;超净工作台:苏州净化设备厂;台式离心机:上海安亭科学仪器厂;高速冷冻离心机:GIBCO公司。;DYYIII-31 A/31 B型电泳槽:北京六一仪器厂;DYYIII-2型稳压稳流电泳仪:北京六一仪器厂;Kodak凝胶成像分析系统:天能科技(上海)有限公司。
微孔细胞培养板:Costar公司
1.1.5 引物的设计 根据已发表的EMCV基因组全序列(GenBank收录号:X74312),利用计算机辅助软件Primer5.0设计特异性引物P1/P2预期扩增长度为300 bp,均由上海生工生物工程技术服务有限公司合成。

1.2 方法
1.2.1 病料处理 无菌采集病变组织2 g,加入3 mL灭菌PBS,在冰上的研磨器中充分研磨。用移液器吸1 mL的研磨液至1.5 mL的离心管内,反复冻融3次,加入0.25 mL的1万单位的双抗,混匀。4℃,过夜。8 000 r/min离心5 min,取上清,经0.22 nm滤器过滤除菌,—20℃保存备用。
1.2.2 细胞培养及病毒分离 待BHK-21细胞生长成70%~80%单层时,吸弃生长液,接种制备好的病料上清1 mL,同时接种1 mL PBS作为阴性对照组,37℃吸附1 h后换细胞维持液培养。每隔12 h观察一次细胞的生长状况。出现CPE后或36 h后收毒,将细胞反复冻融3次,4 000 r/m in离心10 min,取上清留作提取病毒基因组RNA。
1.2.3 细胞病毒液RNA的提取 取病毒液250 μ L,TRNzol 750 μ L加入到DEPC处理过的EP管内,混匀,冰上放置5 min。4℃,12 000 r/min离心15 min,吸取上清至新的EP管内,向上清加入150 μ L的氯仿,剧烈震荡15 S,冰上静置10 min。4℃,12 000 r/min离心15 min,此时样品分成三层:黄色的有机相,中间层和上层无色的水相,RNA主要在水相中,把水相(约600 μ L)转移至新的离心管中,加入等体积的异丙醇,混匀,—20℃放置1 h~2 h。4℃,12 000 r/min离心15 min,弃上清,加入400 μ L 750 mL/L乙醇,颠倒清洗5 min,4℃,5 000 r/min离心5 min,弃上清,加入350 μ L 750 mL/L乙醇,颠倒清洗数次,弃上清,室温放置晾干。加入20 μ L的Rnase-free ddH2O,反复吹打,混匀,充分溶解RNA。
1.2.4 反转录 采用EMCV下游引物,参照全式金反转录酶说明书合成cDNA,具体做法如下:
20 μ L反应体系:
RNasin 0.5 μ L,RNA提取物10 μ L,下游引物0.5 μ L,5×RT buffer 4 μ L,10 mmol/L dNTPs 4 μ L,反转录酶1 μ L。
其反转录过程在PCR仪中进行,其反应程序如下:42℃,30 min,85℃,5 min。
1.2.5 PCR扩增 引物浓度为25 pmol/μ L,dNTPs每种浓度为2.5 mmol/L,Tap酶为5 U/μ L,整个PCR反应体系为25 μ L,反应成分如下:10×buffer 2.5 μ L,dNTPs 2 μ L,上下游引物各为0.5 μ L,模板DNA 3 μ L,Tap酶0.5 μ L,加高压灭菌三蒸水至16 μ L,混匀,将混合物94℃预变性5 min后,进入PCR循环,按94℃1 min,46℃1 min,72℃1 min,31个循环,最后72℃延伸10 min。
1.2.6 PCR产物的检测 取3 μ LPC R产物进行10 g/L琼脂糖凝胶电泳,以Marker作为DNA标准,紫外灯下观察扩增片段大小,并拍照记录结果以出现300 bp条带的为EMCV阳性,出现其他条带为EMCV阴性。
2 结果
2.1 细胞培养及病毒分离
将病料处理液接种BHK-21细胞(图1A),继续培养,BD1无明显病变(图1B),BD2接种的细胞8 h出现病变,病变形式为细胞圆缩、崩解(图1C)。

图1 细胞培养结果Fig.1 The results of cell culture
2.2 细胞毒的PCR检测结果
从上述BD1、BD2细胞病毒液中提取RNA,做RT-PCR,进行琼脂糖凝胶电泳,结果见图2。
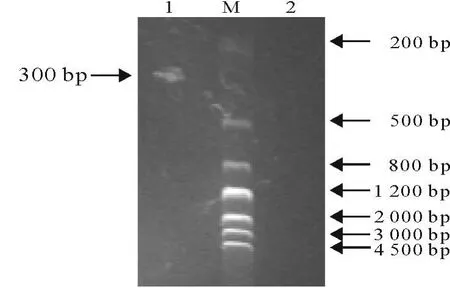
图2 PCR产物电泳结果Fig.2 The results of PCR
3 讨论
病料研磨后,经反复冻融促使病毒从细胞中完全释放出来,再将上清接种BHK-21细胞。由于引起猪繁殖障碍的其他病毒如:PRRSV,PCV2,PRV,PPV和CSFV等在BHK-21细胞系上均不能增殖[12]。病料在细胞上引起明显的特征性的细胞病变如迅速破裂、崩解等,即可以作出初步判断,经RT-PCR进一步鉴定后,最终确定为猪脑心肌炎病毒。
[1] 殷 震.刘景华.动物炳毒学[M].2版.北京:科学出版社,1997.
[2] Helwig F C,Schmidt E C H.A filter-passing agent producing interstitial myocarditis in anthropoidapes and small animals[J].Science,1945,102:31-33.
[3] Kissling R E,Vanella J M,Schaeffer M.Recent isolations of encephalomy ocarditis virus[J].Proc Soc Exp Biol M ed,1956,91:148-152.
[4] Hubbard G B,Soike K F,Butler T M,et al.An encephalomyocarditis virus epizootic in a babooncolony[J].Lab Anim Sci,1992,42:233-239.
[5] Augustijn M,Elbers A R,Koenen F,et al.Estimation of seroprevalence of encephalomyocarditis in Dutch sow herds using the virus neutralization test[J].Tijdschr Diergeneeskd,2006,131(2):40-44.
[6] McLelland D J,Kirkland P D,Rose K A.Serologic responses of Barbary sheep(Ammotragus lervia)Indian antelope(Antilope cervicapra),wallaroos(Macropus robustus),and chimpanzees(Pan troglodytes)to an inactivated encephalomyocarditis virus[J].Uaccine,2005,36(1):69-73.
[7] LaRue R,Myers S,Brewer L.A Wild-Type Porcine Encephalomyocarditis Virus Containing a Short Poly(C)T ract Is Pathogenic to Mice,Pigs,and Cynomolgus Macaques[J].Journal of Virology,2003,9:9136-9146.
[8] Murnane T G,Graig head J E,Mondragon H,et al.Fatal disease of swine dne to encephalomyocarditis virus[J].Science,1960,131:498-499.
[9] Maurice H,Nielen M,Brocchi E,et al.The occurrence of encephalomyocarditis virus(EMCV)in European pigs from 1990 to 2001[J].Epidemiol Infect,2005,133(3):547-557.
[10] Paul B.Occurrence of encephalomyocarditis virus in the Swiss pig population[J].Schweizer A rch Tierheilkunde,1992,134:282-284.
[11] Acland H M,Littlejohns L R.Encephalomy ocarditis virus infection of pig s:An outbreak in New South Wales[J].Aust Vet J,1975,9:5.
[12] 盖新娜.猪脑心肌炎病毒V P1基因的原核表达、血清学调查及分离毒株的鉴定[D].北京:中国农业大学,2005:55-63.

