构建启动大鼠肝组织中TGF-β/Smad信号传导通路的急性肝损伤动物模型
张 涛,黄顺玲,孙克伟,谭德明,孟 琼,陈 晨
(1.湖南中医药大学第一附属医院感染病科,长沙 410007;2.湖南省卫生厅,长沙 410005; 3.中南大学湘雅医院感染病科,长沙 410005;4.湖南中医药大学实验动物中心,长沙 410007)
研究报告
构建启动大鼠肝组织中TGF-β/Smad信号传导通路的急性肝损伤动物模型
张 涛1,黄顺玲2,孙克伟1,谭德明3,孟 琼4,陈 晨1
(1.湖南中医药大学第一附属医院感染病科,长沙 410007;2.湖南省卫生厅,长沙 410005; 3.中南大学湘雅医院感染病科,长沙 410005;4.湖南中医药大学实验动物中心,长沙 410007)
目的在传统CCl4急性肝损伤模型的基础上,构建启动大鼠肝组织中的TGF-β/Smad信号传导通路的急性肝损伤动物模型。方法将30只大鼠随机分为3组,每组各10只,分别为模型组,对照组和空白组,模型组大鼠予小动脉夹夹闭肝总动脉15 min手术处理,随后分别在第6天和第10天,予25%CCl4花生油溶液6 mL/kg体重腹腔注射;对照组则单用两次CCl4,空白组不做任何处理;第二次CCl448 h后处死所有动物。结果模型组与对照组及空白组比较:血清指标ALT、AST、HA显著上升(P<0.01);肝组织HE染色病理观测,肝组织出现明显炎症、变性、坏死,纤维组织增生等现象;PT-PCR检测Ⅰ、Ⅲ型胶原、TGF-β1、Smad3 mRNA表达显著增强(P<0.01);免疫组化检测Ⅰ、Ⅲ型胶原、TGF-β1、Smad3蛋白的表达增强(P<0.01)。结论成功启动急性肝损伤大鼠肝组织中的TGF-β/Smad信号传导路,该急性肝损伤动物模型兼备肝纤维化活跃,和TGF-β/Smad信号传导通路信号增强特征,在评价早期抗肝纤维化药物及方法时具有耗时少、有效和经济的特点,值得进一步研究。
CCl4;肝总动脉夹闭;TGF-β/Smad信号传导通路;模型,动物
肝纤维化的形成是多因素所致,而目前传统的肝纤维化动物模型大多采用单一因素处理,在慢性肝损伤基础上刺激胶原组织增生而造成肝组织纤维化[1,2],此类模型中TGF-β/Smad信号传导通路明显增强,但造模所需时间长、成本高、成模比例低。如能在急性肝损伤的模型中也能启动TGF-β/Smad信号传导通路,也就提示在急性肝损伤同时,可能伴随着抗损伤过程的潜在活化,这在研究早期肝纤维化中意义重大,它不仅可评价药物早期干预的效果,也较传统的肝纤维化动物模型更省时,更经济。但目前并没有此类兼备肝纤维化活跃,和TGF-β/Smad信号传导通路信号增强特征的急性肝损伤动物模型的文献报导。本实验拟在传统CCl4急性肝损伤模型的基础上,通过夹闭肝总动脉产生缺血后再灌注损伤,构建启动大鼠肝组织中的TGF-β/Smad信号传导通路的急性肝损伤动物模型。
1 材料和方法
1.1 材料
1.1.1 动物:健康SD大鼠30只,清洁级,体重300 ±50 g/只,雌雄各半,湖南农业大学动物实验中心提供[SYCK(湘)2003-0003]。
1.1.2 手术器械:止血钳4把、有齿镊、持针器各1把,12.5 cm显微镊1把,系线镊2把,小动脉夹、缝合针数枚。
1.1.3 仪器:苏州 Z20P5 10倍手术显微镜,美国PE公司PCR仪,美国Ewgle Eye II型病理图像分析仪,美国 NUAIRE超低温冰箱,上海天能 UV-2000紫外分析仪。
1.1.4 主要药品及试剂:戊巴比妥钠(国药集团化学试剂有限公司,批号:F20041117,25 g/瓶);分析纯CCl4(湖南师大化学试剂厂,纯度99.99%);RTPCR引物 (日本 TAKARA生物技术有限公司合成);兔抗大鼠 COL-1、COL-3、TGF-β1、Smad3亲和抗体(武汉博士德生物工程有限公司);SABC试剂盒,含复合消化液,正常山羊血清,生物素化山羊抗兔lgG、SABC试剂等(武汉博士德生物工程有限公司);DAB显色试剂盒,含显色液A(DAB×20倍稀释液),显色液B(H2O2×20倍稀释液),显色液C (×20倍TBS浓缩缓冲液)(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 造模:2%戊巴比妥钠45 mg/kg腹腔注射麻醉,剑突以下腹部剃毛、消毒,常规无菌手术规程操作。腹部正中切口2.5~3.0 cm,用无齿镊提起腹肌沿腹白线剪开腹肌,止血钳钳夹切口两侧的腹肌,暴露肝脏。在10倍手术显微镜下,棉签钝性分离肝脏乳头叶,在其下方找到肝总动脉分枝出肝固有动脉和胃十二指肠动脉处,祛除血管外壁的结缔组织与脂肪组织,将各血管分离,在胃十二指肠动脉分出胃右动脉前方用丝线结扎血管,用小动脉夹夹闭肝总动脉,持续15 min后松开动脉夹,缝合腹壁肌层及皮肤,皮肤切口用70%酒精消毒。将手术后的大鼠,分别在随后的第6天和第10天,以25% CCl4花生油溶液6 mL/kg体重腹腔注射,自由饮水、进食普通颗粒饲料。
1.2.2 实验设计、分组:30只大鼠随机分为3组,每组10只,分别为模型组、对照组、空白组。模型组予手术加CCl4处理,对照组单用两次 CCl4处理,空白组不做任何处理,通过预实验设定第二次给予CCl4后0.5 h、24 h、48 h、72 h为观测点比较,选定第二次CCl448 h为最佳观测时间,此时间点处死所有动物。
1.2.3 动物处死及取材:大鼠戊巴比妥钠腹腔注射麻醉,腹中线切皮,暴露游离膈肌心脏取血,离心取血清。充分暴露游离肝脏,从不同肝叶处剪下大小约1 cm ×1 cm ×0.5 cm的两块肝组织,用10%中性甲醛溶液固定,留作病理学和免疫组化检测;再取约100 mg肝组织提取RNA。
1.2.4 观察指标及各指标的测定
1.2.4.1 血清生化指标:由湖南中医药大学附一院检验科全自动生化分析仪检测血清ALT、AST,放射免疫分析法检测HA。
1.2.4.2 肝组织:HE染色及病理组织学评估:甲醛固定标本,石蜡包埋,切片5 μm,二甲苯、乙醇脱水透明,染色后在镜下观察肝脏病变情况。
1.2.4.3 RT-PCR检测Ⅰ、Ⅲ型胶原(COL-1、COL-3)、TGF-β1、Smad3 mRNA的表达:TRIzol提取大鼠肝组织RNA,方法按照试剂说明书操作。以上四个指标引物参照文献,并在基因库上进行核对,GADPH为内参照。COL-1引物如下,上游引物序列5′-CAT AAA GGG TCA TCG TGG CTT C-3′,下游引物序列5′-GTG ATA GGT GAT GTT CTG GGA G-3′,扩增片段长度为489 bp;COL-3上游引物序列5′-AAC CCA GTA TTC TCC ACT CTT-3′,下游引物序列5′-CGA GGT AACAGA GGT GAA AGA-3′,扩增片段长度为 349 bp;TGF-β1上游引物序列 5′-CAA AGA CAT CAC ACA CAG TA-3′,下游引物序列5′-AGG TGT TGA GCC CTT TCC AG-3′,扩增片段长度为 441 bp;Smad3上游引物序列 5′-AAG GGC GAG CAG AAC GGG-3′,下游引物序列 5′-GGG ATG GAA TGG CTG TAG TC-3′,扩增片段长度为425 bp;GADPH上游引物序列5′-GGT GAA GGT CGG TGT GAA CGG A-3′,下游引物序列5′-TGT TAG TGG GGT CTC GCT CCT G-3′,扩增片段长度为245 bp;RT-PCR按照试剂盒说明操作,PCR条件为95℃ 5 min,94℃ 30 s,60℃ 40 s,72℃ 30 s,35个循环,72℃ 7 min。取10 μL PCR产物,琼脂糖凝胶电泳,用凝胶图像分析系统检测灰度值(IVD),对条带量化处理。
1.2.4.4 免疫组织化学检测肝组织COL-1、COL-3、TGF-β1、Smad3蛋白表达:肝组织标本用10%甲醛液固定,石蜡包埋4 μm连续切片,采用SABC法作免疫组化染色。全自动图像分析仪计算 COL-1、COL-3、TGF-β1、Smad3的阳性信号,并以此反映该样本中 COL-1、COL-3、TGF-β1、Smad3含量的相对多少。
1.3 统计学处理
所有数据采用SPSS13.0统计软件。各组之间采用Sidak法比较,方差不齐者进行H检验。
2 结果
2.1 血清ALT、AST及HA测定结果
对照组、空白组与模型组比较,在血清 ALT、AST及HA上差异显著(P<0.01),对照组与空白组在以上三个指标比较差异同样显著(P<0.01),说明对照组与模型组在以上三个指标上明显异常,且以模型组表现最为显著(表1)。

表1 血清ALT、AST HA的测定结果(mean±s)Tab.1 Serum ALT,AST,HA of the determination results(mean±s)
2.2 肝组织病理组织学评估
肝组织病理检查结果显示:模型组肝细胞广泛性脂肪变性及炎症细胞浸润,肝细胞索破坏,肝细胞呈片状坏死,并可见纤维组织增生分割,纤维隔形成,部分肝小叶结构被破坏有假小叶形成趋势;而对照组仅表现为急性肝损伤病理改变,且损伤程度小于模型组,未发现纤维组织增生(图1,见彩插Ⅰ)。
2.3 RT-PCR检测 COL-1、COL-3、TGF-β1、Smad3 mRNA的表达
RT-PCR检测显示与空白组、对照组比较,模型组在 COL-1、COL-3、TGF-β1、Smad3 mRNA的表达明显增强,而对照组与空白组之间,二者没有明显差异(图2)。
经PCR产物电泳及半定量分析,与模型组比较,对照组和空白组在 COL-1、COL-3、TGF-β1、Smad3的灰度值上差异显著(P<0.01),对照组与空白组之间,4个测试值之间未见明显差异(P>0.05)(表2)。
2.4 免疫组化检测肝细胞内COL-1、COL-3、TGF-β1、Smad3蛋白表达
以上各指标在肝细胞内蛋白水平的表达,以细胞质或细胞核及部分细胞膜,呈界限清楚的棕黄色或深棕色反应为阳性细胞。与空白组、对照组比较,在模型组表达明显增加,主要分布在炎性细胞浸润区、坏死灶、汇管区及纤维间隔等地方,免疫组化检测结果具有特异性(图3,见彩插1,2)。
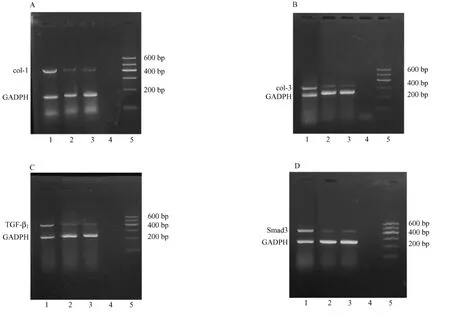
图2 各实验组RT-PCR产物凝胶电泳图Fig.2 RT-PCR products of gel electrophoresis in all experimental groups
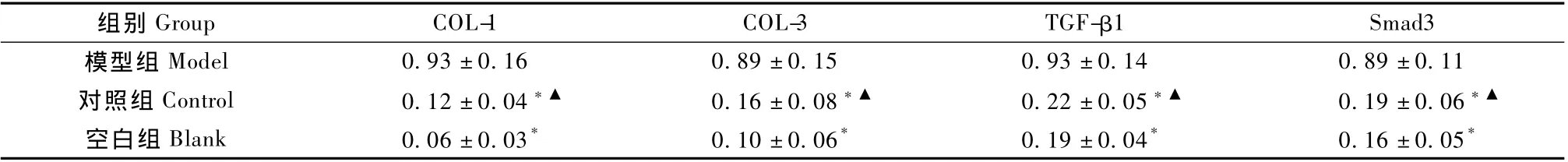
表2 不同组的 COL-1、COL-3、TGF-β1、Smad3灰度值Tab.2 Gray value of different groups of COL-1,COL-3,TGF-β1,Smad3
经各实验组肝细胞内 COL-1、COL-3、TGF-β1、Smad3免疫组化阳性信号定量结果分析,与模型组比较,对照组和空白组在 COL-1、COL-3、TGF-β1、 Smad3的免疫组化蛋白相对量差异显著(P<0.01),对照组与空白组之间,4个测试值之间未见明显差异(P>0.05)(表3)。
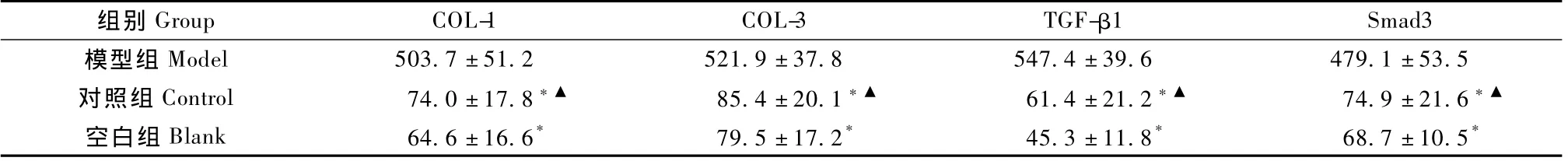
表3 不同组的COL-1、COL-3、TGF-β1、Smad3免疫组化蛋白相对量Tab.3 Different groups of COL-1,COL-3,TGF-β1,Smad3 relative amount of protein by immunohistochemistry
3 讨论
TGF-β/Smad信号传导通路是肝纤维化时主要的信号转导途径[3,4],是已知最强烈的肝纤维化促进因子-转化生长因子β1(TGF-β1)[5]发挥生物学作用的主要通路,而Smad 3介导TGF-β1的大多数促纤维化效应[6,7]。故该通路是肝损伤后向肝纤维化病变的关键环节,阻断该信号传导通路,能较早地逆转肝纤维化。因此构建启动TGF-β/Smad信号传导通路的模型,在急性肝损伤及肝损伤后早期肝纤维化的实验研究中意义重大。
本实验中,模型组在反映血清肝功能指标ALT、AST显著增高;肝脏病理组织学上改变明显,可见广泛性肝细胞脂肪变性及炎症细胞浸润,肝细胞索破坏,肝细胞呈片状坏死,表明肝细胞损伤严重。在急性肝损伤的同时也可见抗损伤机制的活化,表现为反映纤维化活跃的指标也明显增高,如血清透明质酸 (hyaluronic acid,HA)在模型组组明显升高,反映肝星状细胞(hepatic stellate cellular,HSC)活化指标和肝脏细胞外基质(extracellular matrix,ECM)的主要成分Ⅰ、Ⅲ型胶原也明显增加。与此同时TGF-β1、Smad3 mRNA转录水平及蛋白表达水平明显升高。而单用CCl4的对照组仅反映出急性肝损伤,并没有出现明显肝纤维化及 TGF-β/Smad信号通路的传导。
本实验模型是在以较大剂量的 CCl4,间隔5 d两次腹腔注射,外加夹闭肝总动脉基础上构建成功的。所见到的 TGF-β/Smad信号传导通路被启动,肝纤维化指标明显升高的表现在其他的急性肝损伤模型中少见,查阅文献及本实验所示,在短时间若单以CCl4造模,并不能启动TGF-β/Smad信号传导通路。分析成功原因可能是本实验中一方面通过对肝总动脉约15 min的夹闭,阻断了肝脏的血液的供应,产生缺血后再灌注损伤(ischemiareperfusion injury,I-R),促使 Kupffer细胞和白细胞被激活产生大量炎性细胞介质和氧自由基,使肝微循环障碍,加重肝脏损伤[8];另一方面,使用了大剂量的CCl4重复注射,在肝内活化的-OOCl3直接损伤质膜,启动脂质过氧化作用,破坏肝细胞膜性结构等,造成肝细胞变形坏死;两种因素所造成的损伤可能有相加或协同作用,同时也可能加快了抗损伤机制的启动,表现在TGF-β/Smad信号传导通路信号增强,和Ⅰ、Ⅲ型胶原水平的升高。这些表象的存在,提示这一急性肝损伤动物模型也有可能对于研究早期抗肝纤维化药物和方法有重要价值。今后我们将对模型形成机理、模型改进、实验价值等做进一步的研究。
[1] 曾林,王慧芳,窦如海.肝纤维化动物模型的研究概况[J].中国比较医学杂志,2003,13(2):124.
[2] 郭花,薛挥.肝硬化动物模型研究进展[J].中国比较医学杂志,2006,16(8):499-501.
[3] 黄岂平,陈国宝.肝纤维化中肌成纤维细胞的作用及 TGF-β/ Smads通路的研究进展[J].生物技术通报,2009,26(11): 16-19.
[4] 俞敏蕾,吕宾.TGF-β/Smad信号转导通路与肝纤维化的关系[J].国际消化病志,2008,28(5):397-400.
[5] 殷亮,杨生生.转化生长因子β(TGF-β)在肝纤维化中的作用[J].肝脏,2007,12(5):416-417.
[6] Flanders KC.Smad3 as a mediator of the fibrotic response[J]. Int Exp Pathol,2004,85(2):47-64.
[7] 吴晓玲,曾维政,蒋明德,等.肝纤维化大鼠肝组织 Smads基因表达状况及意义[J].世界华人消化杂志,2008,16(10): 1037-1041.
[8] Banga NR,Homer-Vanniasinkam S,Graham A,et al.Ischemic preconditioning in transplantation and major resection of the liver[J].Br Surg,2005,92(5):528-538.
Construction of an Acute Liver Damage Animal Model for Priming TGF-β/Smad Signal Conduction Pathway in Hepatic Tissue of Rats
ZHANG Tao1,HUANG Shun-ling2,SUN Ke-wei1,TAN De-ming3,MENG Qiong4,CHEN Chen1
(1.Department of Infectious Diseases,First Affiliated Hospital of Hunan Chinese Medical University,Changsha 410007,China; 2.Hunan Provincial Department of Health,Changsha 410005,China; 3.Department of Infectious Diseases,Xiangya Hospital of Central South University,Changsha 410008,China; 4.Laboratary animal Centre,Hunan Chinese Medical University,Changsha 410007,China)
ObjectiveTo construct an acute liver damage animal model for priming TGF-β/Smad signal conduction pathway in hepatic tissue of rats on the basis of traditional model induced by carbon tetrachloride(CCl4). Methods Thirty rats were randomly divided into three groups as model group,control group and blank group.The model group was prepared by clamping the hepaticarterycommuniswith bulldogclamp for 15 minuteswasinjected intraperitoneally with 25% of CCl4contained in arachis oil on the following sixth and tenth day after the operation,respectively.The dosage of the liquor was 6 mL per kg.The control group was only injected intraperitoneally with CCl4twice,while the blank group without any treatment.After 48 hours of the second injection,the rats were sacrificed. Results The levels of ALT,AST and HA in plasma were apparently increased in model group compared with that incontrol group and blank group(P <0.01).The liver HE staining in model group showed that there were obvious inflammation,apomorphosis,cellular necrosis and fibroplasias,the gene expression and protein expression of typeⅠ,Ⅲcollagen,TGF-β1 and Smad3 enhanced obviously with RT-PCR detection and Immunohistochemistry technology in the model group than that in control group and blank group(P <0.01)。ConclusionAnimal model of acute liver injury have two features:active liver fibrosis and TGF-β/Smad signaling pathway signal enhancement.The acute liver injury rat model priming TGF-β/Smad signal conduction pathway in liver tissue has advantages of less time consuming,utility and economy in evaluating the drugs and methods for early anti-hepatic fibrosis.
CCl4;Clamping the hepatic artery communis;TGF-β/Smad signal conduction pathway;Model,animal
R-332
A
1671-7856(2010)07-0005-05
2010-01-28
湖南省科技计划项目(NO:2007fj4176),湖南省卫生厅中医药科研基金(NO:2006103)。
张涛(1977-),男,硕士,主治医师,主要从事传染病学及肝病研究。E-mail:emailzt@tom.com
黄顺玲(1958-),女,博士,主任医师,主要从事肝病防治及研究。E-mail:huangshunlin@163.com

