肺炎克雷伯氏菌特异性抗原的筛选与鉴定
李 挺,张丽芳,刘 星,刘先菊,刘江宁,李万波,林树柱
(北京协和医学院中国医学科学院实验动物研究所,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
研究报告
肺炎克雷伯氏菌特异性抗原的筛选与鉴定
李 挺,张丽芳,刘 星,刘先菊,刘江宁,李万波,林树柱
(北京协和医学院中国医学科学院实验动物研究所,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
目的 寻找肺炎克雷伯氏菌(Klebsiella pneumoniae)血清学检测用特异性抗原。方法双向电泳分离K.pneumoniae总蛋白,通过免疫印迹(Western blotting)与常见病原菌的多抗反应筛选特异性抗原蛋白,原核表达该蛋白并用ELISA法验证。结果获得K.pneumoniae的双向电泳图谱。寻找Western blotting中与K.pneumoniae自身多抗反应而不与与其它病原菌多抗反应的蛋白,质谱鉴定为酸性磷酸酶(Acid phosphatase,GI:238894261)。经表达纯化并以酶联免疫吸附试验(ELISA)验证,证明该蛋白作为包被抗原的灵敏度高,特异性强。结论K.pneumoniae酸性磷酸酶是适用于该菌感染检测特异性抗原蛋白。
小鼠;检测;特异性抗原;双向电泳;免疫印迹;酶联免疫吸附试验(ELISA)
肺炎克雷伯氏菌(Klebsiella pneumoniae)是人和动物呼吸道和肠道内寄生性条件致病菌,能致动物肺炎及其他化脓性炎症[1],实验动物如果隐性感染,会在行为学,生长率,相关器官重量和免疫应答方面影响实验结果[2]。我国的实验动物国家标准[3]把此菌列为无特定病原体(SPF)大小鼠必须检测及排除的项目。
目前对K.pneumoniae的检测方法主要是分离培养法,但该方法存在灵敏度低,容易污染环境造成人和动物感染的缺点。PCR法虽然灵敏度较高,但也需要样品中存在K.pneumoniae的菌体或DNA[4],对于处于感染恢复期的人或动物无法检出。基于血清学的免疫检测方法简单有效,灵敏度高,特异性好[5],不需要样本中存在菌体。但由于K.pneumoniae和其他肠杆菌科存在共同抗原,使传统的基于全菌抗原的检测方法准确度不高。随着蛋白质组学技术和生物信息学的不断发展,寻找并利用细菌的特异性抗原蛋白建立的检测方法已成为可能并已有相关报道[4]。鉴于K.pneumoniae的检测在实验动物质量控制上的重要意义,本研究通过免疫印迹技术筛选出与K.pneumoniae血清强烈反应而不与其他抗血清反应的蛋白,用质谱鉴定,原核表达和ELISA法验证,获得用于K.pneumoniae血清学检验的表达抗原蛋白。
1 材料和方法
1.1 材料
病原细菌来自于中国药品生物制品检定所中国医学细菌保藏管理中心,本所保藏。BL21(DE3)大肠杆菌(Escherichia coli)菌株,pET28a载体购于Novagen,由本所遗传中心保藏。SPF级ICR小鼠购于维通利华公司[SCXK(京)2006-0009],饲养于独立通风笼具(IVC)中。等电聚焦电泳系统购于Invitrogen,垂直电泳槽与半干式电转移槽购于ATTO,高速冷冻离心机购于Beckman。细菌培养基均来自英国Oxoid,弗氏完全佐剂、弗氏不完全佐剂均为Sigma原装,BCA蛋白定量试剂盒购于北京博奥森,固相pH梯度(IPG)等电聚焦电泳预制胶条购于Invitrogen,蛋白 Marker购于 MBI,聚偏氟乙烯膜(PVDF)购于美国PALL,辣根过氧化物酶(HRP)标记羊抗小鼠IgG(H+L)(二抗)来自美国Jackson,DAB显色试剂盒购于北京中杉金桥生物,Ni-NTA树脂购于Novagen,其他生化试剂均为进口分装。
1.2 病原菌的培养
嗜肺巴氏杆菌(Pasteurella pneumotropica),鼠棒状杆菌(Corynebacterium kutscheri),金黄色葡萄球菌(Staphylococcus aureus), 念 珠 状 链 杆 菌(Streptobacillus moniliformis), 肺 炎 链 球 菌(Streptococcus pneumuniae)培养于含5%马血清(经56℃30 min灭活补体)的胰胨大豆肉汤(TSB),K.pneumoniae,大肠杆菌,绿脓杆菌 (Pseudomonasaeruginosa),肠炎沙门氏菌(Salmonella enteritidis),小肠结肠炎耶尔森菌(Yersinia enterocolitica),假结核耶尔森菌(Yersinia pseudotuberculosis)培养于TSB,在摇床中以37℃ 180 r/min培养12~48 h至对数末期。
1.3 各种病原菌多抗血清的制备
收集各种病原菌的培养液,分别以6000 r/mim 4℃离心10 min,弃上清,用磷酸盐缓冲液(PBS,pH 7.4)重悬洗涤菌体三次,BCA法定量总蛋白,再加入甲醛至终浓度0.2%,4℃ 72 h灭活菌体。待取少量处理液涂血平皿验证无活菌存在后,离心收集菌体用PBS洗涤重悬并按照报道的方法,免疫小鼠制备多克隆抗体[6],每种抗原免疫10只小鼠,每只小鼠按首次免疫50 μg总蛋白与弗氏完全佐剂混合乳化;第4周、第6周以25 μg总蛋白与弗氏不完全佐剂混合加强免疫,第8周以100 μg总蛋白不加佐剂冲击免疫的方案进行免疫。冲击免疫7 d后处死小鼠取血。以各种病原体全菌包被 ELISA板检测血清的效价,效价高于 1∶10 000的血清用于后续实验。
1.4 双向电泳样品的制备
K.pneumoniae培养液以 6000 r/mim 4℃离心10 min,弃上清,菌体用含 250 mmol/L蔗糖的 TE (10 mmol/L Tris,1 mmol/L EDTA,1 mmol/L PMSF,pH 8.0)缓冲液洗涤三次,后用4倍体积的 TE重悬,在冰上用超声波以15 s为间歇破碎细胞至镜检无完整菌体,20 000 r/mim 4℃离心15 min,上清即为可溶性组分;沉淀用TE洗涤后离心并用4倍体积的 TE重悬,收集不溶性组分。两组分分别用BCA法测蛋白浓度。
1.5 双向电泳
等点聚焦电泳(IEF)采用 Gorg等[7]报道的方法,使用 pH(4~7)的 IPG预制胶条运行于 Zoom IPG Runner系统。可溶与不溶性蛋白组分分别溶解于水化液(7 mol/L尿素,2 mol/L硫脲,2.5% CHAPS,1%DTT,0.5%pH(3~10)两性电解质,痕量溴酚蓝),每胶条上样 70 μg蛋白,25℃水化2 h。IEF条件为200 V 20 min,450 V 15 min,750 V 15 min,2000 V 30 min,3000 V 10 min。胶条先后置于含2%DTT和2.5% 碘代乙酰胺的平衡液(6 mol/L尿素,30%甘油,2%SDS,50 mmol/L Tris-HCl,pH8.8,痕量溴酚蓝)平衡15 min,之后转入10%的聚丙烯酰胺(PAGE)凝胶采用Laemmli系统[8]进行第二向SDS-PAGE分离。电泳完后使用胶体考马斯亮蓝 G250染色法[9]染色。电泳结果用Imagemaster 2DTM软件分析。感兴趣的蛋白切胶做胶内胰酶酶切与激光辅助基质解离-飞行时间质谱(MALDI-TOF-MS)分析。得到的多肽指纹图谱(PMF)使用Mascot数据库检索。
1.6 Western blotting
免疫印迹采用Mansfiled[10]报道的方法,蛋白以2 mA/cm2恒流1 h转移至预处理过的 PVDF膜。转移完成后用含 5%脱脂奶粉的 PBST(pH 7.4 PBS,0.05% Tween 20)封闭 1 h。膜分别与K. pneumoniae抗血清(1∶1000稀释)和其他病原菌抗血清的混合物(每种终稀释度1∶1000)反应。然后用PBST洗膜三次,二抗(1∶2000稀释)室温反应1 h,再用PBST洗膜三次后用 DAB显色,待蛋白点清晰后用蒸馏水终止反应。
1.7 蛋白的表达与纯化
根据质谱结果设计引物 (表 1),以K. pneumoniae基因组为模板扩增对应蛋白的编码序列,产物经Nco I,Xho I双酶切纯化后连接 pET28a载体,转入 BL21(DE3)菌株,25℃诱导表达过夜。表达产物经Ni-NTA树脂柱纯化后,用PBS 4℃透析过夜。产物用BCA法测定蛋白浓度。
1.8 ELISA
纯化后的蛋白用包被缓冲液(15 mmol/L Na2CO3,35 mmol/L NaHCO3,pH 9.6)稀释至20 μg /mL后4℃过夜包被96孔ELISA板,每孔上样100 μL。用 PBST洗板之后用封闭液(含1%BSA的PBST)37℃封闭1 h。随机各取6份各病原菌的多抗血清用封闭液1∶2 000稀释后每孔上样100 μL (阴性血清为1∶40稀释)37℃反应1 h后用PBST洗板,然后用1∶20 000稀释的二抗37℃孵育1 h,再用PBST洗涤。各反应孔中加入100 μL TMB显色液37℃反应10 min后以等体积2 mol/L H2SO4终止反应,用酶标仪450 nm,630 nm双波长读取吸光度值。结果用EXCEL软件计算均值与标准差并作图分析。
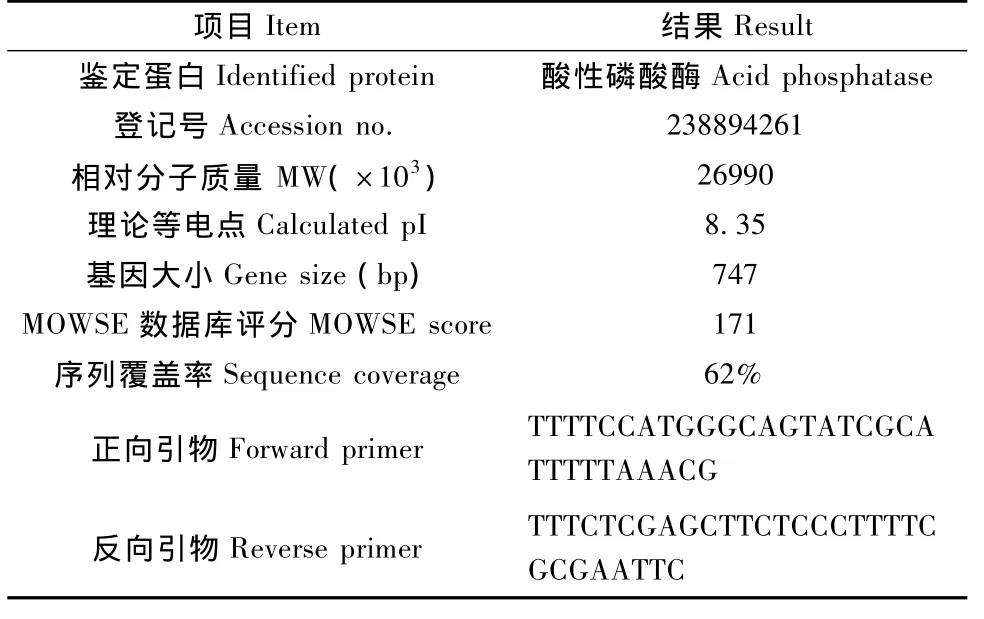
表1 蛋白质谱结果及引物设计Tab.1 Result of protein MS and primer design
2 结果
2.1 K.pneumoniae总蛋白的分离
为筛选和鉴定K.pneumoniae的特异性抗原,K.pneumoniae总蛋白做双向电泳分离,经胶体考马斯亮蓝G250染色后用Imagemaster 2DTM分析,可溶性组分共识别出264个点(图1 A),不溶性组分共识别出135个点(图1 B)。这些蛋白质大小集中在25 ×103~100 ×103之间,可溶性蛋白的等电点(pI)集中在5~7之间,不溶性蛋白pI在4.5~6.5之间比较集中。双线电泳的结果将应用于特异性蛋白的筛选和鉴定。
2.2 特异性蛋白的筛选

图1 K.pneumoniae的双向电泳Fig.1 2DE map of K.pneumoniae
为了鉴定K.pneumoniae特异蛋白,双向电泳分离的蛋白分别与K.pneumoniae的多抗血清和其他病原菌抗血清的混合物进行免疫印迹,以寻找与自身多抗反应,与其他抗血清不反应的特异性抗原蛋白。K.pneumoniae裂解液可溶性蛋白中大多数都与其他细菌存在交叉反应,但仍然能找到部分蛋白仅和K.pneumoniae的抗血清反应而不和其他抗血清发生反应(点1~3,图2),不溶性组分由于电泳过程中拖尾难以避免,而 Western blotting的灵敏度高于考马斯亮蓝染色,导致结果出现较多竖纹,掩盖了部分阳性结果,仅确定一个特异性较强的蛋白(点4,图2)。

图2 K.pneumoniae与其自身多抗及与其他病原菌的多抗的Western blooting结果Fig.2 Western blotting analysis of K.pneumoniae react to its own antiserum and to the antiserum mixture of other pathogens
2.3 特异性抗原的鉴定
Western blotting筛选出的特异性最强灵敏度最高的蛋白(蛋白 1)通过切胶回收,胰酶酶切和MALDI-TOF获得该蛋白的多肽指纹图谱。质谱结果用 Mascot数据库(http://www.matrixscience. com)检索,返回结果显示该蛋白为K.pneumoniae的酸性磷酸酶蛋白(表1)。
2.4 特异性抗原的表达与验证
使用表1中设计的引物扩增该蛋白的编码序列,通过Nco I与Xho I酶切位点与pET28a载体连接,使表达蛋白 C端带有 his-tag。镍柱纯化后以SDS-PAGE验证,该蛋白纯化后纯度大于90%。
计算表达纯化的 Acid phosphatase(酸性磷酸酶)与各种病原菌多抗血清反应、显色的A值的均值与标准差并作图(图3)。结果显示,该蛋白与K.pneumoniae多抗的反应的A值相对于其他多抗差异都显著,感染血清反应A值大于阴性对照的2.1倍。
3 讨论
肺炎克雷伯氏菌是实验动物质量检测中常被检出的病原菌[11]。当前的检测手段为分离培养法和PCR法。分离培养法耗时长(2~3 d),灵敏度低,需要对病原菌进行培养;基于抗体的双抗夹心ELISA法[12]和 PCR法灵敏度高但也需要样品中存在菌体或DNA。传统的血清学检测法受到交叉反应的干扰严重而限制了它的使用。使用表达的特异性抗原来检测感染状况,具有成本低,灵敏度高,耗时短(2~3 h)步骤少,感染后3~7 d即可检出,即使感染后恢复时细菌量很少时也能检出[4]。该方法已用于部分细菌的临床检验,而尚未见用于动物检测。人接触到多种病原菌,临床检测试剂都采用大量的阴性血清排除交叉反应。而动物一般饲养于相对清洁的环境下,可接触病原菌很少,阴性血清不足以排除交叉反应,因此本试验采用甲醛灭活的细菌菌体制备多抗进行优势抗原的筛选和交叉抗原的排除;甲醛是蛋白质交联剂[13],在灭活细菌的情况下,能够稳固菌体蛋白的天然构象,尽可能使产生的抗体与自然感染相近,采用了小鼠常见的12种病原菌的多抗来排除交叉反应,保证了目标抗原的特异性。
为准确得到抗原蛋白,使用IPG-DALT系统做双向电泳分离细菌的总蛋白。该系统已被之前的研究证明重复性好[7],可在多块胶上获得同样的图谱用于Western blotting比对。参考以前的双向电泳结果[14],菌体蛋白的 pI主要集中在 4~7的范围内,因此利用了溶解度预分离和pH(4~7)的窄范围预制胶以提高分辨率。之前有报道用其他方法获得细菌的特异性抗原[15],该方法得到的抗原常为多种成分的混合物,成分不明确,对操作者技术要求高。本研究根据质谱结果设计引物表达带有 histag的抗原蛋白镍柱纯化,可以低成本获得大量高纯度的抗原蛋白,适合生产并建立标准。
表达 蛋 白经 ELISA 验 证,该 蛋 白 与 K. pneumoniae血清反应的A值明显高于与其他血清反应的A值,但与大肠杆菌,沙门氏菌和肠炎耶尔森菌存在一定的交叉反应,在实际应用中有可能出现难以区分的情况;这种问题在获得了所有常见病原菌的特异性抗原建立整合的试剂盒后得到解决。该酸性磷酸酶为K.pneumoniae的功能蛋白,被认为是该菌的毒力因子之一[16],也佐证了该蛋白成为K.pneumoniae特异性抗原的可信性和在不同菌株中存在的稳定性。由于病原样本条件的限制,仅使用了来自于北京的实验小鼠K.pneumoniae感染血清作为验证。是否对K.pneumoniae所有菌株的检测都可靠,还需要在实际检测应用中应用大量不同来演的样本证实。K.pneumoniae的该酸性磷酸酶蛋白有望成为实验动物肺炎克雷伯氏菌血清学检测的标准抗原。
(本研究成果已申请专利,专利号:ZL201010 105060.1。本研究蛋白质质谱鉴定部分由军事医学科学院生物医学分析中心协助完成,感谢该中心薛燕,刘炳玉老师给予的技术指导和帮助。)
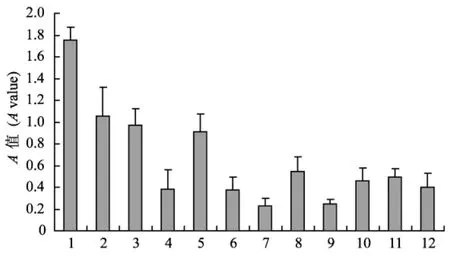
图3 K.pneumoniae酸性磷酸酶与各病原菌抗血清反应情况Fig.3 Acid phosphatase reacts to pAbs of each pathogenic bacteria
[1] 周正任,李凡,叶嗣颖,等.医学微生物学 (第6版)[M].北京:人民卫生出版社,2003:207-208.
[2] Matsuda Y.Recent trends in the number of laboratory animals used in Japan[J].ATLA,2004,32(Supplement 1A):299-301.
[3] 贺争鸣,田克恭,李红,等.中国人民共和国国家标准:实验动物 微生物学等级及监测.GB14922.2-2001[S].国家质量技术监督局,2001.
[4] McCoola TL,Hoeya JG,Montileone F,el al.Discovery and analysisofBartonella henselaeantigensforuse in clinical serologic assays[J].Diagn Micr Infec Dis,2008,60:17-23.
[5] Gosling JP.Immunoassays:a practical approach[M].Oxford: Oxford University Press,2000:5-6,165-180.
[6] Howard GC,Kaser MR.Making and using antibodies[M]. Boca Raton:CRC Press,2007:55-61.
[7] Gorg A,Obermaier C,Boguth G,et al.The current state of twodimensional electrophoresis with immobilized pH gradients[J]. Electrophoresis,2000,21:1037-1053.
[8] Laemmli UK. Cleavage ofstrcucturalpeoteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[9] Candiano G,Bruschi1 M.Blue silver:A very sensitive colloidal coomassie G-250 staining for proteome analysis [J]. Electrophoresis,2004,25:1327-1333.
[10] Mansfield MA. Rapid immunodetection on polyvinylidene fluoride membrane blots without blocking[J].Anal Biochem,1995,229:140-143.
[11] Pritchett-Corning KR,Cosentino J,Clifford CB.Contemporary prevalence of infectious agents in laboratory mice and rats[J]. Lab Animal,2008,11:1-9.
[12] 何静云,李红.分子文库技术在感染性疾病血清学诊断试剂研究中的应用[J].中国比较医学杂志,2005,15(3):179-181.
[13] Golernis E.Protein-protein interactions:a molecular cloning manual[M].New York:Cold Spring Harbor Laboratory Press, 2002:286-287.
[14] Simpson RJ.Purification proteins for proteomics:a laboratory manual[M].Newwork:Cold Spring Harbor Laboratory Press,2004:433-441.
[15] 张丽芳,刘星,李红.嗜肺巴氏杆菌外膜蛋白和脂多糖抗原在血清学诊断中的意义[J].中国实验动物学报,2003,11 (4):226-229.
[16] Prenetaa R, Jarraudb S, Vincent C. Isolation and characterization of a protein-tyrosine kinase and a phosphotyrosine-protein phosphatase from Klebsiella pneumoniae[J].Comp Biochem Physiol B Biochem Mol Biol,2002,131: 103-112.
Identification of Specific Diagnostic Antigen for Klebsiella pneumoniae
LI Ting,ZHANG Li-fang,LIU Xing,LIU Xian-ju,LIU Jiang-ning,LI Wan-bo,LIN Shu-zhu
(Key Laboratory of Human Diseases Animal Model,State Administration of Traditional Chinese Medicine,Institute of Laboratory Animal Sciences,Peking Union Medical College(PUMC)and Chinese Academy of Medical Sciences(CAMS),Beijing 100021,China)
ObjectiveTo discover novel antigens ofKlebsiella pneumoniaefor establishing serological assays. Methods Total protein ofK.pneumoniae was separated by two-dimension electrophoresis(2DE),reacting with polyclonal antibodies of common pathogenic bacteria by western blotting.The specific antigen was selected,expressed inE.coli andthen evaluated by ELISA。Results2DE map ofK.pneumoniaewas obtained.The protein spot that reacted to pAbs of K.pneumoniaebut unreacted to other pAbs in Western blotting was identified by mass spectrometry to be acid phosphatase (GI:238894261).The protein was subsequently expressed and purified.ELISA results had certified its high specificity and sensitivity。ConclusionAcid phosphatase ofK.pneumoniaeis the novel protein antigen for specific diagnosis of its infection.
Mice;Diagnosis;Specific antigen;Two dimension electrophoresis(2DE);Western blotting;Enzymelinked immunosorbent assay(ELISA)
Q939.91
A
1671-7856(2010)07-0021-06
2010-03-29
中央级公益性科研院所基本科研业务费专项资金 (DWS200705)。
李挺(1981-),男,硕士生,研究方向:病原生物的血清学与分子生物学。E-mail:lit@cnilas.org
李万波。E-mail:li_wanbo2006@yahoo.com.cn

