普通变异型免疫缺陷病相关性间质性肾炎
徐 峰 曾彩虹
病例摘要
病史 24岁女性患者,因“血清肌酐(SCr)升高、血红蛋白(Hb)和血小板(PLT)减低21d”于2012-11-26 入院。
患者于2012年10月无明显诱因出现咳嗽、咳痰,白色痰不易咳出,伴流涕,无发热,2012-11-09 外院 查 SCr 293.2 μmol/L,尿 素 氮 (BUN)17.07 mmol/L,尿酸(UA)601.2 μmol/L,Hb 83 g/L、PLT 96×109/L,胸部CT示两肺炎性病变,予头孢他啶和阿奇霉素抗感染治疗,2012-11-18查尿常规蛋白1+、隐血3+,SCr 331 μmol/L,BUN 17.8 mmol/L,UA 596 μmol/L,血清白蛋白(Alb)38.7 g/L,血HCO-315 mmol/L,血磷1.68 mmol/L,ANA、抗中性粒细胞胞质抗体(ANCA)、抗肾小球基膜(GBM)抗体阴性,予保肾、活血化淤及纠正贫血处理,2012-11-26 收入院,病程中,患者精神一般,常有乏力及头晕,食欲、睡眠正常,体重无变化,大便及尿量正常,无尿频、尿急、尿痛,无夜尿增多,无高血压、鼻衄、黑便、皮肤淤斑,无发热、皮疹、关节痛。
既往史 否认肝炎、结核、疟疾等传染病史,否认高血压、糖尿病等病史,预防接种史不祥。个人史无特殊。
家族史 父母体健,1兄患甲状腺功能亢进,余兄姐均体健,否认家族中同样疾病患者,否认家族性遗传病史。
体格检查 体温 37℃,血压100/60 mmHg,心率93次/min,体质量指数(BMI)18.06 kg/m2。发育正常,营养中等,全身皮肤、黏膜无黄染,颜面部无水肿,浅表淋巴结未扪及肿大,甲状腺无肿大。双肺呼吸音清,未闻及干湿啰音和胸膜摩擦音。心律齐,未闻及心脏杂音。腹部平软,无压痛及反跳痛,未触及包块,肝肋下未触及,脾肋下三指,无触痛,移动性浊音阴性。脊柱、四肢无畸形,双下肢无水肿。
实验室检查
血常规 Hb 82 g/L,白细胞计数4.1×109/L,淋巴细胞22%,中性粒细胞比例71%,PLT 56×109/L。
尿液 蛋白定量0.62 g/24h,尿沉渣红细胞计数1.0 万/ml;C3 2 mg/L,α2巨球蛋白 3.19 mg/L,N-乙酰-β-D-氨基葡萄糖苷酶(NAG)12.9 u/(g·cr),视黄醇结合蛋白(RBP)12.2 mg/L,溶菌酶29.8 mg/L,HCO-39.0 mmol/L,肾损伤分子1(KIM-1)0.33 μg/L,白细胞介素 18(IL-18)86.34 ng/L,中性粒细胞明胶酶相关载脂蛋白(NGAL)1760.19 μg/L。尿本周蛋白阴性。
血生化 Alb 39.8 g/L,球蛋白7.0 g/L,BUN 17.32 mmol/L,SCr 332.4 μmol/L,UA 727 μmol/L,胱抑素 C 3.90 mg/L,总胆红素7.3 μmol/L,间接胆红素 4.8 μmol/L,直接胆红素 2.5 μmol/L,谷丙转氨酶 5 U/L,谷草转氨酶 11 U/L,碱性磷酸酶61 U/L,γ谷酰转肽酶9 U/L,乳酸脱氢酶120 U/L,磷酸肌酸激酶7 U/L,总二氧化碳19.1 mmol/L,钠141.0 mmol/L,钾 3.95 mmol/L,氯 107.9 mmol/L,铁 6 μmol/L,未饱和铁结合力 48 μmol/L,总铁结合力 54.0 μmol/L。
免疫学检验 IgG 0.624 g/L,IgA 0.255 g/L,
IgM 0.523 g/L,IgE < 20.0 IU/ml,补 体 C3 0.52 g/L,C4 0.04g/L,ANA、A-dsDNA、ANCA、抗GBM抗体阴性,抗心肌磷脂抗体ACL阴性。甲状腺功能测定:三碘甲腺原氨酸(T3)0.98 nmol/L(正常值1.23~3.07 nmol/L),甲状腺素(T4)85.25 nmol/L(正常值71~161 nmol/L),促甲状腺激素(TSH)1.52 mIU/L(正常值 0.3~4.5 mIU/L),甲状旁腺激素(PTH)10.6 pmol/L(正常值1.3~9.3 pmol/L);出血热特异性抗体(IgG、IgM)阴性;C3肾炎因子检测阴性;抗补体H因子抗体检测阴性;抗C1q抗体:2.98 U/ml,游离轻链 κ 17.2 mg/L;游离轻链λ 57.98 mg/L;免疫固定电泳图谱未见明显异常单克隆免疫球蛋白条带。
流式细胞学检查 CD20+46个/μl(正常值125.22±51.55个/μl),4.8%(正常值11.00% ±2.91%)。
辅助检查
双肾超声 左119 mm×43 mm×59 mm,右92 mm×30 mm×46mm,皮质厚度不清,皮质回声增强。双肾肾动脉循环阻力增高,静脉未见异常。
腹部B超 肝胆胰声像图未见占位;脾大;门静脉及脾静脉扩张。
心脏彩超 极少量心包积液。
CT 胸部CT:两肺弥漫性病变,并双侧胸腔积液,考虑感染;纵隔及左侧腋下淋巴结肿大;心包少许积液;脾肿大。腹部CT:双侧腹股沟区多发大小不等淋巴结,腹膜后软组织影,不除外迂曲扩张的静脉,建议增强检查;门静脉高压,脾大;左侧附件区囊肿或滤泡可能;盆腔少量积液。双肾ECT:左肾滤过功能减低,肾小球滤过率(GFR)22.3 ml/(min·1.73m2);右肾滤过功能减低,GFR 11.6 ml/(min·1.73m2)。
心电图 大致正常心电图。
病原学检查 痰涂片真菌镜检阴性;痰涂片革兰染色阴性;痰培养未见细菌生长;真菌G试验、GM试验阴性。T-spot试验阴性及PPD试验阴性。
骨髓检查 细胞学示缺铁性贫血伴巨核系成熟欠佳。活检示:“左髂前上棘”骨髓增生明显活跃;免疫组化CD68散在阳性,CD20、CD3、CD138阴性。
肾活检
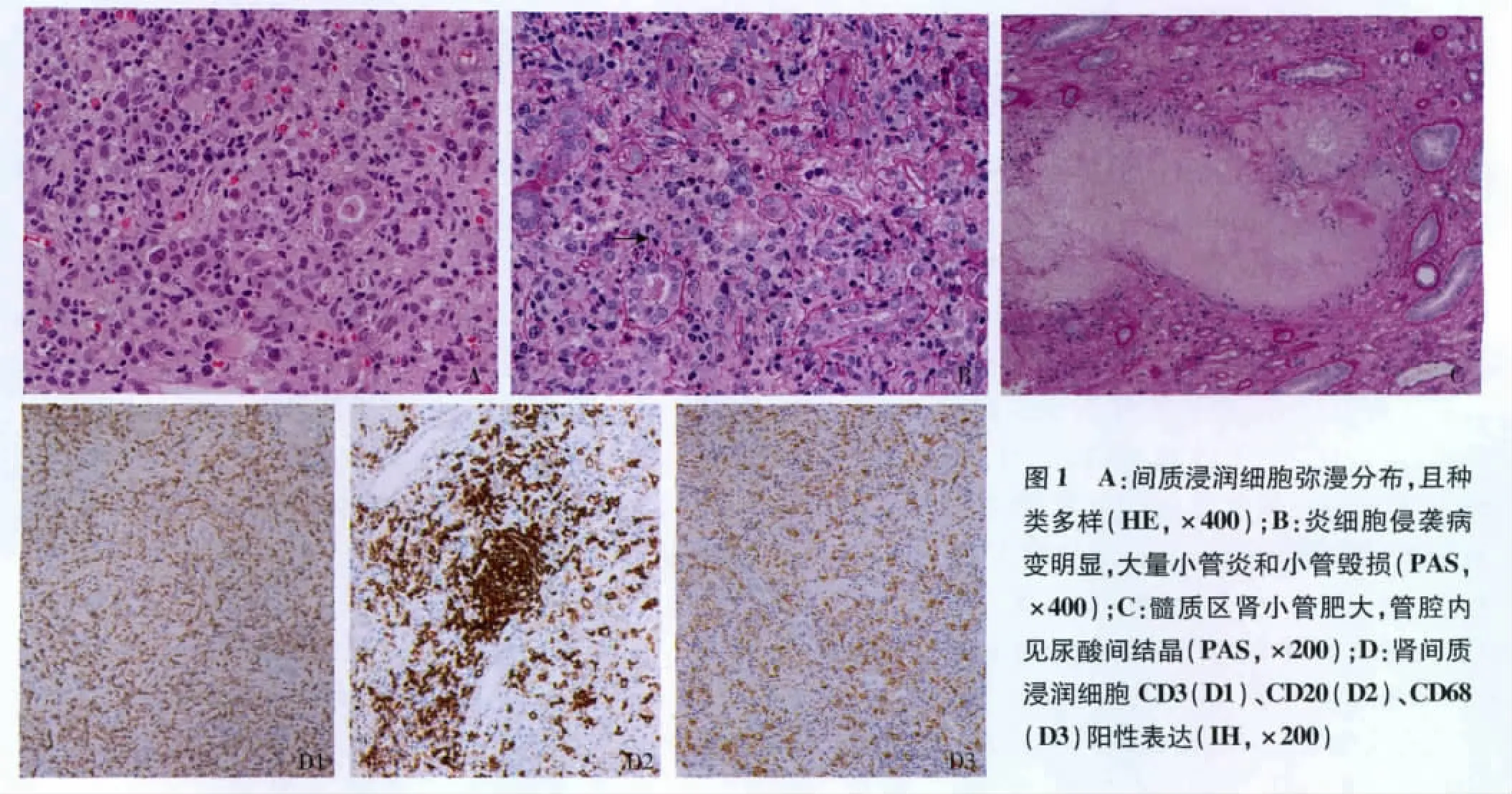
光镜 皮-髓和髓质肾组织各1条,未见肾小球。皮质区弥漫细胞浸润,包括单个核细胞、嗜酸性粒细胞及中性粒细胞(图1A),亦见较多核形态异常的细胞,数处见核分裂相,亦见滤泡样结构,大量小管炎和小管毁损(图1B)。残留的肾小管肥大。髓质区慢性病变中度,数处肾小管管腔内见尿酸盐结晶(图1C),周围见细胞反应,间质纤维化++。动脉未见明确病变。
冰冻组织切片PAS染色见5个肾小球,1个球性废弃,4个肾小球毛细血管袢皱缩明显,囊腔相对扩大,囊壁增厚、分层。肾间质亦见大量浸润细胞。
肾组织和皮肤刚果红染色阴性。
免疫组织化学 肾间质浸润细胞CD3、CD4、CD8、CD68、CD20及增生细胞核抗原(PCNA)阳性,细胞角蛋白阴性(图1D)。
免疫荧光 4个肾小球,其中1个球性硬化,冰冻切片荧光染色 IgG、IgA、IgM、C3、C1q、κ及 λ轻链、IgG亚型染色均阴性。
电镜 观察1个肾小球。肾小球系膜区增宽不明显,系膜区见少量颗粒状物质,直径45~70 nm。肾小球毛细血管袢开放好,基膜厚355~535 nm,袢腔内见中性粒细胞,基膜内皮下、膜上及系膜区未见电子致密物沉积。肾小球足细胞足突节段融合30% ~40%,少量微绒毛化,胞质内见吞噬性溶酶体,偶见双核足细胞。间质大量炎细胞浸润,以淋巴细胞和巨噬细胞为主。部分肾小管基膜断裂,小管毁损。
小结:间质性肾炎(慢性病变基础上合并活动性病变)。
讨 论
分析肾活检病理特点 该患者病变主要在肾间质区域,间质弥漫浸润细胞同时存在慢性病变,组织学符合间质性肾炎,光镜特点如下:(1)皮质区弥漫浸润细胞,且浸润细胞种类多样;(2)炎细胞侵袭病变明显,肾小管正常结构破坏;(3)髓质区慢性化病变显著,肾小管代偿性肥大、管腔内见尿酸盐结晶。免疫荧光染色未见免疫球蛋白和补体沉积。电镜下肾小球病变轻,间质区域大量浸润细胞,肾小管基膜断裂。
寻找肾脏损害的病因 间质性肾炎的最终诊断需结合临床进一步寻找病因。多种因素均可导致间质性肾炎,如药物、感染、肿瘤、自身免疫性疾病及代谢性疾病等,其中药物导致的间质性肾炎最常见,其浸润细胞以T淋巴细胞为主,存在过敏反应时可伴嗜酸性粒细胞,有的药物还会在远端肾小管内形成结晶。该患者除T淋巴细胞和嗜酸性粒细胞外,还有较多的巨噬细胞、中性粒细胞及前体B淋巴细胞浸润,药物导致的间质性肾炎则很少出现如此多样的浸润细胞种类及侵袭性病变。
该患者肾间质中存在核异形细胞,并见核分裂相,是否为恶性肿瘤所致?累及肾脏的恶性肿瘤分为实质性肿瘤和血液系统肿瘤,实质性肿瘤如肾脏转移,常会形成局部包块,可有影像学证据,且肿瘤细胞有原发部位的形态学特征;肾脏最常见的肿瘤为肺癌、卵巢癌、胃肠道癌等上皮来源的肿瘤。该患者浸润细胞CK阴性,且影像学检查未见占位,因此肿瘤转移的可能性不大。间质中存在的核异形细胞主要表达CD68和CD20,考虑为巨噬细胞和前体B淋巴细胞。血液系统肿瘤如淋巴瘤、白血病累及肾组织时,肾间质或肾小球可出现肿瘤细胞的浸润,但浸润的肿瘤细胞通常形态较一致,一般不会出现形态种类多样的浸润细胞。骨髓瘤导致的肾脏损害包括管型肾病、轻链/重链或轻重链沉积病、肾淀粉样变性及肾小管轻链病等,通常有游离轻链κ、λ或IgG亚型等染色阳性,但该患者并未见上述特征性病变。
自身免疫性疾病也可导致间质性肾炎,如系统性红斑狼疮、干燥综合征、ANCA相关性血管炎、肾小管间质性肾炎-眼色素膜炎综合征(TINU综合征)等。狼疮性肾炎(LN)通常存在肾小球病变,免疫荧光多为“满堂红”,也有LN仅表现为间质性肾炎,但其浸润细胞主要为淋巴细胞。干燥综合征以单个核细胞浸润为主,TINU综合征则以T淋巴细胞浸润为主。诊断自身免疫性疾病首先要有多系统受累症状和(或)自身抗体阳性的证据。该患者虽然累及多系统,但多种自身抗体均阴性,故并不支持自身免疫性疾病的诊断。
该患者胸部CT见双肺的弥漫病变,临床疑似真菌感染,肾组织浸润细胞是否为特殊病原体感染所致?肾脏感染包括非特异性和特异性,非特异性的感染如肾盂肾炎,组织学可见大量扩张的肾小管,管腔内见脓细胞管型,肾小管周围中性粒细胞的聚集,临床可出现发热、腰痛、尿频、尿急、尿痛等症状,而该患者肾小管未见白细胞管型,无尿路感染的相关症状,因此可排除尿路感染。特异性的感染如真菌、结核杆菌,会有特征性的肉芽肿样病变和干酪样坏死,本例并无坏死、多核巨细胞及肉芽种样病变。
IgG4相关系统性疾病是新近认识的临床综合征,可累及多个系统和器官(如胰腺、肾脏、唾液腺、泪腺、肺及淋巴结等),肾脏受累时表现为间质性肾炎,以单个核细胞和浆细胞为主,亦可见较多嗜酸性粒细胞,但是IgG4相关系统性疾病免疫球蛋白水平升高,而该患者免疫球蛋白和补体低下并不符合,同时肾组织IgG及亚型染色均为阴性,因此亦不符合IgG4相关系统性疾病。
结合临床特点进行诊断 以上常见的病因似乎都无法解释该患者的间质性肾炎,因此我们重新分析临床资料,发现其存在多系统异常:(1)血液系统:贫血、PLT低下,骨髓细胞学检查示缺铁性贫血伴巨核系成熟欠佳;(2)免疫系统:免疫球蛋白和补体低下,脾肿大,多处淋巴结肿大;(3)泌尿系统:肾功能不全,少量蛋白尿;(4)呼吸系统:双肺弥漫病变。其中低球蛋白血症和低补体血症突出,提示该患者存在体液性免疫缺陷。
免疫缺陷病是先天遗传或后天损伤所导致的一组综合征,表现为免疫活性细胞或免疫应答分子的缺陷,可发生反复感染,或者由于免疫监视和免疫自稳功能异常,易患自身免疫性疾病和肿瘤。免疫缺陷病包括原发和继发。继发性免疫缺陷病的因素多样,包括感染、恶性肿瘤、自身免疫性疾病、蛋白丧失过多或合成不足及免疫抑制治疗等。但该患者临床并未发现导致免疫缺陷的继发因素。
原发性免疫缺陷病(PID)主要与遗传和免疫系统先天发育不良有关,目前已发现120余种类型,与150多种基因缺陷有关,据国际免疫学会联合会(IUIS)2011年公布的最新分类标准[1],将PID分为八类:(1)联合免疫缺陷;(2)已明确的免疫缺陷综合征;(3)抗体缺陷为主的免疫缺陷;(4)免疫失调性疾病;(5)先天性吞噬细胞数目和功能缺陷;(6)天然免疫缺陷;(7)自身炎症性疾病;(8)补体缺陷。
对照该患者,属于抗体缺陷为主的免疫缺陷,原发性免疫缺陷病中最常见的疾病为X连锁无丙种球蛋白血症、普通变异型免疫缺陷病。X连锁无丙种球蛋白血症发生于男性,表现为反复感染,外周血CD19或CD20表达率<1%,而该患者为女性,且流式细胞检查外周血B淋巴细胞比例为4.8%,可排除X连锁无丙种球蛋白血症。
普通变异型免疫缺陷病(CVID)是一组发病机制不明的疾病,男女均可发病,多见于青壮年,表现为低免疫球蛋白血症,B细胞数减少,反复感染,易患贫血、PLT减少和中性粒细胞减低,约1/3的患者有肝脾肿大和弥漫性淋巴组织增生。CVID的诊断标准分为可以诊断和可能诊断。可以诊断标准为:患者血清IgG和(或)IgA水平明显降低(至少低于相应年龄均值2个标准差),并符合以下全部标准:(1)>2岁发病;(2)缺乏同族血凝素和(或)对疫苗应答反应差;(3)排除其他可导致低丙种球蛋白血症的原因(表1)。可能诊断标准:血清主要免疫球蛋白(IgG、IgA、IgM)中一种明显降低(至少低于相应年龄均值2个标准差),并符合以下全部标准:(1)>2岁发病;(2)缺乏同族血凝素和(或)对疫苗应答反应差;(3)排除其他可导致低丙种球蛋白血症病因原发性免疫缺陷病(表1)。该患者有贫血、PLT减低、脾肿大,血清IgG和IgA均明显降低,无明确的其他可导致低丙种球蛋白的因素,综合以上因素可诊断CVID。
CVID累及肾脏的报道较少,且无特征性病理改变,因此难以总结其肾脏病理特点。多数报道为肾间质非坏死性肉芽肿样病变[2,3],除肾脏外,肺、淋巴结、皮肤、骨髓亦可见肉芽肿样病变[4],肉芽肿样病变中央为多核巨细胞和类上皮细胞,周围淋巴细胞浸润和纤维组织分布,形成完整的结节。结节病也是一种累及多个器官的肉芽肿性疾病,CVID肉芽肿样病变与结节病有许多共同的特点,因此有人认为CVID患者出现的肉芽肿样病变其实是CVID合并结节病。但也有人认为CVID肉芽肿样病变与结节病是两种不同的疾病。该患者有肺的弥漫性病变和淋巴结的肿大,是否存在肉芽肿样病变,需行淋巴结和肺活检进一步明确,遗憾的是患者拒行肺活检。

表1 低丙种球蛋白血症的鉴别诊断
此外,也有零星报道CVID组织学表现为肾小球系膜增生样病变伴免疫复合物沉积、膜性病变、淀粉样变性,合并栓塞性微血管病等[5-10],Stigant等[8]报道1例CVID患者同时存在肉芽肿样病变和肾小球系膜增生性病变,伴免疫球蛋白沉积。Yim[10]报道了1例临床为肾病综合征的CVID患者,肾活检组织学为膜性病变,作者在排除继发因素后,推测与CVID并发自身免疫性疾病有关。Aghamohammadi等[7]报道1例AA型淀粉样变性,认为与反复感染导致的慢性炎症有关。Liu等[11]报道1例21岁青年女性CVID患者,有反复感染、肝脾肿大,肾脏肿大和肾功能不全等临床表现,组织学为间质弥漫浸润细胞,以CD8+的T细胞和CD68+的巨噬细胞为主,少量CD4+的T细胞和罕见的B细胞。
该患者间质浸润细胞同样呈弥漫性分布,但CD4、CD8、CD20、CD68 阳性细胞均较多见,偶见淋巴滤泡样结构,未见肉芽肿样病变。免疫荧光免疫球蛋白和补体染色阴性,刚果红染色阴性,组织学肾小球和间质血管未见血栓性微血管病样病变。结合其临床特点考虑CVID相关肾脏损害,而双肺和淋巴结的病变性质,需要在今后的临床过程中进一步随访观察。
1 Al-Herz W, Bousfiha A, Casanova JL, et al. Primary immunodeficiency diseases:an update on the classification from the international union of immunological societies expert committee for primary immunodeficiency.Front Immunol,2011,2:54.
2 KanathurN,Byrd RP Jr,Fields CL,etal. Noncaseating granulomatous disease in common variable immunodeficiency.South Med J,2000,93(6):631-633.
3 Fakhouri F,Robino C,Lemaire M,et al.Granulomatous renal disease in a patient with common variable immunodeficiency.Am J Kidney Dis,2001,38(2):E7.
4 Morimoto Y,Routes JM.Granulomatous disease in common variable immunodeficiency.Curr Allergy Asthma Rep,2005 ,5(5):370-375.5 Meyer A,Lachmann HJ,Webster AD,et al.Hypercalcemia in a patient with common variable immunodeficiency and renal granulomas.Am J Kidney Dis,2005 ,45(5):e90-93.
6 Benoit G,Lapeyraque AL,Sartelet H,et al.Renal granuloma and immunoglobulin M-complex glomerulonephritis:a case of common variable immunodeficiency?Pediatr Nephrol,2009,24(3):601-604.7 AghamohammadiA,ShafieiA,AbolhassaniH,etal.Renal amyloidosis in common variable immunodeficiency.Nefrologia,2010,30(4):474-476.
8 Stigant C,Sapir D,Sweet J,et al.A unique renal lesion in common variable immunodeficiency.Clin Nephrol,2002 ,57(1):74-79.
9 Miloševic'B,Stojanovi c'V,Nikoli c'M,et al.Common variable immunodeficiency complicated with hemolytic uremic syndrome.Ups J Med Sci,2012 ,117(1):67-71.
10 Yim HE,Yoo KH.Membranous nephropathy in a 13-year-old boy with common variable immunodeficiency.J Korean Med Sci,2012,27(11):1436-1438.
11 Liu S,Zhang QD,Zhang DL,et al.An unusual cause of renomegaly and renal insufficiency:a case report of renal involvement in common variable immunodeficiency disease.Ren Fail,2011,33(1):92-95.

