电针介导eNOS动员内源性EPCs促MCAO/R大鼠脑内血管再生
朱艳含,罗勇 ,胥虹贝,王盼欣
(重庆医科大学附属第一医院神经内科 重庆市神经病学重点实验室,重庆 400016)
缺血性卒中(ischemic stroke),约占全部脑卒中的70%,严重威胁着人类的生命健康。如何改善急性脑缺血后的血供,增加缺血区的血管再生从而促进神经功能的恢复日益成为现今研究的热点。内皮祖细胞(endothelial progenitor cells,EPCs)是近年来发现的具有较强促血管再生能力的一种干细胞。研究表明,EPCs 主要存在于机体的骨髓中,在某些病理生理环境下,可以从骨髓动员至外周血循环[1]。当机体发生急性脑梗死时,如何更加有效地调动内源性(即骨髓内)EPCs 参与脑梗死后的血管再生是目前研究的热点之一。前期研究发现电针可促进脑梗死大鼠的血流恢复及血管再生,并改善其神经功能症状[2-4,13],但具体机制尚不十分明确。研究表明,eNOS 的磷酸化可促进NO 的释放并激活MMP-9,进而促进内源性EPCs 的释放[5-6]。本研究将电针与eNOS 通路相结合来研究局灶脑缺血/再灌注后内源性EPCs 的动员情况,进一步探讨电针治疗脑梗死的机制。
1 材料与方法
1.1 实验动物及分组
SPF 级成年雄性SD 大鼠100 只,250 ~300 g,由重庆医科大学动物中心【SCXK(渝)2012-0002】提供,重庆医科大学附属第一医院实验研究中心【SYXK(渝)2010-0002】提供实验操作平台,并按实验动物使用的3R 原则给予人道的关怀。100 只大鼠随机分为正常组(N 组)、模型组(I/R 组)、模型+电针组(I/RE 组)、模型+电针+L-NAME 组(I/REL 组),除N 组外的其余三组根据局灶脑缺血1.5 h 再灌注后的观察时间点,分为1、2、7 d 三个亚组,各亚组10 只。
1.2 主要试剂
兔抗大鼠VEGFR2 抗体购自CST 公司,Biotin-KDR 购自Novus Biology 公司,FITC-链球菌抗生物素蛋白购自eBiosciense 公司,小鼠抗大鼠CD34 抗体购自Santa Cruz Biotechnology 公司,L-NAME 购自北京碧云天公司,免疫组化试剂盒购自北京中杉金桥生物技术有限公司,荧光定量PCR 相关试剂购自Takara 公司。
1.3 动物模型制备及评判标准
线栓法制备大鼠右侧大脑中动脉局灶脑缺血/再灌注模型(middle cerebral artery occlusion/reperfusion,MCAO/R)[7-8]。缺血1.5 h。大鼠清醒后根据Longa 等[9]5 分制评分标准对大鼠进行评分。以评分为2、3 分为纳入标准。因各种原因不能纳入实验的大鼠,相应组别通过随机抽样原则补齐。
1.4 电针刺激方法及腹腔给药
针刺方法:选择大鼠“百会”穴(GV 20)及左侧“四关”穴(合谷LI 4/太冲LR 3)作为针刺穴位。取华佗牌不锈钢银针(直径为0.38 mm,长度为1 寸)一根斜刺“百会”穴;两根直刺“合谷”穴,间距约2 mm;两根直刺“太冲”穴,间距约2 mm。连接电针治疗仪,频率为2/20 Hz,波型为疏密波,针刺20 min,每日一次,强度以大鼠左侧肢体轻微颤动为宜。腹腔注射L-NAME(eNOS 抑制剂):造模成功后,立即给予药物抑制组大鼠腹腔注射L-NAME,注射浓度为8 mg/kg,配药浓度为8 mg/mL (每8 mg 的LNAME 溶于1 mL 的生理盐水)[10]。
1.5 取样及检测
1.5.1 取材
每组取5 只大鼠到相应观察时间点时,采集腹主动脉血约2 mL,流式细胞学检测备用;预冷的PBS 冲出双侧后肢骨腔中的骨髓细胞,并调整细胞数在1 ×106~1×107左右,流式细胞学检测备用;流式取材完毕立即断头取脑,取大脑中动脉供血范围的缺血大脑皮质,-80℃保存,荧光定量PCR 备用。各组其余5只大鼠到相应观察时间点时,经左心室内固定脑组织,取视交叉前后2 mm 脑组织作石蜡切片。
1.5.2 流式细胞术检测外周血及骨髓EPCs 数量(EPCs 占单核细胞数量的百分比)
取外周血及骨髓细胞悬液各100 μL,分别加1 μL 兔抗大鼠VEGFR2 抗体避光孵育30 min,继而加2 mL 红细胞裂解液避光孵育5 min,4℃下1500 r/min 离心5 min,弃上清,2 mL PBS 重悬离心洗涤2次之后,加FITC 标记的二抗避光孵育30 min,2 mL PBS 重悬离心洗涤之后用100 μL PBS 重悬细胞沉淀,流式细胞仪上机检测EPCs 数量。
1.5.3 荧光定量PCR 技术检测缺血大脑皮质VEGFR2 mRNA 的表达
将保存于-80℃的缺血大脑皮质取出,按Takara 说明书提取总RNA,并逆转录成20 μL 体系的cDNA。据GenBank 提供的序列,扩增大鼠VEGFR2 mRNA的上游引物为5′-GGAAAGGGTGTT GGTGACTG-3′,下游引物为5′-GGTGTCCCGATAGAAGCACT-3′,产物长度112 bp。扩增条件为预变性95℃30 s,PCR 反应95℃5 s、60℃30 s,40 个循环。
1.5.4 免疫组化法检测脑缺血区VEGFR2 阳性细胞表达及CD34 微血管计数
根据免疫组化试剂盒步骤对脑组织石蜡切片进行处理。结果的判定:VEGFR2 阳性细胞:采用Image-Pro Plus 16.0 图像测量分析软件计算VEGFR2阳性细胞数(个/HP)。微血管密度:所有切片均编号,取非连续的3 张切片,每张切片读取2 个非连续视野数值。缺血区微血管计数(microvessel count,MVC)结果的判定:在200 倍视野下观察,染成棕褐色或棕黄色的细胞或细胞簇,直径<20 μm,与相邻的血管分界清楚,均认为是1 条微血管。由第一作者和另2 名经过专业训练的专业技术人员观察计数,微血管数(个/HP)为每个视野下的血管数。
1.5.5 统计学分析
2 结果
2.1 大鼠外周血VEGFR2+EPCs 数量变化情况
大鼠局灶脑缺血/再灌注损伤后I/R 组外周血VEGFR2+EPCs 数量明显高于N 组(P <0.05,P <0.01);I/RE 组在各时间点与I/R 组相比均具有统计学差异(P <0.01,P <0.05);而I/REL 组的VEGFR2+EPCs 数量相比I/RE 组则显著降低(P <0.01)。见图1。
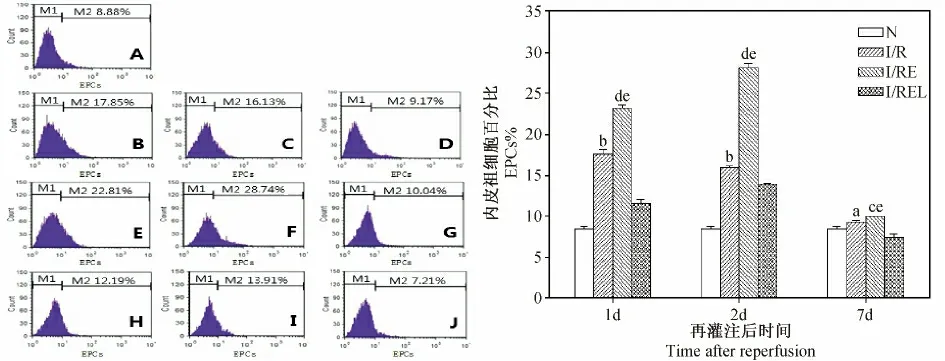
图1 各组大鼠外周血VEGFR2 +EPCs 数量的比较Fig.1 Comparison of VEGFR2 +EPCs percentage in the rat peripheral blood of each group
2.2 大鼠骨髓VEGFR2+EPCs 数量变化情况
大鼠局灶脑缺血/再灌注损伤后1、2d I/R组骨髓VEGFR2+EPCs 数量明显高于N 组(P <0. 01),7d 时与N 组相比无差异(P >0. 05);I/RE 组在各时间点与I/R 组相比有显著差异(P<0. 01,P <0. 05);而I/REL 组 的VEGFR2+EPCs 数量相比 I/RE 组则显著降低(P <0. 01)。见图2。
2.3 大鼠局灶大脑缺血皮质区VEGFR2 mRNA及VEGFR2 阳性细胞表达情况
与N 组比较,I/R 组各时间点VEGFR2 阳性细胞表达均增高(P <0.01);I/RE 组各时间点VEGFR2 mRNA 的表达量及VEGFR2 阳性细胞表达较I/R 组均明显增高(P <0.01);当eNOS 被抑制后,电针促VEGFR2 mRNA 及VEGFR2 阳性细胞表达作用则明显降低(P <0.01)。见图3、表1。
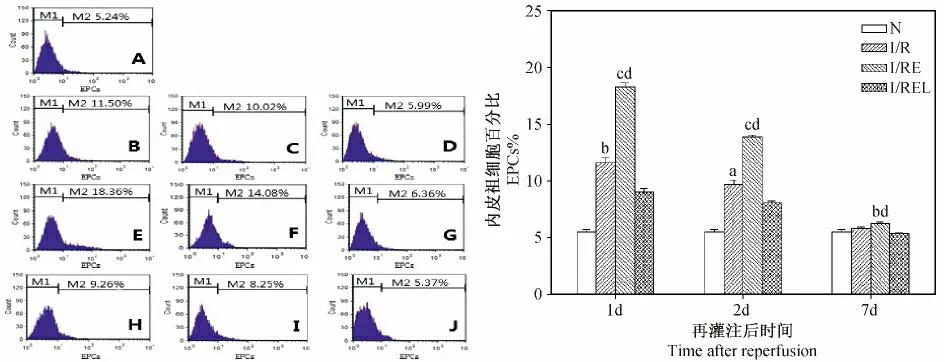
图2 各组大鼠骨髓VEGFR2 +EPCs 数量的比较Fig.2 Comparison of VEGFR2 +EPCs percentage in the rat bone marrow of each group
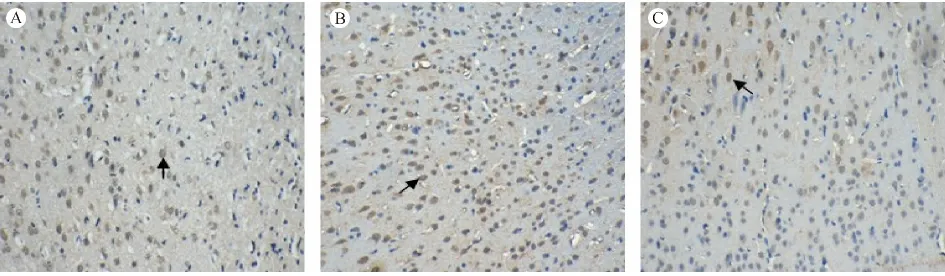
图3 各组大鼠缺血脑皮质区VEGFR2 阳性细胞表达情况(×200)Fig.3 VEGFR2-positive cells in the ischemic cerebral cortex of rats in each group(×200)
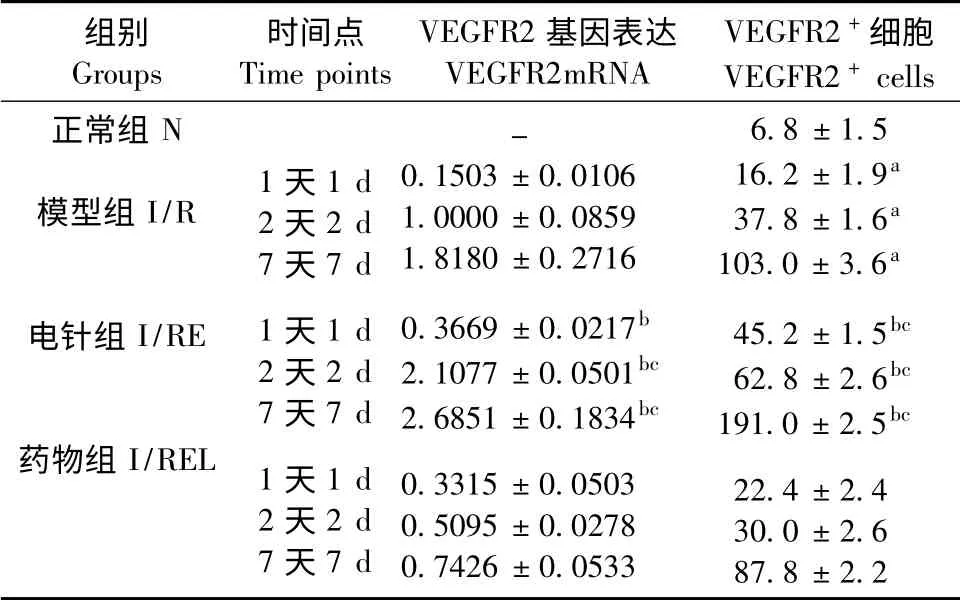
表1 各组大鼠缺血皮质区VEGFR2 mRNA 及VEGFR2阳性细胞的表达Tab.1 The expression of VEGFR2 mRNA and VEGFR2 +cells in ischemic cerebral cortex of the rats in each group
2.4 大鼠局灶大脑缺血皮质区CD34 微血管计数
与I/R 组比较,I/RE 组各时间点CD34 微血管计数均显著增多(P <0.01),在eNOS 被抑制后电针促微血管生成的作用显著降低(P <0.01)。见图4。
3 讨论
在我国针刺用于治疗脑梗死已有数千年的历史。研究表明,电针可通过促骨髓干/祖细胞如EPCs 等的动员来参与缺血区血管的再生[11]。EPCs是血管内皮细胞的前体细胞,在成人主要存在于骨髓。在缺血缺氧等病理因素的刺激下,EPCs 可从骨髓动员出去,并归巢至缺血靶区参与血管再生[12-13]。现阶段关于可以准确代表EPCs 的表面标记物的研究尚未明确,一致认为VEGFR2、CD34、CD31、CD133 等为主要标记物,其中VEGFR2+EPCs具有较强的血管修复能力[14]。
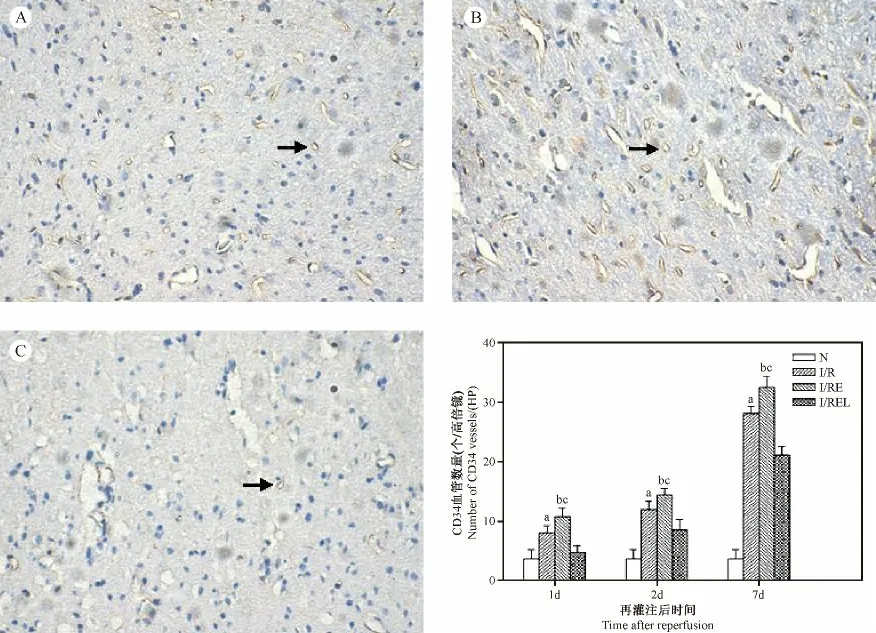
图4 各组大鼠缺血皮质区CD34 微血管计数的比较(×200)Fig.4 Comparison of the number of CD34 +blood vessels in ischemic cerebral cortex in the rats of each group(×200)
张彤等[15]发现电针预处理可上调局灶脑缺血/再灌注后大鼠骨髓及外周血中VEGFR2+EPCs 数量,推测电针对脑梗死的修复作用与对EPCs 的动员有关;孙宏毅等[12]研究表明电针治疗后局灶脑缺血/再灌注大鼠骨髓及外周血中VEGFR2+EPCs 数量明显增高,推测电针动员EPCs 可促脑缺血区血管再生。此外,电针还可以上调局灶脑缺血/再灌注大鼠外周血中VEGFR2+PECAM-1+EPCs、VEGFR2+CD31+EPCs、CD34+EPCs 等的数量,从而促进血管再生[16-18]。组织发生缺血后,是通过何种途径将骨髓龛内处于静止状态的EPCs 激活并动员至外周血,进而参与缺血组织的血管再生,是目前研究的热点。
研究表明,eNOS 在干/祖细胞的动员及缺血组织的保护中起关键作用。Kim 等[19]发现电针提高小鼠局灶脑缺血后的脑血流量及改善神经功能缺损症状的作用,在敲除eNOS 基因的小鼠体内明显受到抑制。Cui 等[6]发现eNOS 可以促进脑梗死后的血管再生,敲除eNOS 基因的小鼠脑梗死后较野生型小鼠死亡率增高,神经功能缺损症状更为明显,在使用NO 供体DETA-NONOate 后明显改善。Aichner等[20]发现缺乏eNOS 的小鼠,VEGF 诱导的EPCs 的动员能力显著降低。同时,研究表明SDF-1α 对EPCs 的动员作用,亦可在eNOS 被阻断后受到抑制[21]。提示eNOS 在EPCs 的动员及缺血后脑保护中处于关键地位。故本研究旨在探讨电针对EPCs的动员作用及对脑梗死的保护作用是否是通过对eNOS 的调控来实现的。本研究结果发现,电针可以促进局灶脑缺血/再灌注大鼠骨髓及外周血中VEGFR2+EPCs 的数量,其中骨髓内VEGFR2+EPCs 数量随大鼠缺血时间的延长逐渐减少,而外周血中VEGFR2+EPCs 数量则是先有一个增多的趋势继而再减少,可能与VEGFR2+EPCs 在机体内先由骨髓内动员至外周血,之后又归巢到缺血脑区有关;同时,本研究发现电针上调大鼠缺血大脑皮质中VEGFR2 mRNA 及VEGFR2 阳性细胞数的表达,这种作用在eNOS 被阻断后受到抑制,有可能提示eNOS 被阻断后,电针促局灶脑缺血后VEGFR2 阳性细胞的归巢能力减弱;且电针治疗后大鼠缺血大脑皮质区微血管的数量生成增多,而电针的这种对脑梗死大鼠的保护作用在使用eNOS 抑制剂后明显减弱。研究表明,电针可上调eNOS 的表达[22]。故我们推断电针或可通过介导eNOS 的激活来促局灶脑缺血后骨髓EPCs 动员至外周血,上调骨髓及外周血中EPCs 数量,同时归巢到缺血脑区的EPCs 数量增加,进而促进缺血大脑皮质区的血管再生。
本研究对电针动员EPCs 的机制做了较为深入研究,既往研究发现电针一方面可以上调外周血及骨髓EPCs 的数量,另一方面可以上调VEGF、SDF-1α、eNOS 等一系列与EPCs 动员、归巢密切相关的因子,但大多未将电针动员EPCs 的机制与介导相关通路结合起来,仅是推测电针动员EPCs 是通过激活EPCs 动员相关因子来实现的,故本研究在既往的研究基础上,更加深入的探讨了电针动员内源性EPCs,进而归巢到缺血脑区参与血管再生的机制,发现使用eNOS 抑制剂L-NAME 后电针对局灶脑缺血大鼠EPCs 的动员作用及对脑血管的保护作用明显受到抑制。可见电针可通过介导eNOS 动员内源性EPCs 促局灶脑缺血大鼠脑内血管再生,进一步证明了电针治疗脑梗死的作用机理,为电针在临床上治疗脑梗死中提供坚实的理论依据。
[1]Asahara T,Masuda H,Takahashi T,et al. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization[J].Circ Res,1999,85(3):221 -228.
[2]Lu T,Luo Y,Sun H,et al. Electroacupuncture improves behavioral recovery and increases SCF/c-kit expression in a rat model of focal cerebral ischemia/reperfusion[J]. Neurol Sci,2013,34(4):487 -495.
[3]唐曦,刘小卫,殷坚,等. 全经针刺法对恢复期脑梗死脑血流动力学影响的临床研究[J]. 中国医药导报,2011,8(17):102 -105.
[4]周秀丽,范为民. 电针对脑缺氧缺血新生大鼠海马结构Nestin 与Brdu 表达的影响[J]. 中国医药导报,2008,5(27):9-11.
[5]Cui X,Chopp M,Zacharek A,et al. Role of endothelial nitric oxide synthetase in arteriogenesis after stroke in mice[J]. Neuroscience,2009,159(2):744 -750.
[6]Heissig B,Hattori K,Dias S,et al. Recruitment of stem and progenitor cells from the bone marrow niche requires MMP-9 mediated release of kit-ligand[J]. Cell,2002,109(5):625-637.
[7]罗勇,董为伟. Wistar 大鼠插线法局灶性脑缺血/再灌注模型的实验研究[J]. 重庆医科大学学报,2002,27(1):1-4.
[8]包新杰,赵浩,赵英杰,等. 线栓法插线深度对大鼠脑梗死模型制备的影响[J]. 中国实验动物学报,2011,19(3):233 -236.
[9]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84 -91.
[10]Li XL,Zou XM,Gao P,et al. Role of nitric oxide in ischemiareperfusion injury and acute rejection in rat intestinal transplantation[J]. Transplant Proc,2008,40(10):334 -3345.
[11]孙宏毅,罗勇,卢桃利,等. 电针对局灶性脑缺血/再灌注大鼠外周血和骨髓内皮祖细胞的作用[J]. 针刺研究,2012,37(3):179 -185.
[12]Orlic D,Kajstura J,Chimenti S,et al. Mobilized bone marrow cells repair the infarcted heart,improving function and survival[J]. Proc Natl Acad Sci U S A,2001,98(18):10344 -10349.
[13]谢宸宸,罗勇,高祥,等. 电针对局灶脑缺血/再灌注模型大鼠缺血海马区血管再生的影响及其机制[J]. 中国实验动物学报,2014,22(4):41 -46.
[14]Friedrich EB,Walenta K,Scharlau J,et al.CD34-/CD133+/VEGFR-2+endothelial progenitor cell subpopulation with potent vasoregenerative capacities[J]. Circ Res,2006,98(3):e20 -e25.
[15]张彤,林涛,王秀志,等. 电针预处理对脑缺血再灌注大鼠骨髓及血浆中EPCs 及VEGF 的影响[J]. 中国康复医学杂志,2009(5):428 -432.
[16]王秀志,张莉,蔡绍皙,等. 电针对脑缺血再灌注大鼠缺血局部脑血管形成的影响[J]. 针灸临床杂志,2010,26(8):61 -63.
[17]赵瑛,陈斯佳,于文娟,等. 电针刺激对脑缺血大鼠内源性EPCs 及相关血清细胞因子的影响[J]. 生物医学工程学杂志,2010,27(6):1322 -1326.
[18]谢宸宸,罗勇,庞月珊,等. 电针对局灶脑缺血/再灌注大鼠骨髓及外周血CD34+EPCs 的影响[J]. 针刺研究,2014,39(4):277 -282.
[19]Kim JH,Choi KH,Jang YJ,et al. Electroacupuncture acutely improves cerebral blood flow and attenuates moderate ischemic injury via an endothelial mechanism in mice[J]. Plos One,2013,8(2):e56736
[20]Aicher A,Heeschen C,Mildner-Rihm C,et al. Essential role of endothelial nitric oxide synthase for mobilization of stem and progenitor cells[J]. Nat Med,2003,9(11):1370 -1376.
[21]Zheng H,Fu GS,Dai T,et al. Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1alpha/CXCR4 via PI3K/Akt/eNOS signal transduction pathway[J]. J Cardiovasc Pharmacol,2007,50(3):274 -280.
[22]卢桃利,罗勇,孙宏毅,等. 电针对局灶脑缺血再灌注大鼠大脑皮质eNOS mRNA 及蛋白、MMP-9 蛋白表达的影响[J].基础医学与临床,2012,32(2):158 -163.

