放线菌A0101发酵产物中几丁质酶抑制剂的分离纯化及性质研究
顾东华,张洪斌,李秋萍,李 瑶,胡雪芹
(合肥工业大学医学工程学院,安徽 合肥 230009)
放线菌A0101发酵产物中几丁质酶抑制剂的分离纯化及性质研究
顾东华,张洪斌*,李秋萍,李 瑶,胡雪芹
(合肥工业大学医学工程学院,安徽 合肥 230009)
实验室前期初筛和复筛得到一株具有高抑制几丁质酶活性的放线菌A0101,本实验通过活性追踪的方法对A0101菌株的发酵产物进行分离纯化,经乙醇醇沉、透析、硅胶柱层析及SephadexG-15凝胶柱层析得到活性物质纯品,高效液相色谱法(high performance liquid chromatography,HPLC)检测显示其在保留时间4.1 min为一单峰,3,5二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法验证其抑制率为80.2%,红外光谱、核磁共振波谱氢谱(1H-nuclear magnetic resonance,1H-NMR)、质谱分析结果初步证明其为一个多羟基的糖类化合物。
几丁质酶;抑制剂;纯化;性质
几丁质是N-乙酰-葡萄糖胺以β-1,4糖苷键连接起来的直链多聚物,是节肢动物外骨骼、真菌细胞壁、细胞隔膜及线虫卵壳的主要组成组分[1]。几丁质酶是降解几丁质的关键酶类,能分解几丁质成几丁单糖或几丁寡糖,对多种生物的生长及发育过程起到重要的作用。如昆虫在幼虫蜕皮和化蛾的发育过程中需要几丁质酶部分降解外骨骼来完成其变态发育的过程[2];真菌需要几丁质酶降解子母细胞之间的隔以完成其出芽生殖过程[3]。几丁质酶抑制剂能特异性地结合几丁质酶并抑制其活性,阻止昆虫蜕皮以及真菌子母细胞的分离而起到杀虫和抗真菌作用[2-3]。同时由于几丁质代谢系统不是哺乳动物机体所必需的生命活动代谢系统[4],故以几丁质酶作为靶标的新型绿色生物杀虫剂及食品保鲜剂等具有对人畜无害、安全环保、高效低毒的优点,很大程度上保证了食品安全。这使得开发以几丁质酶作为靶标的高效低毒生物杀虫剂、抗真菌剂成为国内外关注的新热点,在农业、食品、环保等行业具有重要的应用前景。
目前,国外该领域的研究关注较多的是探索新筛选模型和对现有几丁质酶抑制剂进行结构修饰以获得新的抑制剂[5]。通常天然产物分子质量较大,难以有效合成,但是在发现新的酶抑制剂上能够提供很有价值的线索,Rush等[6]通过对已发现几丁质酶抑制剂精安芬(argifin)的深入研究,确定了其最小活性中心,并作为支架化合物构建出几种新的几丁质酶抑制剂;有报道指出18家族几丁质酶VhChiA的活性位点和酸性哺乳动物几丁质酶AMCase非常相似,这对研究哺乳动物来源的几丁质酶提供很好的借鉴[7];有学者在研究广谱几丁质酶抑制剂阿洛氨菌素的生物学活性时发现它是一种良好的抗哮喘药的前体物[8]。国内有关几丁质酶抑制化合物的研究还处在起步阶段,大多致力于产生菌的初筛和相关合成工艺的改进等。张洪斌等[9]利用平板透明圈法和3,5二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法,以棉铃虫几丁质酶作为筛选靶标对800多株菌株进行筛选,筛选出包括A0901#菌株在内的具有几丁质酶抑制作用的活性菌株29 株;陈志斌等[10]通过响应面法优化链霉菌A0901产几丁质酶抑制剂的发酵条件,优化后抑制率达67.58%;Huang Gangliang等[11]通过改进优化合成工艺,提高了回收率,实现了阿洛氨菌素的有效合成。尽管至今已报道的几丁质酶抑制剂已有多种,但是,由于其生产成本高、活性低、不易合成等原因,始终没有应用于工农业生产。
本研究通过建立稳定可靠的筛选模型,筛选得到一株具有高抑制几丁质酶活性的菌株,并对其所产活性物质进行初步的分离纯化,同时研究了活性化合物的相关理化性质,以期获得有效、易得的几丁质酶抑制化合物,为开发新型绿色生物杀虫剂、食品保鲜剂、抗真菌剂提供参考。
1 材料与方法
1.1 材料、菌种与试剂
家蚕购于安庆市潜山县蚕农。
放线菌A0101由本实验室在前期通过平板透明圈初筛和DNS比色复筛的筛选模型,以家蚕几丁质酶作为筛选靶标筛选得到,将菌种保存于-24 ℃甘油管中。
透析袋(截留分子质量为1 000 D) 生工生物工程(上海)股份有限公司;柱层析硅胶(分析级,100~200 目);Sephadex G-15 美国Pharmacia公司。
1.2 仪器与设备
Model201高效液相色谱仪 德国Rheodyne公司;HC-3018R高速冷冻离心机 科大创新有限责任公司;VFD2000真空冷冻干燥机 北京博医康实验仪器有限公司;ZHWY-2102恒温培养振荡器 上海智城分析仪器制造有限公司;LDZM立式压力蒸汽灭菌锅 上海申安医疗器械厂;HH-1恒温水浴锅 江苏金坛晶玻实验仪器厂;T6紫外分光光度计 新世纪北京普析通用仪器有限责任公司;W-1调节万用电炉 南通市长江光学仪器有限公司;CA-920-2超净工作台 上海净化设备厂。
1.3 方法
1.3.1 胶体几丁质的配制
称取2 g几丁质,加入20 mL质量浓度85 g/100 mL的浓磷酸,常温条件下放置48 h后,加蒸馏水稀释,反复冲洗至pH 5.0以上。最后调整几丁质终质量浓度为1 g/100 mL[9]。
1.3.2 粗酶液的提取
将蛹化后的蚕茧于25 ℃培养箱培养8~10 d后至蚕茧中的蛹将要化蛾前,收集蚕蛹于0.1 mol/L pH 6.0磷酸盐缓冲液中均质,冰水浴中超声1 s,间歇2 s,150 W破碎16 min,4 ℃、10 000 r/min离心30 min收集上清液[12]。
1.3.3 几丁质酶活力测定
几丁质酶分解胶体几丁质生成N-乙酰-D-氨基葡萄糖,以N-乙酰-D-氨基葡萄糖的生成速率测定酶活性大小。50 ℃条件下,每小时产生1 μmol/L N-乙酰-D-氨基葡萄糖所需酶量为一个酶活力单位(U)[13]。
在装有500 μL 1 g/100 mL胶体几丁质和500 μL 0.1 mol/L磷酸盐缓冲液(pH 6.0)的试管中(提前预热至45 ℃)加入500 μL酶液,于45 ℃温育1 h,沸水浴10 min中止反应,将沸水浴后的反应体系冰水浴冷却,冷却后加入1 500 μL DNS试剂,沸水浴20 min,冷却至室温后用蒸馏水定容到25 mL,摇匀,离心后取上清液,以灭活的等量酶液做空白对照,在540 nm波长处测定吸光度[10]。
1.3.4 抑制率测定
在酶反应体系中加入待测液,测定剩余酶活力,以灭活后的体系和原酶反应体系作为对照,根据酶活力是否下降以及下降的程度来判定抑制活性。几丁质酶抑制剂的抑制活性用抑制率计算,以吸光度的变化值表示酶活力(U)[10]。
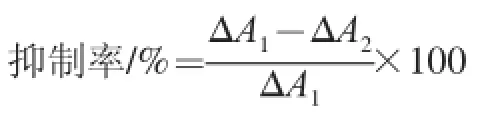
1.3.5 活性菌株的液体培养方法
将活化后的菌株接种于高氏一号液体培养基,30 ℃、250 r/min振荡培养5 d,发酵液6 000 r/min离心10 min,取上清液。
1.3.6 活性物质的初步分离
将发酵液抽滤取上清,浓缩后加入3 倍体积无水乙醇醇沉处理,4 ℃冰箱过夜;醇沉液6 000 r/min离心20 min,收集上清液浓缩到适当体积;用截留分子质量1 000 D的透析袋过夜透析3 次,收集透析液并浓缩冻干;在磁力搅拌的条件下用甲醇反复浸提多次再次冻干即得活性物质粗品。
活性物质粗品依次经硅胶柱层析、Sephadex G-15凝胶柱层析进一步精制得到纯品。采用DNS比色法及高效液相色谱法(high performance liquid chromatography,HPLC)检测确定活性组分区域。HPLC条件如下:Grace反相C18分离柱(4.6 mm×250 mm,5 μm),Model 201型紫外检测器;流动相甲醇-水(10∶90,V/V),流速0.6 mL/min;柱温30 ℃。
1.3.7 活性物质的初步鉴定
面对海量的数据和信息,新媒体要不断培养高素质的采编人才,对信息的甄别和收集能力有较高的要求。新媒体培养复合型采编人才,一方面,善于组织语言,把握大数据时代受众的心理变化;另一方面,善于借助大数据,从民众的信息发布中获取有效信息,核实并且深度挖掘后进行报道,提高信息采编效率。复合型采编人才要善于经营两微一端的媒体公共关系,营造良好的组织形象,获得民众的心理认同感,从根源树立媒体的威信。
收集活性组分并冻干,呈白色粉末状。将此纯品送分析测试中心进行红外光谱检测、核磁共振波谱氢谱(1H-nuclear magnetic resonance,1H-NMR)检测、质谱检测。
红外光谱扫描条件:KBr压片,常温(25 ℃)条件下测试。
核磁共振(1H-NMR)条件:样品用适量氘代水溶解,50%的四甲基甲硅烷(trimethyl silane,TMS)溶液作为内标液,在傅里叶变换核磁共振仪中操作。
质谱条件:EI离子源,离子源温度230 ℃;电离能量70 eV;发射电流34.6 μA;溶剂延迟3 min;扫描质量范围:20~500 u,扫描间隔:0.2 s。
1.3.8 活性物质的理化性质
将活性物质粉末分别用等量的蒸馏水、甲醇、乙醇、正丁醇、氯仿、乙酸乙酯、丙酮、石油醚试剂溶解,考察其溶解性。
1.3.9 pH值对抑制活性的影响
取11 个均装有5 mL待测液的离心管,依次调节pH值为2~12(醋酸-醋酸钠缓冲液pH 2.0~6.0;磷酸盐缓冲液pH 7.0~8.0;甘氨酸-氢氧化钠缓冲液pH 9.0~12.0)处理2 h,然后pH值均调至7,用DNS比色法测定其几丁质酶抑制活性。
1.3.10 温度对抑制活性的影响
取6 个均装有5 mL待测液的离心管,分别放置到40、50、60、70、80、90 ℃的水浴锅中水浴2 h,恢复至常温时用DNS比色法测定其几丁质酶抑制活性。
2 结果与分析
2.1 活性物质的分离纯化结果
2.1.1 硅胶柱层析结果
活性物质粗品硅胶柱层析结果如表1所示。经过硅胶柱层析后,活性物质主要存在氯仿-甲醇体积比分别为1∶1、3∶7两个洗脱组分中,合并两个组分浓缩后进行凝胶柱层析。

表1 硅胶柱层析结果Table 1 Results of silica gel column chromatography
2.1.2 Sephadex G-15凝胶色谱层析结果
经硅胶柱层析精制后,活性组分进一步经Sephadex G-15凝胶柱层析洗脱曲线如图1所示。通过逐管检测几丁质酶抑制活性,确定活性组分主要存在于12~18 管,浓缩、冻干后得到纯品粉末。活性物质纯品HPLC检测结果如图2所示,图谱显示活性物质的HPLC保留时间为4.1 min,经DNS比色法验证其几丁质酶抑制率为80.2%。
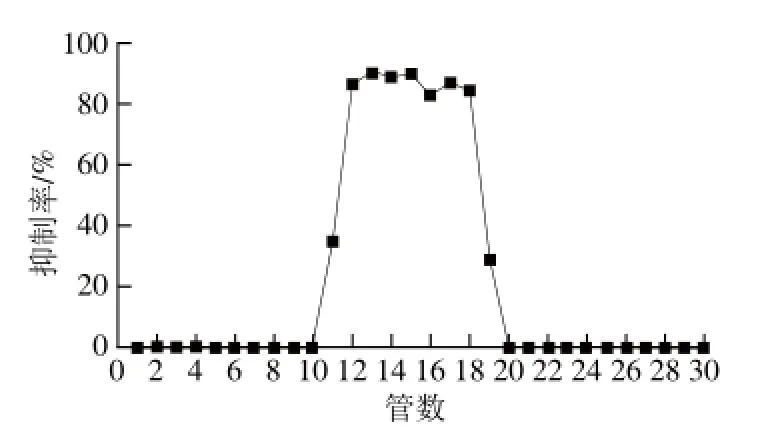
图1 Sephadex G-15凝胶柱层析洗脱曲线Fig.1 Elution curve of Sephadex G-15 gel column chromatography
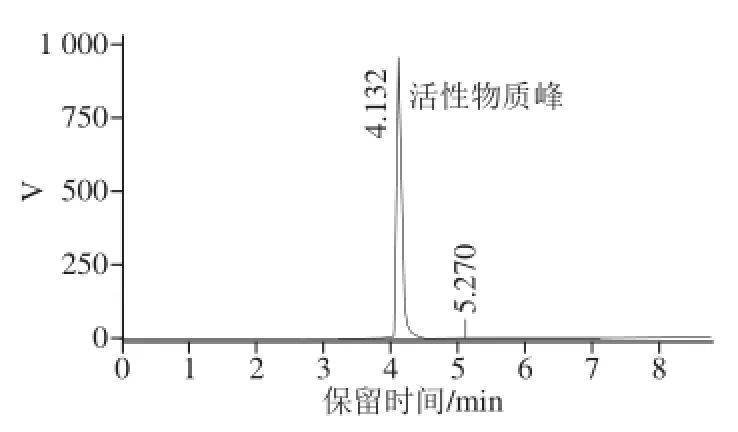
图2 活性物质的HPLC图Fig.2 HPLC profi le of the bioactive fraction
2.2 活性物质初步鉴定结果
图3 活性物质的红外光谱图Fig.3 IR spectrum of the separated chitinase inhibitor
活性物质的红外光谱检测结果如图3所示,活性物质在3 390、3 380、2 490、2 890、1 420、1 360、1 150、1 030、557 cm-1处有较强的吸收峰。其中,2 890 cm-1为C—H伸缩振动峰;1 360、1 030 cm-1处为C—N伸缩振动峰,可能含有胺、酰胺结构;1 150 cm-1处为糖环上C—O吸收峰。活性物质的1H-NMR结果见图4,δ 5.4表明物质结构可能的连接方式是糖类的α-1,4糖苷键,δ 3.5推测活性物质可能含有多个O—H峰。质谱检测结果如图5所示,m/z有多组数据如1 605、1 443、1 281;1 205、1 043、881;863、701、539、377;703、541、379。以上数据都显示相差一个脱水后的单糖分子质量162 D。同时结合活性物质水溶性较好的特点,初步推测该活性物质是一个多羟基的糖类化合物。
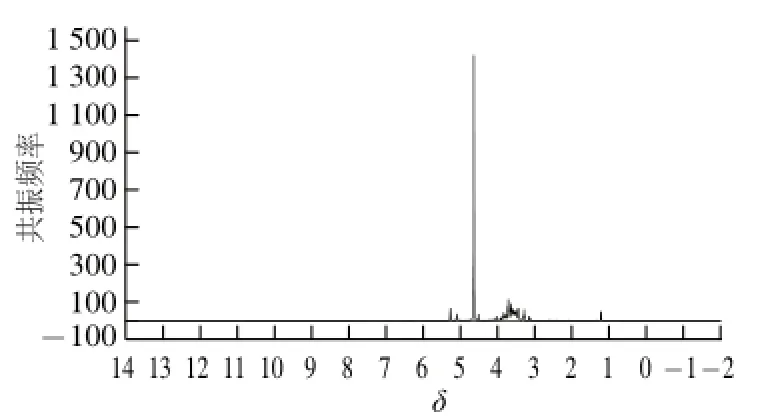
图4 活性物质的1H-NMR谱图Fig.4 1H-NMR spectrum of the separated chitinase inhibitor

图5 活性物质质谱图Fig.5 Mass spectrum of the separated chitinase inhibitor
2.3 活性物质的理化性质分析
溶解性实验结果显示,活性物质粉末在水和甲醇中溶解性较好;微溶于乙醇和丙酮;不溶于所选其他有机试剂。
2.4 pH值对活性物质抑制率的影响
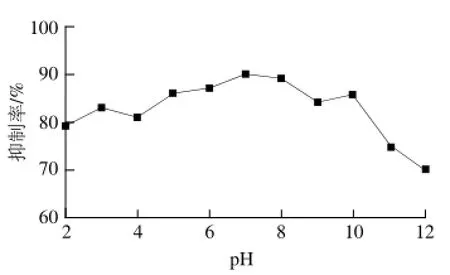
图6 pH值对活性物质的几丁质酶抑制率的影响Fig.6 Effect of pH on inhibitory rate of chitinase by the inhibitor
由图6可知,在酸性、中性、弱碱性条件下,活性物质的几丁质酶抑制率基本没有什么变化;在pH值大于10之后,活性物质的几丁质酶抑制率有少许下降,总体上活性物质有着很好的酸碱耐受性。
2.5 温度对活性物质抑制率的影响
由图7可知,在40~90 ℃之间,该活性物质的热稳定性非常好,对几丁质酶的活性并没有随着温度的升高出现明显的升高或降低趋势,这说明该活性物质有良好的耐热性。
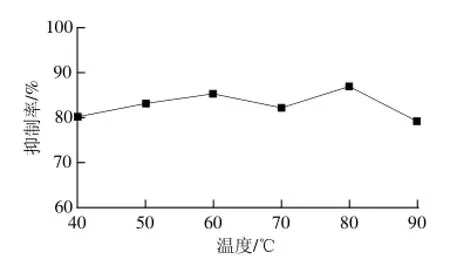
图7 温度对活性物质的几丁质酶抑制率的影响Fig.7 Effect of temperature on inhibitory rate of chitinase by the inhibitor
3 讨 论
基于几丁质酶在含几丁质生物的生长发育过程中发挥着重要作用,几丁质酶抑制化合物可以作为新型潜在的生物杀虫剂、抗真菌剂,在农业、食品、环保等行业具有重要的应用前景。目前,已报道的几丁质酶抑制剂已有多种,从产生菌的筛选、抑制化合物的生物化学合成、抑制机理机制、新功能的发现等都做了很多有意义的研究[6,8,14]。现阶段关注的重点多是对已发现几丁质酶抑制化合物本身结构的分析及其同几丁质酶之间的相互作用机制的研究,以期用抑制剂作为支架前体物构建更高效的化合物。同时,几丁质酶抑制剂还有一些潜在的功能和作用没有被发现,还有很大的研究空间。应该以此为契机开启对几丁质酶抑制剂的深入研究,努力使其应用到生活、生产中。
近年来已报道的几丁质酶抑制剂主要有:阿洛氨菌素及其衍生物、Styloguanidines[15]、CI-4[16]、精氨芬[17-18]和阿尔加定[19]、Psammaplin A[20]、FPS-1[21]、黄嘌呤衍生物[22-23]等。在已发现的几丁质酶抑制剂中,多糖类化合物已有学者报道。Nitoda等[21]从真菌发酵液中分离获得多糖类几丁质酶抑制剂FPS-1。FPS-1是一种水溶性中性多糖,经水解后产物质谱分析为2∶1∶1的N-乙酰葡萄糖胺、葡萄糖和半乳糖。经初步结构鉴定,本研究获得的几丁质酶抑制剂也是一种水溶性多糖类化合物,但分子质量远没有FPS-1(16 kD)大;通过对活性化合物的理化性质研究表明,该活性化合物具有良好的耐热性和酸碱稳定性,而大分子多糖几丁质酶抑制剂FPS-1由于分子质量较大、结构复杂等因素,不具有耐热和耐酸碱性能,对其进一步的实际应用有一定的限制。
本研究以DNS比色法作为检测几丁质酶抑制化合物的方法,该法方便、快捷。经过透明圈初筛和DNS比色复筛从土壤中筛选得到高抑制活性菌株放线菌A0101。对其所产活性物质进行分离纯化,同时研究了该活性化合物的相关理化性质,结果表明:该活性物质是一种水溶性物质,易溶于甲醇,微溶于乙醇和丙酮,不溶于氯仿、乙酸乙酯、丙酮、石油醚等有机试剂;红外光谱、1H-NMR和质谱检测显示其是一种多羟基的糖类化合物,这和该物质良好的水溶性相一致。关于该物质的进一步结构分析确证及其相关理化性质工作尚在进行中。研究结果为获得有效、易得的几丁质酶抑制化合物,开发新型高效低毒的生物杀虫剂、食品保鲜剂、抗真菌剂等提供了参考。
[1] MERZENDOFER H, ZIMOCH L. Chitin metabolism in insects: structure, function and regulation of chitin synthases and chitinases[J]. The Journal of Experimental Biology, 2003, 206(24): 4393-4412.
[2] SAKUDA S, ISOGAI A, MATSUMOTO S, et al. Search for microbial insect growth regulators. II. Allosamidin, a novel insect chitinase inhibitor[J]. Journal of Antibiotics, 1987, 40(3): 296-300.
[3] SAKUDA S, NISHIMOTO Y, OHI M, et al. Effects of demethyallosamidin, a potent yeast chitinase inhibitor, on the cell division of yeast[J]. Agricultural Biological Chemistry, 1990, 54(5): 223-227.
[4] BOOT R G, RENKEMA G H, VERHOEK M, et al. The human chitotriosidase gene: nature of inherited enzyme defi ciency[J]. Journal of Biological Chemistry, 1998, 273(40): 25680-25685.
[5] ANDERSEN O A, DIXON M J, EGGLESTON I M, et al. Natural product family 18 chitinase inhibitors[J]. Natural Product Reports, 2005, 22(5): 563-579.
[6] RUSH C L, SCHUTTELKOPF A W, HURTADO-GUERRERO R, et al. Natural product-guided discovery of a fungal chitinase inhibitor[J]. Chemistry & Biology, 2010, 17: 1275-1281.
[7] PANTOOM S, VETTER I R, PRINZ H, et al. Potent family-18 chitinase inhibitors X-ray structures, affinities, and binding mechanisms[J]. Journal of Biological Chemistry, 2011, 286(27): 24312-24323.
[8] SAKUDA S, INOUE H, NAGASAWA H, et al. Novel biological activities of allosamidins[J]. Molecules, 2013, 18: 6952-6968.
[9] 张洪斌, 刘明艳, 田玉敬, 等. 微生物来源的昆虫几丁质酶抑制剂的筛选与分离纯化[J]. 食品科学, 2010, 31(23): 271-275.
[10] 陈志斌, 张洪斌, 胡雪芹, 等. 响应面法优化链霉菌A0901产几丁质酶抑制剂的发酵条件[J]. 食品科学, 2014, 35(3): 139-143. doi: 10.7506/spkx1002-6630-201403028.
[11] HUANG Gangliang, SHU Shuangquan. An efficient Synthesis of allosamidin[J]. Synlett, 2012, 23(12): 1829-1833.
[12] 刘明艳, 张洪斌, 胡雪芹, 等. 昆虫来源的几丁质酶的分离纯化及酶学性质[J]. 生物工程学报, 2010, 26(3): 404-409.
[13] PATEL A K, SINGH V K, YADAV R P, et al. Purification and characterization of a new chitinase from latex of Ipomoea carnea[J]. Process Biochemistry, 2010, 45(5): 675-681.
[14] TOMOYASU H, TOSHIAKI S, SATOSHI O. Recent development of two chitinase inhibitors, Argifi n and Argadin, produced by soil microorganisms[J]. Proceedings of the Japan Academy, 2010, 86(2): 85-102.
[15] KATO T, SHIZURI Y, IZUMIDA H, et al. Styloguanidines, new chitinase inhibitors from the marine sponge Stylotella aurantium[J]. Tetrahedron Letters, 1995, 36(12): 2133-2136.
[16] IZUMIDA H, IMAMURA N, SANO H. A novel chitinase inhibitor from a marine bacterium, Pseudomonase sp.[J]. Journal of Antibiotics, 1996, 49(1): 76-83.
[17] ŌMURA S, ARIA N, YAMAGUCHI Y, et al. Argifi n, a new chitinase inhibitor, produced by Gliocladium sp. FTD20668 I. taxonomy, fermentation, and biological activities[J]. Journal of Antibiotics, 2000, 53(6): 603-608.
[18] ARIA N, SHIOMI K, IWAI Y, et al. Argifi n, a new chitinase inhibitor, produced by Gliocladium sp. FTD20668 II. Isolation, physicochemical properties, and structure elucidation[J]. Journal of Antibiotics, 2000, 53(6): 609-614.
[19] ARAI N, SHIOMI K, YAMAGUCHI Y, et al. Argadin, a new chitinase inhibitor, produced by Clonostachys sp. FO-7314[J]. Chemical and Pharmaceutical Bulletin, 2000, 48(10): 1442-1446.
[20] TABUDRAVU J N, EIJSINKV G H, GOODAY G W, et al. Psammaplin A, a chitinase inhibitor isolated from the fijian marine sponge Aplysinella rhax[J]. Bioorganic & Medicinal Chemistry, 2002, 10(4): 1123-1128.
[21] NITODA T, USUKI H, KANZAKI H, et al. A potent insect chitinase inhibitor of fungal origin[J]. Zeitschrift für Naturforschung Section C, 2014, 58(11/12): 891-894.
[22] SCHUTTELKOPF A W, ANDERSEN O A, RAO F V, et al. Screening-based discovery and structural dissection of a novel family 18 chitinase inhibitor[J].The Journal of Biological Chemistry, 2006, 281(37): 27278-27285.
[23] RAO F V, ANDERSEN O A, VORA K A, et al. Methylxanthine drugs are chitinase inhibitors: investigation of inhibition and binding modes[J]. Chemistry & Biology, 2005, 12(9): 973-980.
Purification and Characterization of Chitinase Inhibitor from the Fermentation Products of Actinomycete A0101
GU Donghua, ZHANG Hongbin*, LI Qiuping, LI Yao, HU Xueqin
(School of Medical Engineering, Hefei University of Technology, Hefei 230009, China)
Bombyx mori chitinase was used as the target to screen an actinomycete strain able to inhibit chitinase by transparent ring plate screening and DNS colorimetric screening methods. The strain A0101 with high inhibitory specifi city was obtained. The activity-guided separation and purifi cation of the fermented products of strain A0101 were carried out by alcohol precipitation, dialysis, silica gel column chromatography and Sephadex G-15 gel column chromatography, and a pure bioactive material was obtained. This bioactive material exhibited a single HPLC peak with a retention time of 4.1 min. Its inhibitory rate on chitinase was evaluated by DNS colorimetric method to be 80.2%. Moreover, it proved to be a multiple hydroxyl carbohydrate according to the infrared (IR),1H-nuclear magnetic resonance (NMR) and mass spectrometry analyses.
chitinase; inhibitor; purifi cation; characteristics
TS201.3
A
1002-6630(2015)19-0194-05
10.7506/spkx1002-6630-201519035
2014-12-04
安徽省自主创新专项合肥工业大学2013秋实计划项目(2013AKKG0391)
顾东华(1990-),男,硕士研究生,研究方向为生物制药与酶工程。E-mail:gdh9009@126.com
*通信作者:张洪斌(1970-),男,教授,博士,研究方向为生物制药与酶工程。E-mail:zhb5678@163.com

