利用Gateway技术构建神经元特异性人apoE4(1-272)真核表达质粒及鉴定*
李子希, 卢颖洁, 刘晓峰, 冯曾义, 陈 娟
1华中科技大学同济医学院基础医学院生物化学与分子生物学系,武汉 430030 2华中科技大学同济医学院附属中西医结合医院检验科,武汉 430022 3福建医科大学附属第一医院检验科,福州 350005
论 著
利用Gateway技术构建神经元特异性人apoE4(1-272)真核表达质粒及鉴定*
李子希1,2#, 卢颖洁2#, 刘晓峰1,3, 冯曾义2△, 陈 娟1△
1华中科技大学同济医学院基础医学院生物化学与分子生物学系,武汉 4300302华中科技大学同济医学院附属中西医结合医院检验科,武汉 4300223福建医科大学附属第一医院检验科,福州 350005
目的 构建神经元特异性人apoE4(1-272)片段的真核表达质粒,并转染小鼠神经母细胞瘤细胞(N2a细胞)验证其表达,为后续利用该质粒构建转基因小鼠,并探讨其作用奠定实验基础。方法 以同济医学院生物化学与分子生物学系实验室已有的人apoE4质粒为基础,利用Gateway技术设计引物,将人apoE4(1-272)片段克隆至pRP.EX3d载体上,并将神经元特异性启动子SYN1插入至人apoE4(1-272)片段之前,再借助IRES元件连接EGFP报告基因,构建pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP重组表达质粒;经脂质体转染法将上述质粒转染至N2a细胞,转染24 h后,荧光显微镜观察转染效率,并采用Western blot检测apoE4(1-272)蛋白的表达水平。结果 成功构建神经元特异性表达人apoE4(1-272)的真核表达质粒,经测序鉴定各核心元件序列均正确无误,与预期结果相一致,且经转染N2a细胞观察到新构建质粒可顺利表达,Western blot检测结果显示apoE表达及分子量均与预期一致。结论 成功构建了神经元特异性人apoE4(1-272)片段的表达质粒,并初步鉴定了其表达功能,为后续开展相关研究奠定了实验基础。
apoE4(1-272); 神经元特异性表达; Gateway技术
人载脂蛋白E4(apolipoprotein E4,apoE4),是目前公认的阿尔茨海默病(Alzheimer Disease,AD)遗传易感因子[1]。人apoE蛋白由299个氨基酸组成,分子量约34 kD,主要有3种亚型:apoE2、apoE3、apoE4[2]。在正常生理条件下,脑内ApoE主要由星形胶质细胞和部分小胶质细胞合成,其主要生物学功能是参与体内脂质代谢,特别是在脑内脂质转运和代谢中发挥着重要作用[3]。近年来的研究表明,神经元在应激或受到损伤等刺激时可诱导性表达apoE,且脑内神经元产生的apoE4比apoE3更易被神经元细胞内的蛋白酶水解,从而产生多种蛋白裂解片段[4],其中以apoE4肽链羧基端水解产生的含有272个氨基酸残基的片段[(即apoE4(1-272)片段]最为丰富,且具有较强神经毒性,被认为是apoE4引发AD病变的关键病理分子[5]。
Gateway技术是基于λ噬菌体位点特异性重组系统[6],无需使用限制性内切酶和连接酶,经BP和LR两个反应即可将所需的目的基因克隆到各种表达载体上,具有方便、省时、高效的特点[7-8]。本实验中我们基于实验室前期已构建的全长apoE4-EGFP质粒,采用Gateway技术并结合神经元特异性启动子SYN1(Synapsin Ⅰ),构建可实现神经元特异性表达人apoE4(1-272)片段的重组表达质粒,为研究其在ApoE4引发AD病变中的作用提供实验基础。
1 材料与方法
1.1 材料
Gateway® BP ClonaseTMⅡ Enzyme Mix、Gateway® LR ClonaseTMⅡ Plus Enzyme Mix购自Invitrogen公司;胶回收试剂盒及质粒小提试剂盒均购自TIANGEN公司;Taq DNA聚合酶、dNTP及DNA Ladder购于美国Fermentas公司;小鼠神经母细胞瘤(N2a)细胞由同济医学院生物化学与分子生物学系实验室保存;细胞培养液和胎牛血清购自Gibco公司;转染试剂LipofectamineTM2000购于Invitrogen公司;神经元特异性的启动子SYN1及母载体pRP.EX3d购自广州赛业生物科技有限公司;人apoE多克隆抗体购自美国Biosource公司,内参GAPDH抗体购自Abcam公司。
1.2 方法
1.2.1 PCR扩增attB1-Kozak-ApoE4(1-272)-attB2 以本实验室已构建的人apoE4-EGFP质粒为模板,利用Primer STARTMHS DNA聚合酶,采用根据Gateway技术要求设计的带有attB重组位点的针对apoE4(1-272)的上下游引物,并在上游引物起始密码子之前加入Kozak序列(GCCACC),在下游引物加入终止密码子TGA,进行PCR反应。具体扩增程序如下:98℃预变性3 min,98℃变性30 s,60℃退火30 s,72℃延伸1.5 min,共30个循环;72℃延伸5 min。扩增产物采用1%琼脂糖凝胶电泳,通过QIAquick琼脂糖凝胶电泳回收试剂盒回收目的片段,于-20℃保存。实验所用引物如下:AttB1-K-ApoE4(1-272)-F,5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTGCCACCATGAAGGTT-CTGTGGGCTGC-3′;AttB2-ApoE4(1-272)-R,5′-GCCCCTGGTGGAAGACATGACCCAGCTTTC-TTGTACAAAGTGGTCCCC-3′。
1.2.2 BP反应及阳性克隆鉴定[pDown-apoE4(1-272)] 经BP反应获取含有目的片段的入门克隆,具体BP反应体系如下:上述1.2.1获得的attB1-K-apoE4(1-272)-attB2 PCR产物100 ng、pDONR221载体100 ng、BP clonase混合物1 μL、采用TE buffer补充至5 μL。25℃,反应1 h。反应结束后,加入0.5 μL蛋白酶K,37℃终止反应10 min。
将上述BP反应产物转化大肠埃希菌Stbl3,具体操作如下:冰上溶解感受态细胞;把2 μL的BP反应物加入到Stbl3感受态细胞中,冰上孵育30 min;42℃热击细胞30 s;立即转移到冰上孵育2 min;加入300 μL培养液在37℃、以225 r/min的转速摇床孵育1 h,将100 μL转化物涂到含有50 μg/mL卡拉霉素的LB平板上,37℃过夜。挑取阳性克隆,经菌落PCR筛选阳性克隆,并测序鉴定。
1.2.3 LR反应及阳性克隆鉴定[pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP] 经LR反应将入门克隆转移到目的载体上,并将SYN1启动子及EGFP报告基因重组至目的载体,以构建获得表达克隆,具体LR反应如下:上述1.2.2获得的入门克隆[pDown-apoE4(1-272)]11.5 ng、pUp-SYN1 10.27 ng、pTail-IRES/EGFP 13.03 ng、母载体pRP.EX3d 31.66 ng、LR clonase酶反应混合液1 μL、TE缓冲液补充至5 μL;25℃,LR反应16 h。反应结束后,加入0.5 μL蛋白酶K,37℃终止反应10 min。转化LR反应产物到Stbl3,挑取阳性克隆质粒,酶切鉴定筛选阳性克隆,并进一步经DNA测序鉴定阳性克隆。
1.2.4 细胞培养及转染野生型小鼠神经母细胞瘤细胞系(N2a) N2a细胞由本实验室保存,采用DMEM高糖培养液和Opti-MEM培养液按1∶1混合并加入5%的胎牛血清,于5%CO2培养箱中37℃恒温培养。隔天更换新鲜培养液,选取对数生长期的N2a细胞接种至适宜器皿进行实验。
细胞转染采用Invitrogen公司无内毒素LipofectaminTM2000转染试剂盒,具体操作参照其操作说明书:转染前1 d,采用6孔板接种铺板细胞,第2天,每孔加入2 μg质粒DNA,10 μL LipofectamineTM2000转染试剂,Opti-MEM培养液补充体积至500 μL,轻轻混匀,置于细胞培养箱内进行培养,4~6 h后更换新鲜完全培养液;转染24 h后荧光显微镜下观察转染效率,并进行后续试验。实验过程中设立空载体对照和全长apoE4阳性转染对照。
1.2.5 Western blot检测apoE4(1-272)蛋白的表达 转染24 h后,提取各组细胞总蛋白,BCA法测定蛋白浓度。取各组蛋白样品80 μg,10%SDS-PAGE凝胶电泳分离,湿转到NC膜上,然后用5%的脱脂奶粉封闭2 h,加入一抗(稀释度:兔抗apoE4单克隆抗体1∶1 000;羊抗GAPDH单克隆抗体1∶5 000)4℃孵育过夜,第2天采用辣根过氧化物酶标记的二抗孵育,采用Bio-Rad凝胶成像系统扫描成像,并进行后续的定量分析。
1.3 统计学方法
2 结果
2.1 PCR扩增获得带有attB重组位点的apoE4(1-272)片段
以本实验室已有的人全长apoE4-EGFP质粒为模板,根据Gateway技术要求设计带有attB重组位点,并定向扩增apoE4(1-272)片段的上下游引物(见方法1.2.1部分),经PCR扩增,获得带有attB重组位点的apoE4(1-272)片段,以便下一步将其经BP反应克隆至带有attP的pDONR221载体中。扩增产物经1%琼脂糖凝胶电泳鉴定,并经凝胶回收获得其目的片段。如图1所示:目的条带分子量为882 bp,电泳后所得条带与其分子量相一致。
2.2 BP反应构建含有apoE4(1-272)片段的入门克隆
以上述2.1获得的带有attB重组位点的apoE4(1-272)片段为基础,经BP反应将apoE4(1-272)片段转移到pDONR221载体上,构建含有目的片段的入门克隆[pDown-ApoE4(1-272)]。随之将BP反应产物转化至大肠埃希菌Stbl3,经抗性基因卡拉霉素筛选后,挑取阳性克隆,采用载体通用引物M13进行菌落PCR,PCR产物送交测序公司测序验证,所得结果与数据库比对相一致。
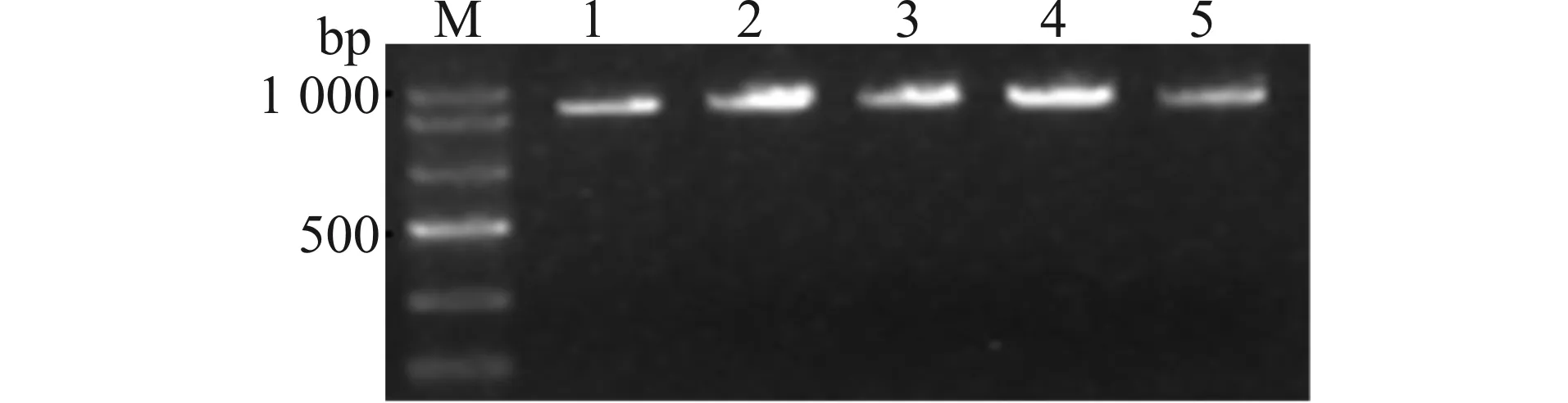
M:DNA Marker;1~5:含有attB序列的apoE4(1-272)PCR产物;PCR产物条带理论大小为882 bp,与目的条带大小相符的克隆即为阳性克隆图1 带有attB重组位点的apoE4(1-272)片段PCR产物的凝胶电泳图Fig.1 Agarose electrophoresis of PCR product of apoE4(1-272)with attB sequence
2.3 LR反应构建pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP真核表达质粒
通过LR反应将神经元特异性启动子(pUp-SYN1)、EGFP报告基因重组体(pTail-IRES/EGFP)转移到母载体pRP.EX3d,生成SYN1-apoE4(1-272)-IRES/EGFP真核表达克隆,即构建成由神经元特异性启动子SYN1调控的含有人apoE4(1-272)片段并带有EGFP荧光标签的重组质粒。将其转化大肠埃希菌Stbl3,挑选阳性克隆,菌落PCR后进行酶切鉴定,如图2所示:经限制性内切酶SacⅡ酶进行单酶切,单酶切后产生大小为710 bp的目的条带,与预期理论值大小相一致。初步提示:已成功构建实验所需目的表达克隆。

M:DNA Marker;1~6:pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP的1~6号克隆经限制性内切酶SacⅡ进行单酶切鉴定,酶切产物理论大小为710 bp,与目的条带大小相符的克隆即为阳性克隆图2 pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP表达克隆酶切后凝胶电泳图Fig.2 Agarose electrophoresis of pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP after restriction endonuclease digestion
进一步,送交上述阳性克隆[即最终成功构建的pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP真核表达质粒]进行测序鉴定,测序结果如图3所示:表达质粒的各组成部分[SYN1、apoE4(1-272)、IRES及EGFP]测序结果均正确无误,且质粒中各部分结构排列完全一致。表明我们已成功构建由神经元特异性启动子SYN1调控的人apoE4(1-272)重组真核表达质粒。

图3 pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP表达质粒的测序结果Fig.3 Sequencing results of pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP expression plasmid
2.4 pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP重组真核表达质粒转染及表达
为了初步验证我们构建的pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP重组真核表达质粒的功能,我们将其转染至N2a细胞中,并设置EGFP空载体对照和全长apoE4阳性对照,转染24 h后,荧光显微镜下观察各组的转染效率,随后收取各组细胞,提取总蛋白,经Western blot检测各组细胞中apoE蛋白的表达情况。如图4所示:在全长apoE4、我们新构建的apoE4(1-272)片段及EGFP空载体组均有绿色荧光蛋白表达,且进一步的Western blot检测结果也显示,全长apoE4和apoE4(1-272)片段组均有apoE蛋白的表达,而空载体对照组未检测到apoE蛋白的表达,因目的基因与EGFP之间经IRES元件连接,因此为非融合蛋白,分子量大小表现为全长apoE4组(34 kD)略大于apoE4(1-272)片段组(27~30 kD),与理论预期结果相符(图4)。初步表明:pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP重组质粒可成功表达于N2a细胞。
3 讨论
ApoE4是当前已知的AD最主要的遗传易感因子,自1993年Rose及其研究团队首次报道apoE4与AD的发生密切相关以来,有关apoE4在AD发生中的作用及机制一直是AD研究领域关注的热点。近年来的研究发现:神经元在应激或损伤等刺激下,可诱导性表达apoE,且其进一步在胞内裂解产生apoE4(1-272)片段[4]。研究显示:在AD患者以及表达人apoE4的转基因鼠的脑组织中均存在apoE4(1-272)片段,因而目前认为apoE4(1-272)片段可能是apoE4发挥促AD作用的关键病理分子[9]。有关apoE4(1-272)片段在AD中的作用,引起了不少学者的关注,构建该片段的重组质粒,成为在体内、体外研究其功能的基础。但后来的研究发现,apoE4(1-272)片段具有神经毒性效应,作为一个毒性片段,外源性给予apoE4(1-272)片段或过表达该片段可导致培养细胞死亡[10],为后续的研究工作带来了新的挑战。

图4 pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP在N2a细胞的表达情况(×400)Fig.4 Expression of apoE4(1-272)fragment after being transfected with pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP in N2a cells (×400)
基于上述认识,以及apoE4(1-272)片段神经元特性表达的特点,我们选用具有神经元特异性表达功能,且强启动子活性适度,主要是在成熟神经元表达的SYN1启动子[11],构建神经元特异性表达人apoE4(1-272)片段的重组质粒。这样一方面既可实现神经元特异性表达目的基因[apoE4(1-272)片段],另一方面也可避免该该片段过度表达引发的毒性作用,减轻其致细胞死亡的效应。
鉴于实验室前期研究中已经成功构建了带有EGFP标签的全长apoE4质粒(apoE4-EGFP),本实验中我们采用新近发明的Gateway技术,先扩增获取apoE4(1-272)片段,再经BP和LR两个反应最终将其转入目的表达载体中,构建成由SYN1调控的含有人apoE4(1-272)片段并带有EGFP荧光标签的重组质粒。结果显示,相对于传统的克隆技术,Gateway技术可实现高效、快速、简捷地将我们需要的目的基因转移至目标载体上,具有明显的优势,节省了实验的时间、加速了实验进程。
为了验证本实验中我们新构建的pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP重组真核表达质粒的功能,将其转染至N2a细胞,观察其转染效率、细胞存活情况及其表达效果。实验结果显示,新构建的由SYN1调控的神经元特异性表达人apoE4(1-272)的重组质粒可顺利表达,且未造成培养细胞的大量死亡,荧光显微镜下可见EGFP表达发出的绿色荧光,Western blot检测发现apoE蛋白表达,且相比全长apoE4组,apoE4(1-272)组蛋白条带分子量略小,与已有文献报道的apoE4(1-272)片段的分子量大小相符[12]。
可见,本实验中构建的pRP.EX3d-SYN1-apoE4(1-272)-IRES/EGFP可成功表达人apoE4(1-272)片段,且对细胞毒效应较小,可用于后续试验。为我们进一步构建神经元特异性表达人apoE4(1-272)片段转基因小鼠,进而研究其在AD病变中的作用提供了实验基础。
[1] Liu C C,Kanekiyo T,Xu H,et al.Apolipoprotein E and Alzheimer disease:risk,mechanisms and therapy[J].Nat Rev Neurol,2013,9(2):106-118.
[2] Mahley R W.Apolipoprotein E:cholesterol transport protein with expanding role in cell biology[J].Science,1988,240(4852):622-630.
[3] Beffert U,Danik M,Krzywkowski P,et al.The neurobiology of apolipoproteins and their receptors in the CNS and Alzheimer’s disease[J].Brain Res Brain Res Rev,1998,27(2):119-142.
[4] Harris F M,Brecht W J,Xu Q,et al.Carboxyl-terminal-truncated apolipoprotein E4 causes Alzheimer’s disease-like neurodegeneration and behavioral deficits in transgenic mice[J].Proc Natl Acad Sci USA,2003,100(19):10966-10971.
[5] Yadong H.Apolipoprotein E sets the stage-response to injury triggers neuropathology[J].Neuron,2012,76(5):871-85.
[6] Bushman W,Thompson J F,Vargas L,et al.Control of directionality in lambda site specific recombination[J].Science,1985,230(4728):906-911.
[7] 朱玉贤,梅宋,潘巩,等.利用Gateway克隆技术大规模克隆拟南芥转录因子[J].分子植物育种,2004,2(3):358-364.
[8] Magnani E,Bartling L,Hake S.From Gateway to MultiSite Gateway in one recombination event[J].BMC Mol Biol,2006,7:46.
[9] Brecht W J,Harris F M,Chang S,et al.Neuron-specific apolipoprotein e4 proteolysis is associated with increased tau phosphorylation in brains of transgenic mice[J].J Neurosci,2004,24(10):2527-2534.
[10] Huang Y,Liu X Q,Wyss-Coray T,et al.Apolipoprotein E fragments present in Alzheimer’s disease brains induce neurofibrillary tangle-like intracellular inclusions in neurons[J].Proc Natl Acad Sci U S A,2001,98(15):8838-8843.
[11] Li L,Suzuki T,Mori N,et al.Identification of a functional silencer element involved in neuron-specific expression of the synapsin I gene[J].Proc Natl Acad Sci U S A,1993,90(4):1460-1464.
[12] Nakamura T,Watanabe A,Fujino T,et al.Apolipoprotein E4(1-272)fragment is associated with mitochodrial protein and affects mitochondrial function in neuronal cells[J].Mol Neurodegener,2009,4:35.
(2017-03-25 收稿)
Construction and Expression of Neuron-specific Recombinant Plasmid of Human ApoE4(1-272) Fragment by Gateway Technique
Li Zixi1,2#,Lu Yingjie2#,Liu Xiaofeng1,3etal
1Department of Biochemistry and Molecular Biology,School of Basic Medical Sciences,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China2Department of Laboratory Medicine,Affiliated Hospital of Chinese and Western Medicine,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China3Department of Laboratory Medicine,the First Affiliated Hospital of Fujian Medical University,Fuzhou 350005,China
Objective To construct an expression plasmid of neuron-specific human apolipoprotein E4(1-272)fragment,and then identify its function by transfecting into N2a cells,which may provide a foundation for further study.Methods According to the Gateway technique,we designed the primer for apoE4(1-272)fragment,and get apoE4(1-272)fragment by PCR from the apoE4-EGFP plasmid.The apoE4(1-272)fragment was firstly cloned into pDONR221 vector by BP reaction,and then cloned into pRP.EX3d donor by LR reaction,meanwhile the neuron-specific promoter SYN1 was inserted prior to the apoE4(1-272)fragment,and the EGFP was also constructed by ligating the EGFP reporter group with the IRES element.The recombinant plasmid was transfected into N2a cells by LipofectamineTM2000,after 24 h,the transfection efficiency was observed by fluorescence microscopy and the expression level of apoE4(1-272)protein was detected by Western blotting.Results The expression plasmid of neuron-specific human apoE4(1-272)was successfully constructed,and the sequences of the core components were confirmed by sequencing.After being transfected into N2a cells,the newly constructed plasmid was successfully expressed,and the levels and molecular weight of apoE were consistent with the expected by Western blotting.Conclusion In this study,we have successfully constructed a recombinant expression plasmid of neuron-specific human apoE4(1-272)fragment,and identified its expression function in N2a cells,which would facilitate follow-up study for its function.
apoE4(1-272); neuron-specific expression; Gateway technique
*国家自然科学基金资助项目(No.31171027,No.31670778,No.81371416);华中科技大学自主创新基金资助项目(No.2016YXMS191)
R542.2
10.3870/j.issn.1672-0741.2017.04.001
#共同第一作者,李子希,男,1982年生,医学硕士,E-mail:11189847@qq.com;卢颖洁,女,1983年生,医学硕士,E-mail:705410418@qq.com
△共同通讯作者,Co-corresponding author,冯曾义,E-mail:982341872@qq.com;陈 娟,E-mail:chenjuanlinda69@163.com

