大鼠靶向α7nAchR基因shRNA真核表达载体及重组腺病毒构建*
王定坤, 陆付耳, 邹 欣, 任妍林, 董 慧, 巩 静, 方 珂, 徐丽君, 王开富△
华中科技大学同济医学院附属同济医院 1中西医结合科 2中西医结合研究所,武汉 430030
大鼠靶向α7nAchR基因shRNA真核表达载体及重组腺病毒构建*
王定坤1, 陆付耳2, 邹 欣2, 任妍林2, 董 慧2, 巩 静2, 方 珂2, 徐丽君2, 王开富2△
华中科技大学同济医学院附属同济医院1中西医结合科2中西医结合研究所,武汉 430030
目的 构建大鼠烟碱样乙酰胆碱受体α7亚型(α7nAchR)基因短发夹RNA(shRNA)真核表达载体。方法 设计并合成编码α7nAchR基因shRNA的DNA模板引物AY318、AY857、AY444+559、AY318+857,并分别与线性化的质粒载体pGenesil-1.1、pGenesil-1.4、pGenesil-1.2,pGenesil-1.3连接,以构建可以编码1条α7nAchR基因shRNA和编码2条α7nAchR基因shRNA的重组质粒载体;重组质粒载体感染感受态的DH5a细胞,提取细菌质粒进行特定酶切,并用1%的琼脂糖凝胶电泳以鉴定重组质粒是否构建成功;用LR体外同源重组法将AY318、AY444+559、AY857 shRNA表达框分别从重组质粒pGenesil转移至腺病毒pGSadeno质粒表达载体上,构建重组腺病毒质粒;用相同的方法感染DH5a细胞,并鉴定重组腺病毒pGSadeno质粒是否构建成功;提取线性化的重组腺病毒DNA并转染包装细胞HEK293,经放大培养获得滴度为1.0×1010pfu/mL的重组腺病毒上清;将重组腺病毒感染大鼠GH3垂体瘤细胞,以PCR反应鉴定重组腺病毒载体的α7nAchR基因干扰效果。结果 通过酶切片段及其大小,初步判断AY318、AY857、AY444+559、AY318+857 shRNA成功重组入质粒载体,重组腺病毒pGSadeno-shRNA包装成功;重组腺病毒感染HEK293细胞,在荧光显微镜下有绿色荧光蛋白表达;重组腺病毒感染GH3细胞后α7nAchR mRNA表达显著减少,且pGSadeno-AY857 shRNA干扰效果最明显(85%)。结论 具有感染力和干扰大鼠α7nAchR基因表达的shRNA真核表达载体构建成功,且pGSadeno-AY857 shRNA具有最强的基因干扰效果。
α7nAchR; shRNA; 基因干扰; 重组质粒; 重组腺病毒
RNA干扰(RNA interference,RNAi)是一种先于动植物分化,古老而普遍存在于自然界中,保护生物体抵抗外界环境刺激的生物现象。RNAi技术是近些年来发展起来的分子生物学技术,旨在于分子水平抑制靶基因表达,从而实现对特定表型的基因进行研究。近年来,越来越多的研究表明胆碱能抗炎通路(Cholinergic anti-inflammatory pathway,CAP)在一系列慢性消耗性疾病如2型糖尿病、关节炎、动脉粥样硬化病、牛皮癣、哮喘、败血症以及溃疡性结肠炎中的作用,而这些疾病都与机体的慢性炎症反应相关[1]。所谓的胆碱能抗炎通路即Ach-α7nAchR-MAPK/JAK/STAT-NF-κB通路,乙酰胆碱(Ach)作为副交感神经系统分支自主神经系统的主要神经递质,可以通过作用于α7烟碱样胆碱能受体(α7 nicotinic acetylcholine receptor,α7nAchR)激活CAP,抑制人体的网状内皮系统(RES)如肺、脾、肝、肾和肠道等器官的NF-κB蛋白表达和核位移,从而抑制炎症反应[2-3]。因此,本研究试图沉默α7nAchR基因,为进一步研究该基因介导的CAP在一些慢性炎症反应性代谢病中的作用奠定基础。
1 材料与方法
1.1 材料、试剂、仪器
质粒pGenesil、腺病毒pGSadeno载体(淅玛生物技术有限公司,武汉);质粒提取试剂盒(Sigma-Aldrich公司,美国);DH5a细胞(上海闪晶分子生物科技有限公司,上海);PCR扩增试剂、Trizol、限制性内切酶(TaKaRa公司,大连);PCR仪(StepOne公司,美国);恒温培养箱(SANYO公司,日本);HEK293细胞(ATCC公司,美国);DMEM培养液(Gibco公司,美国);高速离心机(Thermo Scientific公司,美国);DNA/细胞转染剂METAFECTENETM(Biontex公司,德国);荧光显微镜(OLYMPUS公司,日本);NanoDrop 2000核酸/蛋白分析仪(Thermo Scientific公司,美国);Mastercycler梯度PCR仪(Eppendrof公司,德国);PCR引物(武汉金开瑞生物工程有限公司,武汉)。
1.2 方法
1.2.1 一个质粒载体编码1条shRNA的重组质粒构建及鉴定 (1)设计并合成编码α7nAchR基因shRNA序列的DNA模板引物。在GenBank中查找大鼠α7nAchR的全基因序列(ID号分别为:NM_012832),拷贝并粘贴在siRNA网上设计软件OptiRNA中,根据siRNA的设计原则,选取G∶C含量在30%~55%之间的核酸片段,并分别从该序列的318号碱基和857号碱基开始选择19个碱基为siRNA的靶序列,并做BLAST分析,保证不与同属大鼠非靶序列同源。选择的2条靶序列如下:AY318:5′-GATTTGGAAACCAGACATT-3′;AY857:5′-CATCTGATTCTGTGCCCTT-3′。根据选定的靶序列,设计并体外合成α7nAchR基因shRNA的DNA模板引物,其结构为:BsaⅠ+Sense+Loop+Antisense+终止信号+SacⅠ+BsaⅠ。引物序列如下:pGenesil-1.1-AY318-A,5′-CACCGATTTGGAAACCAGACATTTCAAGACAATGTCTGG-TTTCCAAATCTTTTTG-3′;pGenesil-1.1-AY318-B,5′-AGCTCAAAAAGATTTGGAAACCAGACAT-TGTCTTGAAATGTCTGGTTTCCAAATC-3′;pGenesil-1.4-AY857-A,5′-TCCCCATCTGATTC-TGTGCCCTTTCAAGACAAGGGCACAGAATC-AGATGTTTTTG-3′;pGenesil-1.4-AY857-B,5′-AGCTCAAAAACATCTGATTCTGTGCCCTTG-TCTTGAAAGGGCACAGAATCAGATG-3′。把设计的DNA单链模板(正向序列、反向序列)退火形成双链,并分别插入线性化的pGenesil-1.1,pGenesil-1.4质粒表达载体。(2)α7nAchR基因shRNA载体的构建及鉴定。分别用退火缓冲液溶解上述AY318及AY857的A片段和B片段,于水浴箱中94℃退火,自然冷却至室温,使DNA模板引物链接为双链;内切酶BsaⅠ酶切质粒pGenesil-1.1、pGenesil-1.4构建线性化质粒载体;在Ligation Mix缓冲液中α7nAchR基因shRNA与线性化质粒载体链接构建重组质粒,并感染感受态细胞DH5a细胞,取菌落接种于卡那霉素抗性(终浓度为30 μg/mL)的LB平板上繁殖,质粒提取试剂盒提取细菌质粒,并用限制性内切酶SacⅠ进行酶切。回收酶切产物,并用1%琼脂糖凝胶电泳进行鉴定。
1.2.2 一个质粒载体编码2条shRNA的质粒构建及鉴定 (1)设计合成含2个shRNA的DNA的模板引物。用同样的方法,并遵循同样的原则,从该基因的444位和559位起,分别选择19和21个碱基,设计合成α7nAchR基因siRNA。其序列如下:AY444,5′-CTCCTGCTACATTGACGTT-3′;AY559,5′-GCAGTGGAACATGTCTGAGTA-3′。各引物序列如下:AY318+857-A,5′-TTGGACAGCACA-ATGTCTGGTTTCCAAATCGGGAAAGAGTGA-TCT-3′;AY318+857-AR,5′-TTTCTCTTGAAA-AGGGCACAGAATCAGATGGGTGTTTCGTCC-TTT-3′;AY318+857-C,5′-TTGAATTCAAGCTTGGATCCAAAAAGATTTGGAAACCAGACATTGGACAGCACAA-3′;AY318+857-CR,5′-TTGGATCCAAGCTTGAATTCAAAAACATCTGAT-TCTGTGCCCTTTCTCTTGAAAA-3′;AY444+559-A,5′-TTGGACAGCACAACGTCAATGTA-GCAGGAGGGGAAAGAGTGATCT-3′;AY444+559-AR,5′-TATCTCTTGAATACTCAGACATG-TTCCACTGCGGTGTTTCGTCCTTT-3′;AY444+559-C,5′-TTTGAATTCAAGCTTAAAAACT-CCTGCTACATTGACGTTGGACAGCACAA-3′;AY444+559-CR,5′-TTTAAGCTTGAATTCAA-AAAGCAGTGGAACATGTCTGAGTATCTCTT-GAATA-3′。DNA模板中引物A及C,AR及CR分别为AY318及AY857的正向序列及反向序列,均含Loop环序列及保护碱基,其正向序列含质粒连接序列,其反向序列中均含有限制性内切酶BamHⅠ、EcoRⅠ、HindⅢ的酶切位点及终止信号。(2)双链shRNA的合成用2步PCR法构建AY318+857的双链shRNA。用如前述的相同方法构建AY444+559的shRNA序列。将上述引物分2组,进行2步PCR扩增,第1轮引物为A+AR,第2轮引物为C+CR,从而构建含2个shRNA的序列。将合成的双链shRNA进行琼脂糖凝胶电泳,鉴定双链shRNA是否构建成功。(3)一个载体编码2条shRNA的重组质粒的构建及鉴定。分别用限制性内切酶HindⅢ+EcoRⅠ,BamHⅠ+EcoRⅠ酶切质粒pGenesil-1.2和pGenesil-1.3,使其线性化,并开放和AY444+559 shRNA、AY318+857 shRNA结合的粘性末端,在Ligation Mix中构建线性化质粒载体。分别感染感受态的DH5a细胞,如1.2.1(2)项中同样的方法进行细菌的繁殖,使重组质粒充分克隆。用质粒提取试剂盒收集并裂解繁殖菌落,小量提取细菌质粒,并做酶切。收集酶切产物,于1%的琼脂糖凝胶电泳,观察切割片段的大小。
1.2.3 重组腺病毒rAd5-AY444+559、AY318、AY857 shRNA构建、包装 LR体外同源重组法将AY318、AY444+559、AY857 shRNA表达框分别从质粒pGenesil(1.1,1.2,1.4)转移至腺病毒pGSadeno表达载体上,构建重组腺病毒质粒(AY318+857 shRNA由于制作重组腺病毒效率低,故而舍弃)。重组后的腺病毒感染DH5a,用同样方法进行克隆增殖。用质粒提取试剂盒提取上一步中克隆增殖的质粒,并用XbaⅠ内切酶进行单酶切,收集酶切产物,用1%琼脂糖凝胶电泳,根据切出的片段大小,判断shRNA是否重组入腺病毒质粒。用内切酶PacⅠ酶切重组腺病毒DNA使之线性化,并提取获得线性化的腺病毒DNA。线性化的腺病毒DNA与DNA细胞转染剂METAFECTENETM以DNA∶lipid=1∶3的比例混匀,转染HEK293细胞,荧光显微镜下观察到HEK293细胞荧光蛋白表达。当HEK293细胞有明显的细胞病态反应(CPE)反应,且有一半以上的细胞脱壁时即裂解细胞收集病毒,并进行放大培养从而获得滴度为1.0×1010pfu/mL的病毒。
1.2.4 构建HK的重组腺病毒 用1.2.1同样的方法,构建1个质粒载体含1个无基因干扰效果的无效干扰对照序列(HK)shRNA重组质粒,并按上述同样的方法,构建HK干扰质粒的重组腺病毒。HK序列如下:5′-GACTTCATAAGGCGCATGC-3′。编码HK shRNA的DNA模板引物如下:HK-1.1-A,5′-CACCGACTTCATAAGGCGCATGCTTCAAGACGGCATGCGCCTTATGAAGTCTTT-TTTG-3′;HK-1.1-B,5′-AGCTCAAAAAAGAC-TTCATAAGGCGCATGCCGTCTTGAAGCATG-CGCCTTATGAAGTC-3′。
1.2.5 shRNA重组腺病毒感染GH3细胞 以3×105/孔的细胞数量将GH3细胞接种于6孔板中,并用含15%灭活FBS、青链霉素(青霉素100 U/mL,链霉素100 μg/mL)的DMEM培养液于5%CO2的细胞培养箱中37℃培养。当细胞融合度达到80%~90%时,弃去培养液,换为不含血清和双抗的DMEM完全培养液。将一定体积4种shRNA(HK,AY318,AY444+559,AY857)重组腺病毒上清加入培养液中进行过量感染,并设正常对照组。72 h后弃去培养液,加胰酶消化细胞,并离心收集细胞。用Trizol提取收集细胞的RNA,并逆转录为cDNA,用PCR扩增试剂盒分别对GAPDH和α7nAchR扩增,并用1%琼脂糖凝胶电泳扩增产物。目的基因表达相对量以α7nAchR与GAPDH灰度值的比值(α7nAchR/GAPDH)表示。引物序列如下:GAPDH上游引物:5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物:5′-TTTGAGGGTGCA-GCGAACTT-3′;α7nAchR上游引物:5′-CCATACCCAGATGTCACCTAC-3′,下游引物:5′-CAGCAAGAATACCAGCAGAG-3′。
2 结果
2.1 质粒pGenesil的酶切结果
质粒pGenesil-1.1和pGenesil-1.4的BsaⅠ酶切结果见图1,质粒pGenesil-1.1-AY318和pGenesil-1.4-AY857的SacⅠ酶切结果见图2。
M:DL2000 marker;1:pGenesil-1.1;2:pGenesil-1.4图1 质粒经BsaⅠ酶切后的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of plasmid after digested by BsaⅠ

M:DL2000 marker;1、2:pGenesil-1.1-AY318;3、4:pGenesil-1.4-AY857图2 重组质粒pGenesil-shRNA经SacⅠ酶切后的琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of recombinant plasmid pGenesil-shRNA after digestion with SacⅠ
经酶切结果分析:如图1和图2所示,质粒pGenesil-1.1、pGenesil-1.4的结构中只有1个SacⅠ酶切位点,而重组质粒pGenesil-1.1-AY318,pGenesil-1.4-AY857能够分别被限制性内切酶SacⅠ切出约1 000 bp和700 bp的DNA片段,说明含有SacⅠ酶切位点的AY318 shRNA和AY857 shRNA已经分别重组入质粒pGenesil-1.1和pGenesil-1.4里。
2.2 AY318+857、AY444+559 PCR扩增产物电泳结果
结果见图3。
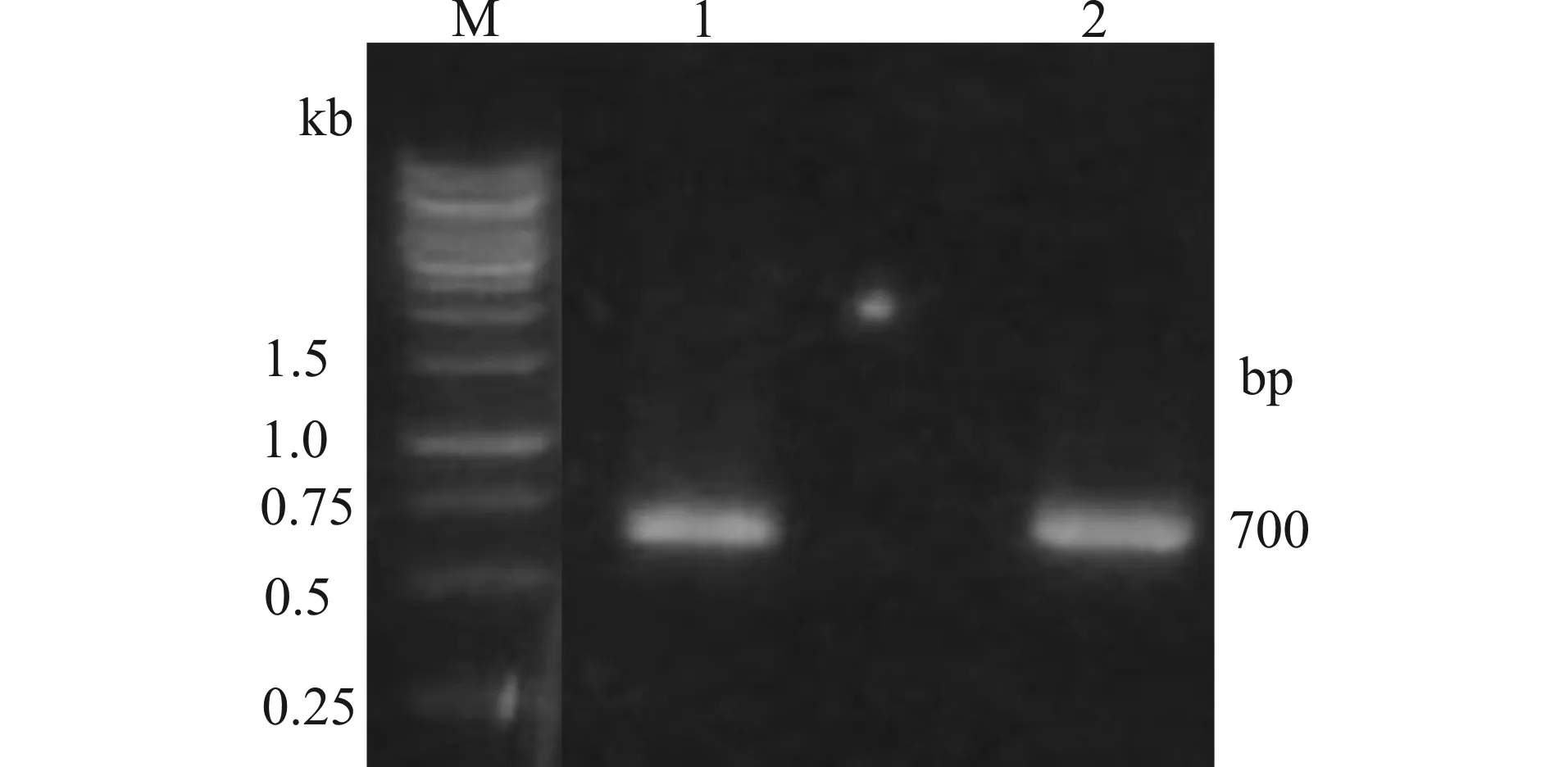
M:DL5000 marker;1:AY318+857;2:AY444+559图3 AY318+857、AY444+559 PCR扩增电泳图Fig.3 Agarose gel electrophoresis of AY318+857 and AY444+559 shRNA amplification
2.3 重组质粒pGenesil-1.3-AY318+857、pGenesil-1.2-AY444+559用HindⅢ和EcoRⅠ双酶切结果
结果见图4。
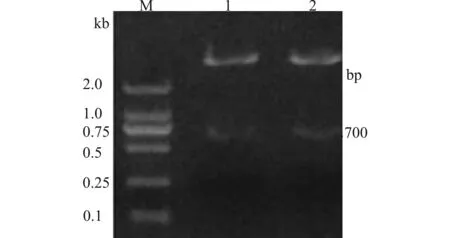
M:DL2000 marker;1:pGenesil-1.3-AY318+857;2:pGenesil-1.2-AY444+559图4 重组质粒pGenesil-1.3-AY318+857,pGenesil-1.2-AY444+559HindⅢ和EcoRⅠ双酶切电泳图Fig.4 Agarose gel electrophoresis of recombinant plasmid pGenesil-1.3-AY318+857 and pGenesil-1.2-AY444+559 after digestion with HindⅢ and EcoRⅠ
从图3和图4可知,AY318+857 shRNA,AY444+559 shRNA的大小约700 bp,且其中有HindⅢ和EcoRⅠ的酶切位点。因为重组质粒载体pGenesil-1.3-AY318+857和pGenesil-1.2-AY444+559能被限制性内切酶HindⅢ和EcoRⅠ酶切出一条约700 bp的DNA条带,说明目的基因片段已经分别成功插入到质粒载体里。
2.4 重组腺病毒质粒载体pGSadeno-AY444+559、AY318、AY857 shRNA经XbaⅠ单酶切结果
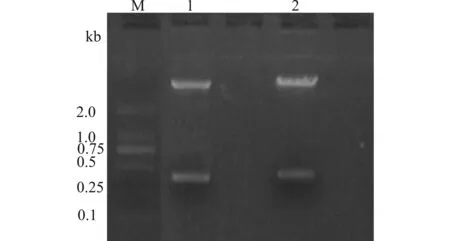
酶切结果分析:根据前期的实验结果,shRNA如果插入腺病毒质粒,将切出一条约2.5 kb的DNA条带,如图5示,可知目的克隆是正确的,并将其分别命名为AY444+559、AY318、AY857 shRNA。

M1:DL15000 marker;M2:DL2000 marker;1:pGSadeno-AY444+559 shRNA;2:pGSadeno-AY318 shRNA;3:pGSadeno-AY857 shRNA图5 重组腺病毒质粒载体pGSadeno-AY444+559、AY318、AY857 shRNA XbaⅠ酶切电泳图Fig.5 Agarose gel electrophoresis of recombinant plasmid pGSadeno-AY444+559,AY318 and AY857 shRNA after digestion with XbaⅠ
2.5 重组腺病毒感染包装细胞HEK293细胞
因为重组腺病毒的DNA序列中有绿色荧光蛋白表达基因,在荧光显微镜下可以见到感染了重组腺病毒的HEK293细胞有绿色荧光蛋白表达,而正常细胞没有(图6),说明具有感染力的重组腺病毒包装成功。
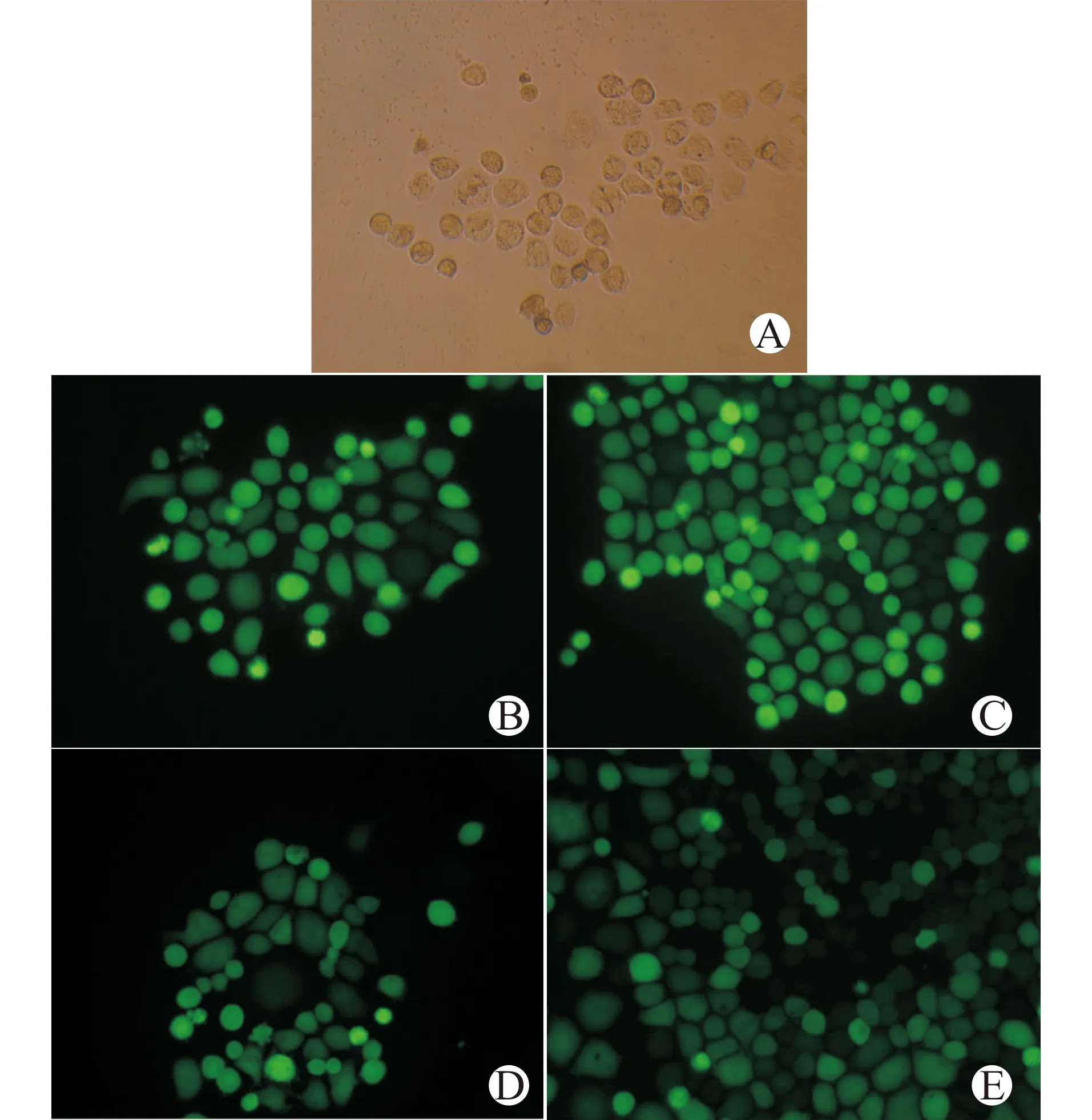
A:正常HEK293细胞;B:感染pGSadeno-HK shRNA的HEK293细胞;C:感染pGSadeno-AY318 shRNA的HEK293细胞;D:感染pGSadeno-AY444+559 shRNA的HEK293细胞;E:感染pGSadeno-AY857 shRNA的HEK293细胞图6 重组腺病毒感染HEK293细胞(×200)Fig.6 Recombinant adenovirus infects HEK293 cells (×200)
2.6 重组腺病毒对GH3细胞α7nAchR mRNA表达的影响
从图7分析可知,重组腺病毒能够明显抑制α7nAchR基因的表达。通过mRNA电泳条带灰度分析发现,pGSadeno-AY857 shRNA的抑制效果最强(85%),pGSadeno-AY318 shRNA的抑制效果次之(76%),而pGSadeno-HK shRNA对α7nAchR基因的表达与正常GH3相比,几乎没有差异。故而筛选出pGSadeno-AY857 shRNA为理想的重组腺病毒载体。
3 讨论
随着分子生物学的发展,科学家们对具有基因表达调控功能的小片段非编码RNA在动植物体内的作用更加重视[4]。Fire等[5]在上世纪90年代率先通过小分子双链RNA(double strand RNA,dsRNA)沉默特定序列基因证实了RNAi在新杆状线虫中的存在,并且这种干扰效果是任何一条正义链或反义链的数倍。目前,研究者认为该技术的原理主要是利用外源的小分子dsRNA通过特定载体转移到被感染的细胞或动植物体内,被属于Dicer家族的Rnase Ⅲ切割为只有21~23个核苷酸(nt)的小干扰RNA(small interference RNA,siRNA),而这些siRNA通过核酸酶-RNA诱导沉默复合物(RNA-induced silencing complex,RISC)介导与之同源的mRNA降解[6],从而达到沉默基因表达,抑制蛋白合成的作用。事实上,RNAi在基因表达的多个层面发挥作用,如转录后水平的RNAi主要是mRNA降解和启动子、内含子失活而导致基因沉默;暴露于dsRNA后的基因组中同源基因序列的甲基化[7];以及染色体结构的改变层面影响基因表达。但是,转录后水平的RNAi机制更受到重视,也研究得更加透彻。运用RNAi技术抑制靶基因的表达,从而验证靶蛋白在生物体中的作用及与之相关的机制成为现代生命科学领域的一种新方法。作为基因治疗(Gene Therapy)的重要手段,应用现代分子生物学技术通过人工体外合成的小干扰RNA可以沉默内源性疾病基因的表达,这种方法比起那些效果不稳定的小分子、蛋白和单克隆抗体更具可靠性,已经成为现代基因治疗技术研究的重要手段[8]。RNAi可以通过多种方式导入哺乳动物细胞,既可以合成21~23 bp长度的siRNA,也通过可以表达shRNA的质粒和病毒媒介系统[9]。Siolas等[10]的研究表明shRNA具有比siRNA更强的RNAi效果。RNAi具有高特异性、高效性沉默目的基因的特点[11],已经广泛成为体内和体外研究哺乳动物基因功能的重要实验工具,尤其是致病基因的功能,如沉默基因带来的一系列的细胞内过程,包括细胞吞噬、信号转导、凋亡和细胞循环等细胞功能紊乱过程。目前,有学者对RNAi在肿瘤性疾病[12]、感染性疾病[13]以及呼吸系统疾病[14]等多种疾病中的作用进行研究,证实了RNAi作为一种基因沉默技术的优点和可靠性,也开展了多项RNAi相关的基因治疗临床实验[15]。

M:DL2000 marker;1:正常GH3细胞;2:GH3细胞+pGSadeno-HK shRNA;3:GH3细胞+pGSadeno-AY318 shRNA;4:GH3细胞+pGSadeno-AY857 shRNA;5:GH3细胞+pGSadeno-AY444+559 shRNA图7 重组腺病毒感染GH3细胞GAPDH(A)及α7nAchR(B)基因电泳图Fig.7 GAPDH (A) and α7nAchR(B) mRNA expression in HEK293 cells infected by recombinant adenovirus
本实验中,选用可以诱导更稳定的RNAi效果的shRNA,通过重组入腺病毒质粒载体中,诱导细胞内与之同源的mRNA的降解,从而达到抑制特定基因表达的作用。为了设计出具有更佳基因沉默效果的shRNA,我们从GenBank查找出大鼠α7nAchR基因序列,根据siRNA的设计原则,分别选择该基因的318位、857位、444位和559位为起始的碱基序列为模板,设计出能够克隆该基因shRNA的DNA模板引物,导入pGenesil质粒载体中。为了验证表达1条shRNA和同时表达2条shRNA对基因干扰的效果好坏,实验中同时设计了能够编码1条shRNA的质粒载体pGenesil-1.1-AY318-shRNA,pGenesil-1.4-AY857-shRNA和能够同时编码2条shRNA的质粒载体pGenesil-1.3-AY318+857-shRNA,pGenesil-1.2-AY444+559-shRNA。因为编码shRNA的DNA模板和pGenesil质粒上都有特殊的酶切位点,且pGenesil质粒上有卡那霉素抗性基因,将重组质粒转化感受态的DH5a细胞,并用含卡那霉素的培养液进行重组质粒筛选和克隆,用特定的限制性内切酶对重组质粒进行酶切,并对酶切片段用1%琼脂糖凝胶电泳,根据酶切的片段数目及大小确定重组质粒是否成功。然而在病毒的质粒中,shRNA可以获得更持久、更稳定的表达[16],故而把pGenesil上的shRNA表达框转移至腺病毒pGSadeno表达载体上,并用相似的技术验证转移的成功与否。通过重组腺病毒感染GH3细胞,PCR反应检验α7nAchR基因的表达量,筛选出具有最佳基因沉默效果的AY857-shRNA。
本实验成功构建了多个能够表达具有α7nAchR基因沉默效果的shRNA腺病毒表达载体,并明确pGSadeno-AY857-shRNA表达载体具有最佳的基因沉默效果,为进一步研究该基因在慢性炎症性代谢性疾病中的作用奠定了良好的基础。
[1] Bencherif M,Lippiello P M,Lucas R,et al.Alpha7 nicotinic receptors as novel therapeutic targets for inflammation-based diseases[J].Cell Mol Life Sci,2011,68(6):931-949.
[2] Munyaka P,Rabbi M F,Pavlov V A,et al.Central muscarinic cholinergic activation alters interaction between splenic dendritic cell and CD4+CD25-T cells in experimental colitis[J].PLoS One,2014,9(10):e109272.
[3] Wang H,Yu M,Ochani M,et al.Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation[J].Nature,2003,421(6921):384-388.
[4] Stefani G,Slack F J.Small non-coding RNAs in animal development[J].Nat Rev Mol Cell Biol,2008,9(3):219-230.
[5] Fire A,Xu S,Montgomery M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[6] Elbashir S M,Harborth J,Weber K,et al.Analysis of gene function in somatic mammalian cells using small interfering RNAs[J].Methods,2002,26(2):199-213.
[7] Dougherty W G,Lindbo J A,Smith H A,et al.RNA-mediated virus resistance in transgenic plants:exploitation of a cellular pathway possibly involved in RNA degradation[J].Mol Plant Microbe Interact,1994,7(5):544-552.
[8] Soutschek J,Akinc A,BramLage B,et al.Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs[J].Nature,2004,432(7014):173-178.
[9] Leung R K,Whittaker P A.RNA interference:from gene silencing to gene-specific therapeutics[J].Pharmacol Ther,2005,107(2):222-239.
[10] Siolas D,Lerner C,Burchard J,et al.Synthetic shRNAs as potent RNAi triggers[J].Nat Biotechnol,2005,23(2):227-231.
[11] Aigner A.Gene silencing through RNA interference(RNAi)invivo:strategies based on the direct application of siRNAs[J].J Biotechnol,2006,124(1):12-25.
[12] Yang W Q,Zhang Y.RNAi-mediated gene silencing in cancer therapy[J].Expert Opin Biol Ther,2012,12(11):1495-1504.
[13] Dyawanapelly S,Ghodke S B,Vishwanathan R,et al.RNA interference-based therapeutics:molecular platforms for infectious diseases[J].J Biomed Nanotechnol,2014,10(9):1998-2037.
[14] Ballarin-Gonzalez B,Thomsen T B,Howard K A.Clinical translation of RNAi-based treatments for respiratory diseases[J].Drug Deliv Transl Res,2013,3(1):84-99.
[15] Burnett J C,Rossi J J,Tiemann K.Current progress of siRNA/shRNA therapeutics in clinical trials[J].Biotechnol J,2011,6(9):1130-1146.
[16] Miyagishi M,Taira K.Strategies for generation of an siRNA expression library directed against the human genome[J].Oligonucleotides,2003,13(5):325-333.
(2016-08-04 收稿)
Construction of Eukaryotic Expression Vector for Short Hairpin RNA Targeting Gene of Rat α7nAchR and Production of Recombinant Adenovirus
Wang Dingkun1,Lu Fu’er2,Zou Xin2etal
1Department of Integrated Traditional Chinese and Western Medicine,2Institute of Integrated Traditional Chinese and Western Medicine,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To construct eukaryotic expression vector for shRNA targeting gene of rat α7nAchR.Methods We designed and synthesized DNA templates(AY318,AY857,AY444+559,AY318+857)which would encode shRNA of α7nAchR.To construct recombinant plasmid vector which would encode one or two shRNA of α7nAchR,DNA templates listed were connected with linearized plasmid vector (pGenesil-1.1,pGenesil-1.4,pGenesil-1.2,pGenesil-1.3).To identify the recombinant plasmid vectors,DH5a cells were infected with the recombinant plasmid vectors,and plasmids from DH5a were extracted and electrophoresed in 1% agarose gel.To construct recombinant adenovirus plasmid,LR homologous recombination methodinvitrowas used to transfer AY318,AY444+559,AY857 shRNA expression cassettes of shRNA from pGenesil to pGSadeno from adenovirus plasmids,and a similar method was used to identify the recombinant adenovirus plasmid of pGSadeno.To obtain specific titer of recombinant adenovirus,we extracted DNA from the recombinant adenovirus and infected HEK293 cells increasingly.To identify the effect of α7nAchR gene silencing,we infected GH3 cells with the recombinant adenovirus and PCR was applied to detect the expression of α7nAchR mRNA in different groups(pGSadeno+AY318 shRNA,pGSadeno +AY857 shRNA,pGSadeno+AY444+559 shRNA,pGSadeno+HK shRNA and Normal group).Results We succssefully constructed the recombinant plasmids(pGenesil-AY318,AY857,AY318+857 and AY444+559 shRNA)and pGSadeno shRNA.HEK293 cells expressed green fluorescent protein under infection of recombinant adenovirus.The mRNA expression of α7nAchR was decreased in GH3 cells infected with the recombinant adenovirus(pGSadenoAY318,AY857,AY444+559 shRNA),and pGSadeno-AY857 shRNA showed the best effect of α7nAchR gene silencing.Conclusion We have constructed the recombinant adenovirus of pGSadeno-α7nAchR-shRNA successfully,and pGSadeno-AY857 shRNA shows the best effect of gene interference.
α7nAchR; shRNA; gene interference; recombinant plasmid vector; recombinant adenovirus
*国家自然科学基金资助项目(No.81373872,No.81573785)
R34
10.3870/j.issn.1672-0741.2017.04.002
王定坤,男,1986年生,住院医师,医学博士,E-mail:wdkung@163.com
△通讯作者,Corresponding author,E-mail:wkf58@163.com

