miR-551b在人胃癌组织中的表达及对胃癌细胞凋亡的影响*
王娅南, 魏亚宁, 徐 芳, 范翔宇, 张 培,李 赟, 王 盼, 张金库, 郑红婧
河北大学附属医院 1病理科, 2肿瘤内科,保定 071000 3河北省保定第一中心医院病理科,保定 071028 4河北省保定市第七人民医院病理科,保定 072150
miR-551b在人胃癌组织中的表达及对胃癌细胞凋亡的影响*
王娅南1, 魏亚宁2, 徐 芳1, 范翔宇1, 张 培1,李 赟1, 王 盼1, 张金库3△, 郑红婧4
河北大学附属医院1病理科,2肿瘤内科,保定 0710003河北省保定第一中心医院病理科,保定 0710284河北省保定市第七人民医院病理科,保定 072150
目的 探讨miR-551b在人胃癌组织中的表达及对胃癌细胞凋亡的影响。方法 采用Real-time PCR检测胃癌组织、正常胃组织miR-551b表达水平,分别将miRNA无义序列、miR-551b mimics、miR-551b inhibitors转染至人胃癌细胞株SGC-7901,Real-time PCR检测各组细胞miR-551b表达,MTT法检测各组肿瘤细胞增殖活性,Transwell法检测各组细胞侵袭能力,流式细胞术检测各组细胞凋亡情况,Hoechst33342荧光染色观察各组细胞自噬、凋亡的发生,Western blot检测各组细胞NF-κB、LC3Ⅱ、Beclin 1蛋白表达。结果 miR-551b在胃癌组织表达明显下调,胃癌组织miR-551b相对表达量(1.75±0.13)显著低于正常胃组织(2.47±0.38)(P<0.05)。与NC组和miR-551b inhibitors组比较,miR-551b mimics组miR-551b表达水平显著上升,细胞增殖率和侵袭率显著降低,细胞凋亡率明显上升,各指标比较差异均具有统计学意义(均P<0.05)。Hoechst33342荧光染色显示miR-551b mimics组出现大量自噬泡,NC组可见部分自噬泡,而miR-551b inhibitors组仅有少量自噬泡。Western blot检测结果显示,与NC组和miR-551b inhibitors组比较,miR-551b mimics组NF-κB、LC3Ⅱ、Beclin 1蛋白表达水平显著升高(均P<0.05)。结论 miR-551b能够抑制胃癌细胞的增殖和侵袭等细胞生物功能,其作用机制可能是诱导了胃癌细胞发生自噬性凋亡。
微小RNA; 胃癌; 侵袭、 凋亡; 增殖; 自噬性凋亡
胃癌是发病率最高的消化道恶性肿瘤,全世界每年约93.4万新增胃癌患者,且发病率呈逐年上升趋势[1-2]。增殖、侵袭、转移等恶性生物学行为是胃癌高死亡率的主要原因,也是导致胃癌治疗失败的主要诱因[3]。自噬[4](autophagy)作为真核细胞内广泛存在的降解和再循环系统,在废物清除、结构重建、细胞生长发育、蛋白代谢平衡和细胞内环境稳定中起重要作用。微小RNA(miRNA)是一类长度约19~24个核苷酸的内源性非编码RNA分子,作为一类新的癌基因或者抑癌基因,其表达失衡与多种肿瘤的发生密切相关。研究证实miRNA可以调控自噬相关蛋白的表达,从而调控肿瘤的病理过程[5]。胃癌组织miR-551b呈低表达,上调miR-551b表达能够抑制胃癌细胞的增殖和转移,提示miR-551b在胃癌的发展过程中可能发挥着类似抑癌基因的作用[6];但是对miR-551b的具体作用机制依然不清楚。本研究探讨了miR-551b对人胃癌细胞株SGC-7901自噬性凋亡的诱导作用及可能的作用机制,为寻找胃癌治疗的新靶点提供了依据。
1 材料与方法
1.1 标本来源
选择2014年7月至2015年9月河北大学附属医院收治的48例胃癌病例,所有患者均经病理学证实,病理检查时切取部分胃癌组织,同时切取距瘤体边缘10 cm的正常胃组织作为对照,所有标本取出后用医用生理盐水反复冲洗,并置于液氮中保存。本研究样本采集均经过医院伦理委员会批准,患者签署知情同意书。
1.2 细胞与试剂
人胃癌细胞株SGC-7901购自中国科学院细胞资源中心,MTT染料、二甲基亚砜(DMSO)、胎牛血清购自美国Sigma公司,RPMI 1640培养液、胰蛋白酶(0.25%)购自HyClone公司,细胞裂解液、BCA蛋白定量检测试剂盒购自北京天根生化科技有限公司,NF-κB、LC3Ⅱ、Beclin 1抗体,兔抗人β-actin抗体均购自武汉博士德生物工程有限公司,miR-551b mimics、miR-551b inhibitors、miR-551b无义序列、LipofectamineTM2000转染试剂购自美国Invitrogen公司,Trizol提取试剂盒、Real-time PCR试剂盒购自宝生物工程(大连)有限公司,引物购自上海生工生物工程股份有限公司,Hoechst33342染色液购自上海晶都生物技术有限公司,Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒购自Invitrogen公司,Transwell小室购自美国Costar公司。
1.3 实验方法
1.3.1 胃癌组织、正常胃组织miR-551b表达检测液氮中取出胃癌组织和正常胃组织,充分研磨,加入Trizol(1 mL/100 mg)和150 μL氯仿充分混匀,15 000 r/min离心10 min;吸取上清液再加入200 μL异丙醇混匀,15 000 r/min离心10 min,上清液弃去,75%乙醇洗涤沉淀。取5 μg总RNA,采用Real-time PCR检测miR-551b表达水平,引物委托上海生工生物工程有限公司合成,上游引物:5′-CTGAGCGACCCATACTTGG-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′,PCR反应体系:10×缓冲液7 μL,Taq DNA酶0.5 μL,dNTP 5 μL,上下游引物各1 μL,DNA模板5 μL,双蒸水补充至50 μL。PCR反应条件:94℃预变性3 min,94℃变性30 s,62℃ 40 s,72℃ 1 min,30个循环后74℃延伸5 min。以U6作为内参照,检测组织miR-551b相对表达量。
1.3.2 SGC-7901细胞转染 取复苏后的SGC-7901细胞株,置于RPMI 1640培养液(含10%胎牛血清),在37℃、5%CO2条件下培养。取对数生长期细胞,用不含血清的培养液洗涤3次,再用培养液将细胞重悬于不含抗生素的完全培养液中,调整细胞密度1×106个/孔,再转入6孔板中培养。将细胞分为3组:阴性对照组(negative control,NC):将5 μL miRNA无义序列、2 μL Lipofectamine2000加入至200 μL不含血清的培养液中混匀,静置5 min直接加入至6孔板细胞中培养;miR-551b模拟物(miR-551b mimics)组:加入5 μL浓度为20 nmol/L的miR-551b mimics和2 μL Lipofectamine2000;miR-551b抑制物(miR-551b inhibitors)组:加入5 μL浓度为20 nmol/L的miR-551b inhibitors和2 μL Lipofectamine2000;转染后在培养箱中以37℃培养5~6 h,再将培养液更换为含有胎牛血清和抗生素的培养液继续培养24 h。
1.3.3 MTT法检测各组肿瘤细胞增殖 将转染后的各组细胞以1.0×107个/L接种于96孔板中,分别于12、24、36、48、60、72 h向每孔加入10 μL、5 g/L MTT溶液,培养4 h后将培养液弃去,再向每孔中加入150 μL DMSO,充分振荡,置于酶标仪上,测量570 nm处吸光度值。
1.3.4 Transwell法检测各组细胞侵袭能力 将转染的各组细胞用不含血清的培养液调整浓度为1.0×109个/L,Transwell上室每孔植入150 μL细胞,下室加入600 μL含有20%胎牛血清的RPMI 1640培养液,每组分别设置6个复孔,细胞培养48 h,待培养结束后将Transwell小室滤膜用4%多聚甲醛固定,轻轻拭去表面细胞;结晶紫染色10 min,PBS冲洗3次,于显微镜下观察穿透滤膜的细胞数。
1.3.5 流式细胞术检测细胞凋亡 收集转染24 h的细胞,5 000 r/min离心5 min,收集细胞;75%乙醇以4℃固定24 h,1 500 r/min离心5 min弃去乙醇,PBS冲洗;按照Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒说明书对细胞进行处理,流式细胞仪分析结果。
1.3.6 Hoechst33342染色 取对数生长期细胞,分别接种于6孔板中,继续培养6 h,再加入0.5 mL固定液于4℃固定过夜;再加入1 mL Hoechst33342染色液染色10 min,荧光显微镜下观察并拍照。
1.3.7 Western blot检测各组细胞NF-κB、LC3Ⅱ、Beclin 1蛋白表达 收集对数生长期细胞,加入100 μL含1%PMSF的细胞裂解液充分裂解,4℃15 000 r/min离心20 min,吸取上清液,将上清液移至EP管中,加入等量上样液,100℃煮沸5 min,使蛋白完全变性。SDS-PAGE电泳分离蛋白,并转移至PVDF膜上,100 mA、40 min电转后将PVDF膜取出。5%脱脂牛奶封闭2 h,加入1∶1 000 NF-κB抗体、1∶1 000 LC3Ⅱ抗体、1∶500 Beclin 1抗体、1∶50 β-actin抗体,4℃孵育过夜。PBS冲洗3次,再按照1∶1 000加入二抗,室温下振荡孵育2 h,PBS冲洗3次。ECL显色,凝胶成像分析仪采集图像,测定目的蛋白灰度值,目的蛋白相对表达量为样本条带与β-actin条带灰度值比值。
1.4 统计学方法

2 结果
2.1 胃癌组织、正常胃组织miR-551b表达
miR-551b在胃癌组织表达明显下调,胃癌组织miR-551b相对表达量(1.75±0.13)显著低于正常胃组织(2.47±0.38)(P<0.05)。
2.2 转染miR-551b mimics和miR-551b inhibitors后各组细胞miR-551b表达
转染24 h后,与NC组和miR-551b inhibitors组比较,miR-551b mimics组miR-551b表达水平显著上升(均P<0.05),与NC组比较,miR-551b inhibitors组miR-551b表达水平显著降低(P<0.05),说明miR-551b mimics能够上调miR-551b表达,miR-551b inhibitors能够下调miR-551b表达,见图1。
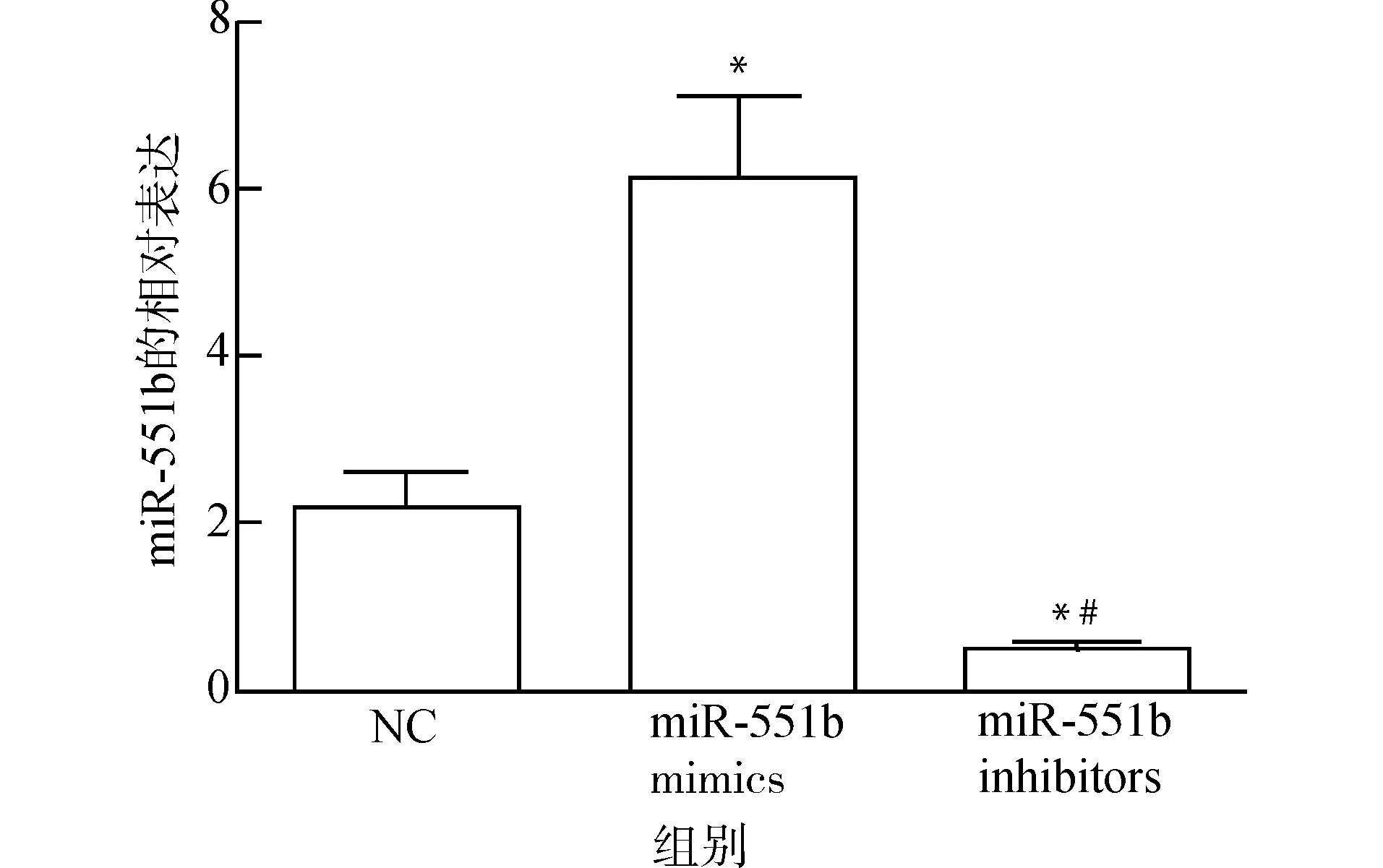
与NC组比较,*P<0.05;与miR-551b mimics组比较,#P<0.05图1 各组细胞miR-551b表达Fig.1 miR-551b expression level in each group
2.3 各组细胞增殖能力的变化
在24~72 h时间内,miR-551b mimics组细胞增殖显著低于NC组和miR-551b inhibitors组(均P<0.05),见图2。
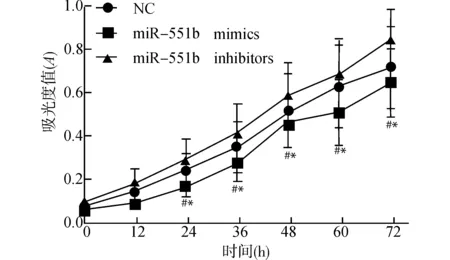
与miR-551b inhibitors组比较,#P<0.05;与NC组比较,*P<0.05图2 各组细胞增殖能力的变化Fig.2 Changes of proliferation ability in each cell group
2.4 各组细胞侵袭能力的变化
NC组、miR-551b mimics组、miR-551b inhibitors组细胞侵袭率分别为(52.01±2.01)%、(45.37±1.72)%、(94.47±3.07)%,与NC组和miR-551b inhibitors组比较,miR-551b mimics组细胞侵袭率显著降低(均P<0.05);与NC组比较,miR-551b inhibitors组细胞侵袭率显著上升(P<0.05),见图3。
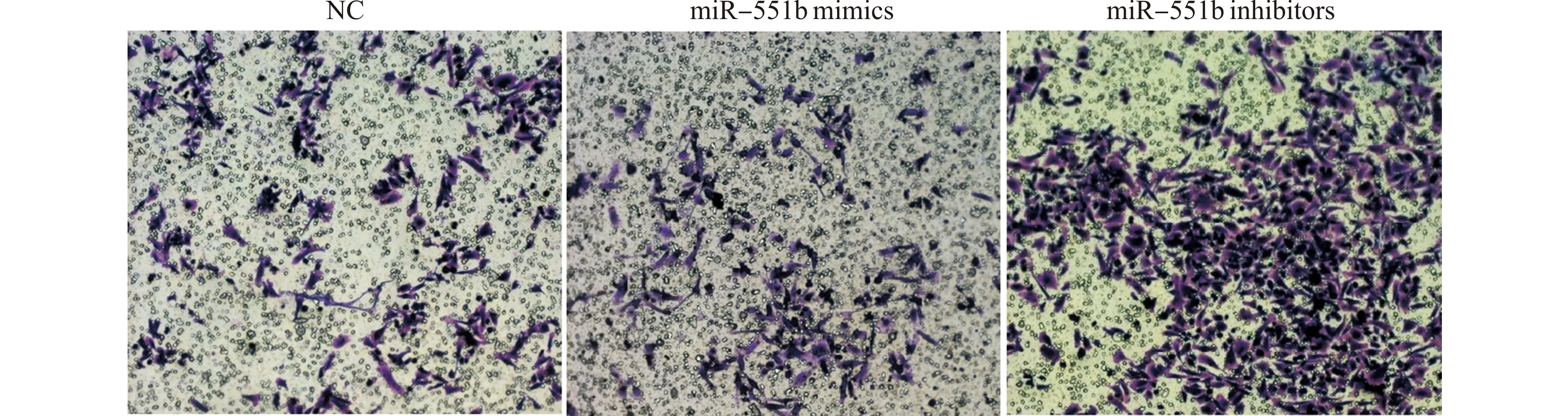
图3 各组细胞侵袭能力的变化(结晶紫染色,×200)Fig.3 Changes of invasion ability in each cell group(Crystal violet staining,×200)
2.5 各组细胞凋亡情况
NC组、miR-551b mimics组、miR-551b inhibitors组细胞凋亡率分别为(44.05±16.21)%、(72.31±22.79)%、(35.30±11.27)%,与NC组和miR-551b inhibitors组比较,miR-551b mimics组细胞凋亡率明显上升(均P<0.05);与NC组比较,miR-551b inhibitors组细胞凋亡率显著降低(P<0.05),见图4。
2.6 各组细胞自噬形态变化
Hoechst33342荧光染色结果显示,miR-551b mimics组出现大量自噬泡(亮蓝色),NC组可见部分自噬泡,而miR-551b inhibitors组仅有少量自噬泡,见图5。
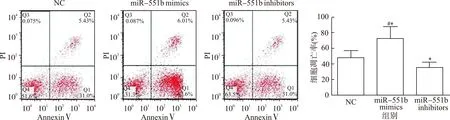
与miR-551b inhibitors组比较,#P<0.05;与NC组比较*P<0.05图4 各组细胞凋亡情况Fig.4 Changes of cell apoptosis in each cell group
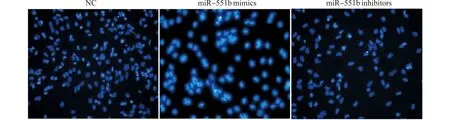
图5 各组细胞自噬形态变化(Hoechst 33342染色,×400)Fig.5 Morphological changes of cell autophagy of each cell group(Hoechst 33342 staining,×400)
2.7 各组细胞NF-κB、LC3Ⅱ、Beclin 1蛋白表达
与NC组和miR-551b inhibitors组比较,miR-551b mimics组NF-κB、LC3Ⅱ、Beclin 1蛋白表达水平显著升高(均P<0.05);与NC组比较,miR-551b inhibitors组NF-κB、LC3Ⅱ、Beclin 1蛋白表达水平显著降低(均P<0.05),见图6。
3 讨论
miRNA[7-8]是一类近年来新发现的在转录翻译水平调控靶基因蛋白表达的非编码小RNA,虽然其分子小、数量少,但却调控着大量基因的表达。目前已经证实miRNA在肿瘤的发生、发展中发挥重要调控作用[9]。在关于胃癌的研究中,已经发现了部分miRNA,如miR-29a、miR-15a、miR-124、miR-551b等。温馨等[10]报道,miR-551b在胃癌组织中表达异常,检测miR-551b可以为诊断胃癌和预测病情提供参考。叶敏等[11]认为miR-551b可能是作为一个抑癌基因参与胃癌的进展,抑制miR-551b表达能够明显促进胃癌的进展。本研究对胃癌组织和正常胃组织miR-551b表达水平进行检测,结果显示miR-551b在胃癌组织表达明显下调,胃癌组织miR-551b相对表达量显著低于正常胃组织,说明miR-551b可能对胃癌的进展起到负调控作用。陈兆峰等[12]对40例胃癌和正常胃组织标本进行检测,结果显示miR-551b在胃癌组织表达降低,且表达水平与肿瘤体积、侵袭程度、转移分期呈负相关,提示miR-551b可能作为抑癌因子参与胃癌的侵袭、转移等生物学过程。
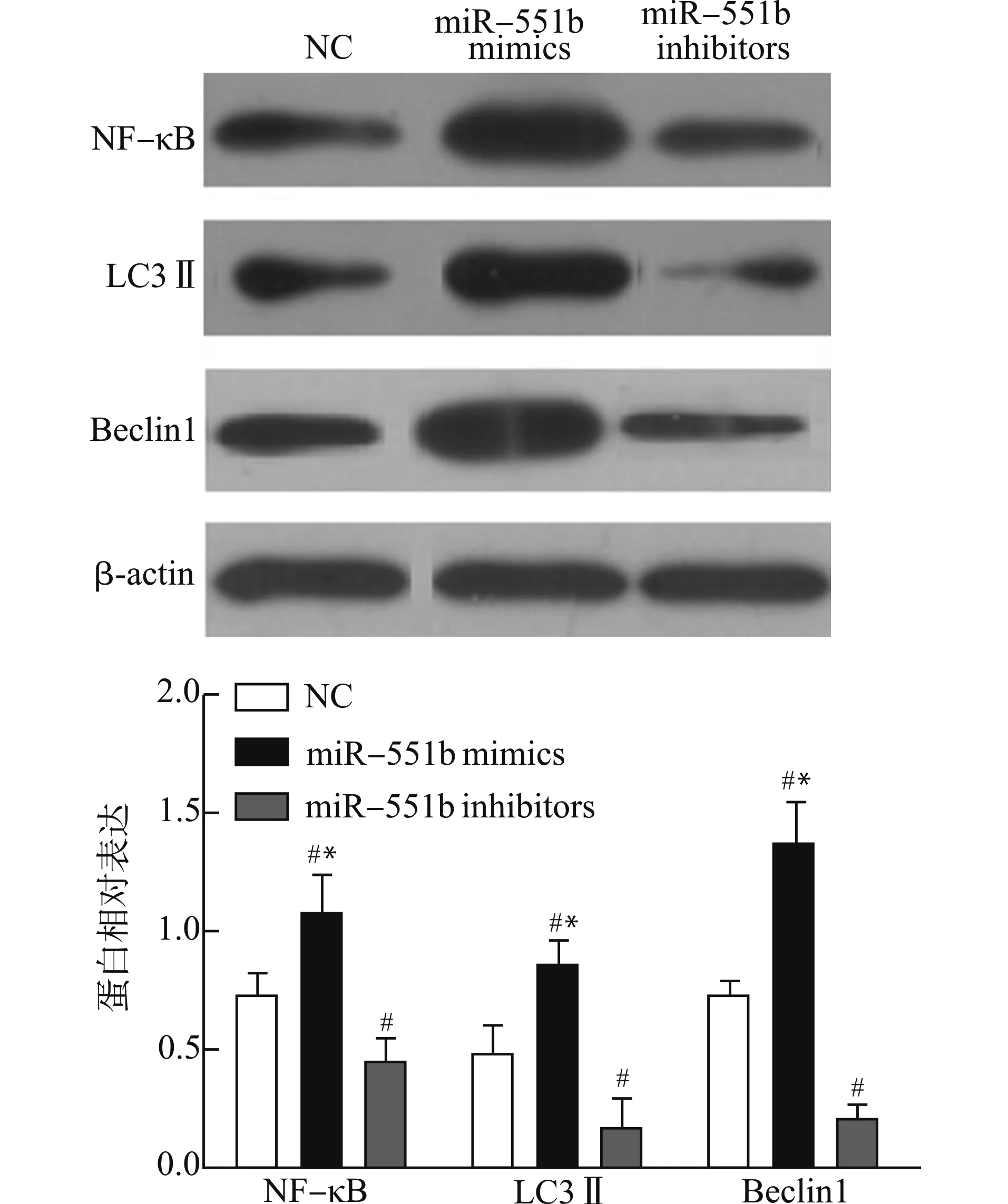
与miR-551b inhibitors组比较,*P<0.05;与NC组比较,#P<0.05图6 各组细胞NF-κB、LC3Ⅱ、Beclin 1蛋白表达Fig.6 NF-κB,LC3Ⅱ,Beclin 1 protein expression in each cell group
既往研究证实,miRNA与肿瘤的增殖、耐药、侵袭、转移等细胞功能密切相关,如miR-124与胃癌进展有关,miR-15a可能参与调控胃癌的增殖和侵袭等[13-14]。本研究以人胃癌细胞株SGC-7901作为研究对象,分别将miR-551b mimics、miR-551b inhibitors和miR-551b无义序列转染至SGC-7901细胞,经过Real-time PCR检测发现miR-551b mimics能够上调miR-551b表达,miR-551b inhibitors能够下调miR-551b表达,证实转染成功。进一步分析发现与NC组和miR-551b inhibitors组比较,miR-551b mimics组细胞细胞增殖率和侵袭率显著降低,细胞凋亡率明显上升,证实miR-551b在胃癌细胞功能中主要发挥抑癌作用。丁丽芳等[15]发现大肠癌组织miR-551b表达量显著低于正常组织,并且miR-551b表达量与临床分期、淋巴结转移呈负相关。韦尉元等[16]将miR-551b mimics转染至胃癌细胞,发现miR-551b能够抑制胃癌细胞中靶基因PRL-3的蛋白表达,并进一步抑制胃癌细胞的侵袭、转移。
自噬是在真核细胞中广泛存在的降解和再循环系统,其主要过程是吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程。饥饿、氧化、压力等应激状态均是自噬的诱导因素[17],目前关于自噬的具体分子机制尚不明确,可能与细胞代谢失衡有关。实验证实,化疗、放疗等治疗因素能够激活自噬活动,提高肿瘤细胞对环境刺激的适应性[18];但是过度自噬又可以诱导自噬性凋亡。鉴于自噬在细胞生长过程中的双刃剑作用,对自噬相关信号转导通路分子机制研究就显得尤为重要。研究证实,miRNA可以调控自噬相关蛋白的表达,从而调控肿瘤的病理过程[19]。本研究显示,miR-551b mimics组出现大量自噬泡,NC组可见部分自噬泡,而miR-551b inhibitors组仅有少量自噬泡,并且miR-551b mimics组细胞膜结构模糊不清,凋亡率增加,证实miR-551b可诱导胃癌细胞发生自噬性凋亡。
NF-κB是转录调节的核蛋白因子,NF-κB被激活后能够参与肿瘤细胞程序性凋亡。Ho等[20]证实放疗、化疗等能够诱导胃癌细胞NF-κB表达,促进细胞发生凋亡。LC3Ⅱ是定位于自噬泡内膜的蛋白,激活LC3前体能够形成LC3Ⅰ,LC3Ⅰ暴露的甘氨酸残基能够与自噬泡内膜磷脂酰乙醇胺结合,并修饰为膜型(LC3Ⅱ)。因此LC3Ⅱ的含量能够间接反映自噬泡的数量[21]。Beclin 1是调节细胞自噬的重要蛋白[22],Beclin 1与相应受体PI3K3C结合成Beclin 1/PI3K3C复合物后,能够激活细胞自噬调节通路,参与调节细胞自噬过程。本研究显示miR-551b mimics组凋亡蛋白NF-κB及自噬相关因子LC3Ⅱ、Beclin 1表达水平均显著升高,提示NF-κB可能通过调节自噬相关因子的表达,参与了胃癌细胞自噬性凋亡。
综上所述,miR-551b能够抑制胃癌细胞的增殖和侵袭等细胞生物学特性,其作用机制可能是诱导了胃癌细胞发生自噬性凋亡,为胃癌的治疗提供了新的作用靶点。
[1] Van Cutsem E,Dicato M,Geva R,et al.The diagnosis and management of gastric cancer:expert discussion and recommendations from the 12th ESMO/World Congress on Gastrointestinal Cancer,Barcelona,2010[J].Ann Oncol,2011,22(Suppl.5):v1-9.
[2] Hanisch E,Batsis C.Clinicopathologic characteristics of colorectal cancer patients with synchronous and metachronous gastric cancer[J].World J Surg,2011,35(3):700-701.
[3] Ramachandran L,Manu K A,Shanmugam M K,et al.Isorhamnetin inhibits proliferation and invasion and induces apoptosis through the modulation of peroxisome proliferator-activated receptor γ activation pathway in gastric cancer[J].J Biol Chem,2012,287(45):38028-38040.
[4] Lassen K G,Kuballa P,Conway K L,et al.Atg16L1T300A variant decreases selective autophagy resulting in altered cytokine signaling and decreased antibacterial defense[J].Proc Natl Acad Sci U S A,2014,111(21):7741-7746.
[5] Gibbings D,Mostowy S,Jay F,et al.Selective autophagy degrades DICER and AGO2 and regulates miRNA activity[J].Nat Cell Biol,2012,14(12):1314-1321.
[6] Xu X,Wells A,Padilla M T,et al.A signaling pathway consisting of miR-551b,catalase and MUC1 contributes to acquired apoptosis resistance and chemoresistance[J].Carcinogenesis,2014,35(11):2457-2466.
[7] Kleftogiannis D,Korfiati A,Theofilatos K,et al.Where we stand,where we are moving:Surveying computational techniques for identifying miRNA genes and uncovering their regulatory role[J].J Biomed Inform,2013,46(3):563-573.
[8] Barvkar V T,Pardeshi V C,Kale S M,et al.Genome-wide identification and characterization of microRNA genes and their targets in flax(Linum usitatissimum):Characterization of flax miRNA genes[J].Planta,2013,237(4):1149-1161.
[9] 黄孝文,许胜,褚汉启,等.MiRNA Let-7和Lin28在散发性听神经瘤中的表达及意义[J].华中科技大学学报:医学版,2013,42(5):520-524.
[10] 温馨,翟頔,王芳,等.miR-551b-3p在胃癌组织中低表达并抑制胃癌细胞系HGC-27的增殖、迁移和侵袭[J].基础医学与临床,2016,36(5):610-614.
[11] 叶敏,聂玉强,陈熙,等.胃癌组织中microRNA的差异表达[J].中华生物医学工程杂志,2011,17(5):403-406.
[12] 陈兆峰,刘晓光,刘敏,等.miR-551b-3p在胃癌细胞和组织中的表达及其临床意义[J].中华肿瘤杂志,2014,36(12):903-904.
[13] Kumar S,Keerthana R,Pazhanimuthu A,et al.Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J].Indian J Biochem Biophys,2013,50(3):210-214.
[14] Zadran S,Remacle F,Levine R D.miRNA and mRNA cancer signatures determined by analysis of expression levels in large cohorts of patients[J].Proc Natl Acad Sci U S A,2013,110(47):19160-19165.
[15] 丁丽芳,姜藻,陈巧云,等.miR-520a靶基因PIK3CA结合位点多态性与中国汉族人群大肠癌易感性的关联研究[J].中国癌症杂志,2015,25(3):184-189.
[16] 韦尉元,曹稳珑,詹泽栩,等.miR-1284过表达对人胃癌SGC-7901细胞基因表达谱及侵袭转移的影响[J].中国癌症杂志,2015,25(9):659-664.
[17] Salminen A,Kaarniranta K,Kauppinen A.Beclin 1 interactome controls the crosstalk between apoptosis,autophagy and inflammasome activation:impact on the aging process[J].Ageing Res Rev,2013,12(2):520-534.
[18] Khan M I,Mohammad A,Patil G,et al.Induction of ROS,mitochondrial damage and autophagy in lung epithelial cancer cells by iron oxide nanoparticles[J].Biomaterials,2012,33(5):1477-1488.
[19] McAfee Q,Zhang Z,Samanta A,et al.Autophagy inhibitor Lys05 has single-agent antitumor activity and reproduces the phenotype of a genetic autophagy deficiency[J].Proc Natl Acad Sci U S A,2012,109(21):8253-8258.
[20] Ho H H,Chang C S,Ho W C,et al.Gallic acid inhibits gastric cancer cells metastasis and invasive growth via increased expression of RhoB,downregulation of AKT/small GTPase signals and inhibition of NF-κB activity[J].Toxicol Appl Pharmacol,2013,266(1):76-85.
[21] Hanna R A,Quinsay M N,Orogo A M,et al.Microtubule-associated protein 1 light chain 3(LC3)interacts with Bnip3 protein to selectively remove endoplasmic reticulum and mitochondria via autophagy[J].J Biol Chem,2012,287(23):19094-19104.
[22] Salminen A,Kaarniranta K,Kauppinen A,et al.Impaired autophagy and APP processing in Alzheimer’s disease:The potential role of Beclin 1 interactome[J].Prog Neurobiol,2013,106-107:33-54.
(2016-10-27 收稿)
Expression of miR-551b in Human Gastric Carcinoma and Its Effect on Apoptosis of Human Gastric Carcinoma Cell Lines
Wang Ya’nan1,Wei Yaning2,Xv Fang1etal
1Department of Pathology,2Department of Medical Oncology,the Affiliated Hospital of Hebei University,Baoding 071000,China
Objective To explore miR-551b expression in human gastric carcinoma and effect of miR-551b on autophagic apoptosis of human gastric carcinoma cell lines.Methods The miR-551b expression in gastric cancer tissues and normal gastric tissues was detected by real-time PCR.miRNA nonsense sequences,miR-551b mimics,miR-551b inhibitors were transfected into human gastric carcinoma SGC-7901 cell lines,and miR-551b expression in the cells of each group was detected by real-time PCR.Proliferation activity of tumor cells was detected by MTT assay;invasion ability of tumor cells was detected by Transwell method;cell apoptosis was detected by flow cytometry;autophagy and apoptosis in each group was observed by Hoechst33342 fluorescence staining;protein expression of NF-κB,LC3Ⅱ and Beclin 1 was detected by Western blotting.Results The expression of miR-551b in gastric carcinoma was significantly down-regulated,and the relative expression of miR-551b(1.75±0.13)in gastric carcinoma was significantly lower than that in normal gastric tissue(2.47±0.38)(P<0.05).Compared with NC group and miR-551b inhibitors group,miR-551b expression level in miR-551b mimics group was significantly increased,proliferation rate and invasion rate were significantly decreased,apoptosis rate significantly increased(allP<0.05).Hoechst33342 fluorescence staining showed that large number of autophagy bubbles appeared in miR-551b mimics group,some autophagy bubbles in NC group,and only a small number of autophagy bubbles in miR-551b inhibitors group.Western blotting showed that,as compared with NC group and miR-551b inhibitors group,expression levels of NF-κB,LC3Ⅱ and Beclin 1 in miR-551b mimics group were significantly increased(P<0.05).Conclusion MiR-551b can inhibit the proliferation and invasion of gastric cancer cells,and the action mechanism may be related to inducing the autophagic apoptosis of gastric cancer cells.
micro RNA; gastric cancer; invasion; apoptosis; proliferation; autophagy apoptosis
*国家自然科学基金资助项目(No.81672706)
R735.2
10.3870/j.issn.1672-0741.2017.04.004
王娅南,女,1978年生,副主任医师,E-mail:wangyanan1610@163.com
△通讯作者,Corresponding author,E-mail:zhangjinku_001@163.com

