c-Abl基因在AngⅡ诱导血管平滑肌细胞氧化应激中的作用*
孙图成, 周先吾, 李华东, 陈 澍, 许 菲 , 蒋雄刚△
1广东省心血管病研究所,广东省人民医院心血管外科,广东省医学科学院,广州 510080 2华中科技大学同济医学院附属协和医院心血管外科,武汉 430022 3武汉大学附属中南医院消化内科,武汉 430071
c-Abl基因在AngⅡ诱导血管平滑肌细胞氧化应激中的作用*
孙图成1#, 周先吾2#, 李华东2, 陈 澍2, 许 菲3, 蒋雄刚2△
1广东省心血管病研究所,广东省人民医院心血管外科,广东省医学科学院,广州 5100802华中科技大学同济医学院附属协和医院心血管外科,武汉 4300223武汉大学附属中南医院消化内科,武汉 430071
目的 探讨c-Abl基因在血管紧张素Ⅱ(AngⅡ)诱导血管平滑肌细胞(VSMCs)氧化应激中的作用。方法 构建c-Abl基因过表达和沉默的慢病毒载体,并利用慢病毒转染的方法构建c-Abl过表达和沉默的VSMCs。实验分6组:①对照组、②AngⅡ组、③STI571组、④lenti-control组、⑤lenti-cAbl-shRNA组、⑥lenti-cAbl组。①~③组为正常VSMCs,③组用STI571预处理,④~⑥组为分别利用lenti-control、lenti-cAbl-shRNA、lenti-cAbl转染VSMCs,对照组用生理盐水干预,其余实验组用AngⅡ(1×10-7mol/L)干预30 min,并用Western blot测定c-Abl和p-cAbl蛋白表达量;活性氧测定:对照组用生理盐水干预,其余实验组用AngⅡ(1×10-7mol/L)干预36 h,流式细胞仪分别检测其活性氧分子(ROS)、二氢罗丹明(DHR)、二氢乙啶(DHE)水平。结果 AngⅡ刺激后,与对照组比较,lenti-cAbl组的c-Abl和p-cAbl蛋白表达最强,STI571组和lenti-cAbl-shRNA组p-cAbl蛋白表达最弱,而lenti-control组与AngⅡ组c-Abl和p-cAbl蛋白水平无明显差异。AngⅡ干预36 h后,VSMCs氧化应激产物(ROS、DHE、DHR)均增加,但lenti-cAbl组氧化应激水平最高,lenti-cAbl-shRNA组、STI571组的氧化应激水平较AngⅡ组有所降低。结论 利用慢病毒载体构建过表达c-Abl基因的VSMCs细胞系获得成功;c-Abl基因表达的增加与AngⅡ刺激下VSMCs的氧化应激程度呈正相关。
慢病毒载体; c-Abl基因; 血管平滑肌细胞; 氧化应激; 血管紧张素Ⅱ
主动脉夹层的发病机制尚未完全明了,近年来研究表明,主动脉壁中层血管平滑肌细胞(vascular smooth muscle cells,VSMCs)功能和结构的改变可能是导致主动脉夹层发生的原因之一[1]。
c-Abl基因编码的Abelson酪氨酸激酶(c-Abl)属于Src非受体酪氨酸激酶家族成员,其构成细胞骨架,参与细胞转化生长、细胞凋亡、细胞周期、感染和免疫等病理生理过程[2-3]。c-Abl在静息时为非活化状态,而磷酸化后形成p-cAbl行使激酶功能。我们前期的研究证实c-Abl基因与VSMCs的生物学行为相关,Abl基因敲除导致Crk相关底物(CAS)蛋白磷酸化和粘附相关的支架蛋白表达下降,肌动蛋白聚合受到抑制,VSMCs的张力降低[4]。同时,我们检测主动脉夹层患者的主动脉标本发现,与正常对照(心脏移植的供心)相比,夹层患者的主动脉标本中c-Abl活性和凋亡相关蛋白表达均增加[5]。但c-Abl基因与VSMCs的氧化应激的关系目前尚无研究报道。
为了研究c-Abl基因在血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导VSMCs氧化应激中的作用,我们拟构建c-Abl基因过表达和沉默的慢病毒载体,并转染VSMCs,构建c-Abl基因过表达和沉默的VSMCs,通过观察不同c-Abl活性的VSMCs对AngⅡ诱导的氧化应激的反应,从而进一步揭示c-Abl基因在主动脉夹层发生发展中的作用。
1 材料与方法
1.1 实验细胞
小鼠主动脉VSMCs细胞:美国ATCC细胞库中国代理公司;293T、HeLa细胞:中国科学院细胞库。
1.2 主要实验试剂
lipo 2000、嘌呤霉素(Puromycin):美国Invitrogen公司;DMEM高糖培养液、胎牛血清、opti-MEM:美国Gibco公司;表达质粒:永联生物科技(上海)有限公司;包装质粒:美国ADDGENE公司;DMSO、TBS缓冲液、青-链霉素双抗、胰蛋白酶、AngⅡ:美国Sigma公司;信号转导抑制剂-571(STI571):美国Selleck公司;c-Abl shRNA慢病毒颗粒、对照的shRNA慢病毒颗粒、copGFP对照的慢病毒颗粒:美国Santa Cruz公司;鼠抗β-actin抗体:天津三箭公司;兔抗P-CABL抗体:美国Assay Biotech公司;兔抗CABL抗体:美国Santa Cruz公司;活性氧检测试剂盒、Dihydroethidium(超氧化物阴离子荧光探针):上海碧云天公司;活性氧ROS荧光探针Dihydrorhodamine:南京凯基生物公司。
1.3 实验方法
1.3.1 慢病毒载体的构建 (1)XbaⅠ和BamHⅠ分别酶切pUC57-cAbl和pCDH-EF1-MCS-T2A-PURO;(2)DNA凝胶电泳分别回收cAbl及pCDH骨架,大小分别为3 435 bp和7 066 bp;(3)利用T4连接酶对片段进行连接;(4)连接上目的基因的质粒转化大肠埃希菌,让目的基因在大肠埃希菌里扩增,然后提取质粒。
1.3.2 慢病毒包装与浓缩 在准备好的293T细胞中,加入表达质粒及包装质粒(pCDH-EF1-PURO-cAbl∶pSpAX2.0∶pCMV-VSV-G = 12 μg∶8 μg∶4 μg)以及500 μL的无血清Opti-MEM,轻柔混匀后加入lipo2000室温孵育,将DNA溶液和脂质体溶液轻柔混匀,室温孵育。293T细胞更换新鲜培养液后,加入上述的混合物,12 h后换液。转染48~72 h后收集含病毒的上清液,离心后加入5×PEG-8000 NaCl母液(NaCl 8.766 g∶PEG-8000 50 g溶解于200 mL Milli-Q纯水中)5 mL。混匀、过夜、离心、弃上清,加入适量的慢病毒溶解液溶解慢病毒沉淀。浓缩后的病毒悬液储存于-80 ℃冰箱。
1.3.3 慢病毒滴度测定 将病毒按稀释度分别为1∶105~109梯度稀释,将稀释好的病毒液接种于HeLa细胞中,接种病毒24 h后,加终浓度为0.3 μg/mL的嘌呤霉素处理细胞7 d后,选取合适的稀释度,计数HeLa细胞的细胞集落个数,并计算病毒滴度。病毒滴度=细胞集落个数×病毒稀释度(单位:TU/mL)。在本实验中,构建的过表达慢病毒滴度为:1×1010TU/mL。
1.3.4 感染复数(MOI)的测定 将copGFP 对照的慢病毒颗粒在冰上解冻后,按MOI值分别为1、10、100的比例,把溶解的copGFP对照的慢病毒颗粒加入计数好的VSMCs中,12 h后换液继续培养。24~48 h后荧光显微镜下观察荧光强度,为下一步慢病毒转染挑选出合适的MOI值。
1.3.5 构建稳定转染的VSMCs 将c-Abl shRNA慢病毒颗粒、对照的shRNA慢病毒颗粒、c-Abl慢病毒颗粒在冰上解冻后,分别按合适的MOI值加入VSMCs中,12 h后换液。24~48 h后加入嘌呤霉素进行筛选,每3天换1次含有嘌呤霉素的培养液,1周后通过Western blot验证转染细胞系是否成功构建。
1.3.6 实验分组 实验分成6组:①对照组、②AngⅡ组、③STI571组、④lenti-control组、⑤lenti-cAbl-shRNA组、⑥lenti-cAbl组。①~③组为正常VSMCs,其中,③组加入终浓度为2×10-6mol/L的STI571预干预2 h;④~⑥组为分别利用lenti-control、lenti-cAbl-shRNA、lenti-cAbl慢病毒载体转染的VSMCs。
1.3.7 Western blot检测 分组同前,对照组进行生理盐水干预,其余各实验组加入AngⅡ(1×10-7mol/L),30 min后收集各实验组的细胞,提取蛋白后-80℃冷冻。用BCA法测样品蛋白浓度,计算所需蛋白量。依据要求加入蛋白样品30 μg和蛋白marker 5 μL,制10%的SDS-PAGE分离胶和5%浓缩胶。电泳初始为60 V,待溴酚蓝指示剂在2种胶分界处时电压调至100 V。恒流280 mA转移90 min。一抗孵育后加入相应二抗(抗体稀释比:β-actin 1∶8 000,兔抗P-CABL抗体1∶1 000,兔抗CABL抗体1∶500)。化学发光,显影和定影,曝光,得到胶片。实验结果判读:阳性条带以Quantity One 4.62版凝胶吸光度分析软件进行分析。
1.3.8 氧化应激检测 分组同前,对照组进行生理盐水干预,其余各实验组AngⅡ(1×10-7mol / L)处理,36 h后胰酶消化收集各组细胞后装载探针。ROS检测:稀释DCFH-DA使终浓度为10 μL/L,细胞收集好后悬浮于配好的DCFH-DA中;DHE检测:Dihydroethidium探针用DMSO稀释成15 mmol/L储存浓度,-20℃保存,按照1∶3 000用无血清培养液稀释Dihydroethidium,使终浓度为5 μmol/L;DHR检测:按照1∶300用无血清培养液稀释Dihydrorhodamine,使终浓度为10 mmol/L。细胞浓度均为1×108/mL,在37℃培养箱中孵育细胞20 min;孵育终止后用无血清培养液洗涤3次,PBS重悬细胞,上机检测;流式细胞仪各项数据分析采用WinMDI 2.9软件进行。
1.4 统计学分析
2 结果
2.1 质粒图谱
本研究设计的c-Abl过表达质粒载体图谱见图1。
2.2 酶切验证
目的基因克隆PCR产物琼脂糖凝胶电泳结果(图2),与设计的克隆片段大小相符。
2.3 病毒转染MOI值测定
按MOI值分别为1、10、100的比例,把copGFP对照的慢病毒颗粒转染VSMCs,培养24 h后换液,荧光显微镜下观察到:随着MOI值的倍增,细胞荧光的亮度增加,遂以MOI值100作为细胞感染密度(图3)。

图1 pCDH-EF1-MCS-T2A-Puro-cAbl质粒图谱Fig.1 Plasmid map of pCDH-EF1-MCS-T2A-Puro-cAbl
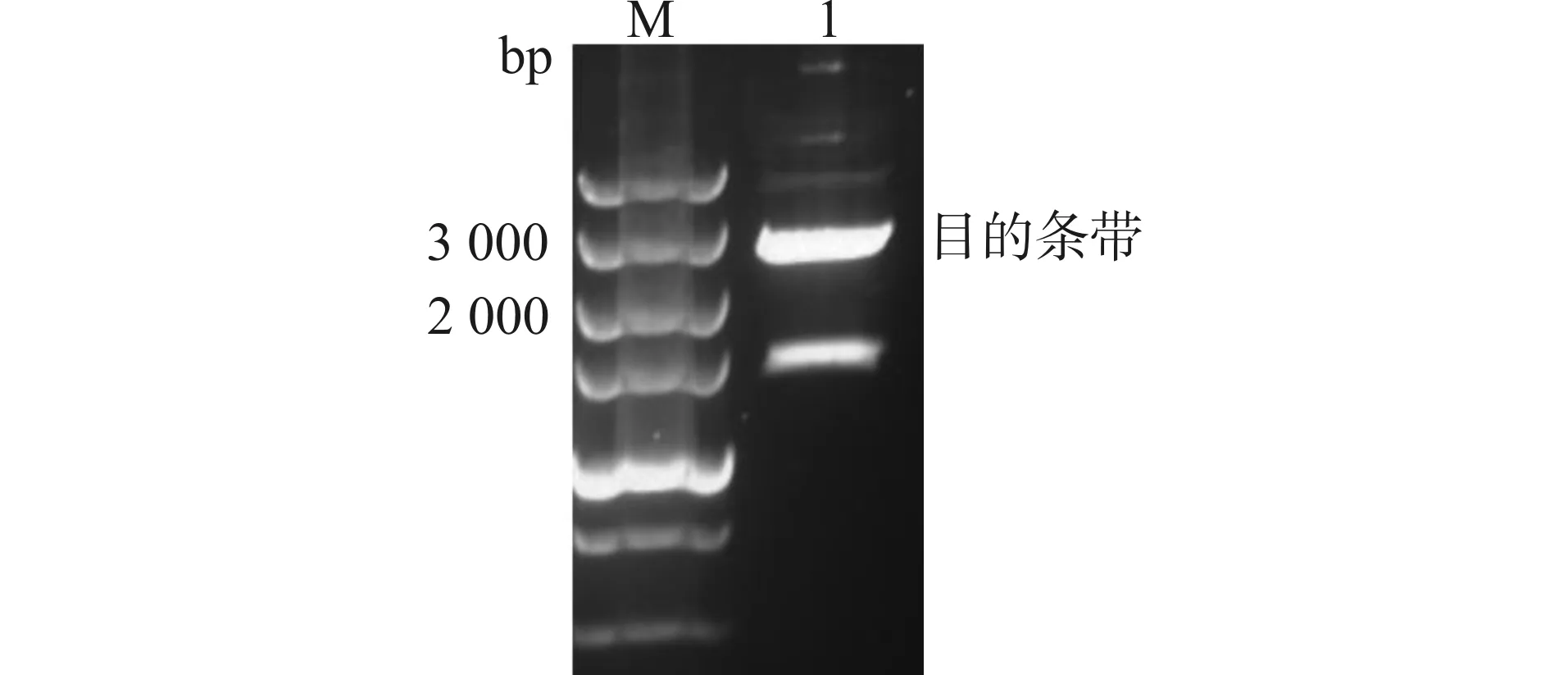
M:Marker;1:PCR产物图2 pUC57-cAbl酶切图Fig.2 Digestion of pUC57-cAbl by XbaⅠand BamHⅠ
2.4 转染后过表达及沉默VSMCs的c-Abl和p-cAbl蛋白表达
6孔板培养不同组细胞,密度达到70%时,对除对照组外的实验组进行AngⅡ(1×10-7mol/L)干预30 min(对照组用生理盐水干预30 min),并用Western blot测定c-Abl和p-cAbl蛋白表达量。由结果(图4)可知:慢病毒可稳定转染并传代,转染后的c-Abl蛋白表达符合预期,AngⅡ刺激后,与对照组比较,过表达组(lenti-cAbl组)的c-Abl和p-cAbl蛋白表达最强(P<0.05,P<0.01),c-Abl激活抑制组(STI571组)和沉默组(lenti-cAbl-shRNA组)p-cAbl蛋白表达最弱(均P<0.01),而慢病毒对照组(lenti-control)与AngⅡ组无明显差别(P>0.05),但均较对照的p-cAbl蛋白水平有明显升高(均P<0.01)。以上实验结果表明,慢病毒过表达VSMCs细胞系构建成功。

A:MOI值=1;B:MOI值=10;C:MOI值=100图3 不同MOI值的慢病毒转染VSMCs后的荧光照片(×200)Fig.3 Fluorescence pictures of VSMCs transfected with lentivirus of different MOI values (×200)
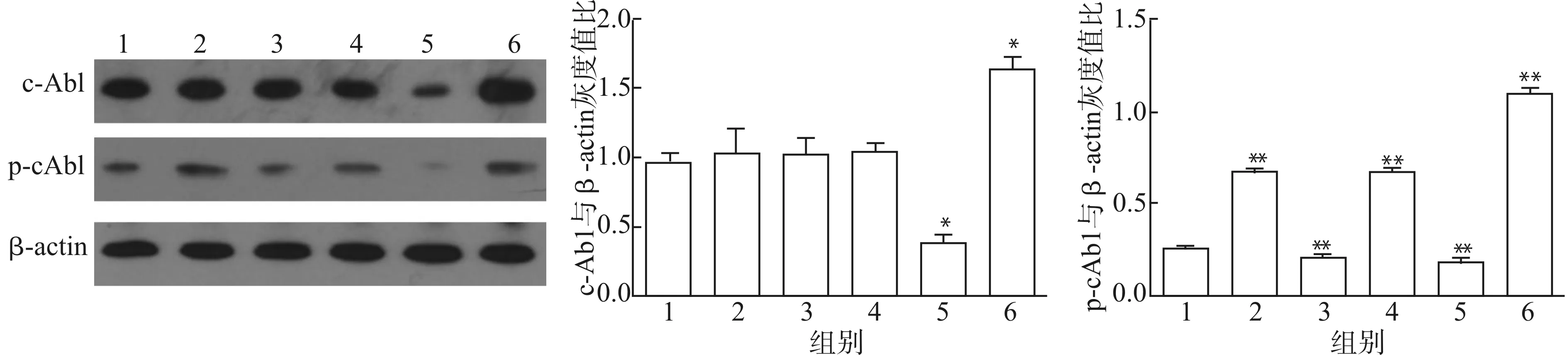
1:对照组;2:AngⅡ组;3:STI571组;4:lenti-control组;5:lenti-cAbl-shRNA组;6;lenti-cAbl组;与对照组比较,*P<0.05 **P<0.01图4 各实验组的c-Abl和p-cAbl蛋白表达Fig.4 Expression of c-Abl and p-cAbl protein in each experimental group
2.5 c-Abl对AngⅡ刺激下的VSMCs氧化应激的影响
6孔板培养已分组的细胞,当细胞密度为70%时,对除对照组外的实验组AngⅡ(1×10-7mol/L)干预36 h(对照组用生理盐水干预36 h)后,流式细胞仪检测各组氧化应激水平(ROS、DHE、DHR)。流式细胞技术检测氧化应激结果(图5、6、7):AngⅡ干预后,VSMCs氧化应激产物(ROS、DHE、DHR)均增加(均P<0.05),lenti-cAbl组氧化应激水平最高(均P<0.05),lenti-cAbl-shRNA组、STI571组的氧化应激水平较AngⅡ组有所减低(均P<0.05)。因此,c-Abl激酶活性与AngⅡ刺激下VSMCs的氧化应激程度呈正相关。
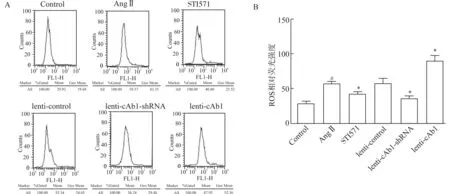
A:各组ROS流式图;B:各组ROS荧光强度柱状图;与AngⅡ组比较,*P<0.05;与Control组比较,#P<0.05 图5 各实验组ROS强度差异Fig.5 Difference of ROS intensity in each experimental group

A:各组DHE流式图;B:各组DHE荧光强度柱状图;与AngⅡ组比较,*P<0.05;与Control组比较,#P<0.05 图6 各实验组DHE强度差异Fig.6 Difference of DHE intensity in each experimental group

A:.各组DHR流式图;B:各组DHR荧光强度柱状图;与AngⅡ组比较,*P<0.05;与Control组比较,#P<0.05 图7 各实验组DHR强度差异Fig.7 Difference of DHR intensity in each experimental group
3 讨论
主动脉夹层的发生与动脉中层的退行性变相关,动脉中层主要由VSMCs和细胞外基质(ECM)组成,其中VSMCs对维持主动脉壁的完整性和收缩功能具有重要作用,其损伤或生物学行为的改变是主动脉夹层产生的重要原因之一[6-7]。
慢病毒载体是一种以人类免疫缺陷Ⅰ型病毒为基础发展起来的基因表达载体,可长时间、稳定地表达外源基因。相比于腺病毒,其优点在于可以有效地感染多种难感染的细胞,比如原代细胞、干细胞、神经元细胞等,又很少引发机体免疫反应,能达到良好的基因治疗效果,具有广阔的应用前景[8-10]。在本实验中使用的是pCDH系列慢病毒载体,构成过表达的重组慢病毒载体pCDH-EF1-MCS-T2A-Puro-cAbl,将慢病毒载体转入到HeLa细胞,并用嘌呤霉素处理细胞7 d后,选取合适的稀释度计算病毒滴度。
前期研究发现,c-Abl与VSMCs的生物学行为相关,c-Abl基因是Abelson小鼠白血病病毒原癌基因v-abl的同源基因,位于人的第9号染色体,其编码蛋白的分子量为140 kD,分布于包括VSMCs、内皮细胞、成纤维细胞在内的多种细胞和组织的细胞核、细胞质中。c-Abl激活后使下游的Crk相关底物(p130CAS)磷酸化,而磷酸化的p130CAS与CrkⅡ及DOCK180蛋白形成复合体,是调节下游信号GTP结合蛋白Rac1的关键步骤,Rac1则通过作用于JNK和Nox调控相关基因表达[11],参与细胞骨架重塑、DNA损伤和氧化应激、细胞凋亡、细胞转化等生命活动。在本实验中,我们验证了c-Abl在静息时为非活化状态,而磷酸化后形成p-cAbl实现激酶功能。信号转导抑制剂-571(STI571)可粘附于c-Abl的无活性构象[12],占据其激活环和螺旋αC之间的空间,防止激活环构象改变,从而阻止c-Abl的磷酸化激活。实验中,我们利用shRNA下调了c-Abl表达,利用c-Abl激活抑制剂STI571抑制了c-Abl的活性成分p-cAbl。研究结果表明,下调c-Abl基因的表达,或降低其活性均可使AngⅡ导致的VSMCs氧化应激效应降低,提示c-Abl基因在VSMCs过氧化损伤中的非保护性调控作用。
主动脉夹层是凶险复杂的大血管疾病,目前认为主动脉壁中层VSMCs的损伤在主动脉夹层病变的形成过程中起到重要作用[13-14],而大量过氧化物的产生可加重VSMCs的损伤。我们发现AngⅡ诱导的c-Abl激活是ROS依赖性的,并且c-Abl活性越高,其ROS产物越多。AngⅡ通过活化一种质膜蛋白NAD(P)H氧化酶,并以此为第二信使,介导有丝分裂原的信号转导,从而导致VSMCs增殖[15]。ROS可通过MAPKs通路、NF-κB通路调控MMP的表达,影响细胞外基质的成分,改变弹性纤维的合成与降解过程[16-17],这可能是引发夹层的原因之一。本实验中,c-Abl活性被抑制后,AngⅡ导致的VSMCs氧化应激水平也降低,VSMCs的损伤可能减少。因此,通过抑制c-Abl活性而阻断AngⅡ诱导VSMCs的氧化应激效应,可能成为预防主动脉夹层发生、发展的治疗靶点。
综上所述,本实验通过在DNA、RNA、蛋白质3个水平观察具有不同活性cAbl的VSMCs在AngⅡ刺激后的氧化应激效果,发现c-Abl基因过表达的VSMCs,其AngⅡ刺激后的氧化应激效应增加,而c-Abl基因沉默和c-Abl活性抑制的VSMCs,其AngⅡ刺激后的氧化应激效应降低。这些结果提示c-Abl基因与AngⅡ诱导的VSMCs氧化应激呈正相关。但其介导的具体信号通路和分子机制,尚需进一步研究论证。
[1] Milewicz D M,Guo D C,Tran-Fadulu V,et al.Genetic basis of thoracic aortic aneurysms and dissections:focus on smooth muscle cellcontractile dysfunction[J].Annu Rev Genomics Hum Genet,2008,9:283-302.
[2] Shaul Y,Ben-Yehoyada M.Role of c-Abl in the DNA damage stress response[J].Cell Res,2005,15(1):33-35.
[3] Furstoss O,Dorey K,Simon V,et al.c-Abl is an effector of Src for growth factor-induced c-myc expression and DNA synthesis[J].Embo J,2002,21(4):514-524.
[4] Chen S,Wang R,Li Q F,et al.Abl knockout differentially affects p130 Crk-associatedsubstrate,vinculin,and paxillin in blood vessels of mice[J].Am J Physiol Heart Circ Physiol,2009,297(2):H533-H539.
[5] 孙图成,杜心灵,蒋雄刚,等.Abelson非受体酪氨酸激酶及肌动蛋白动态细胞骨架结构在夹层主动脉组织中的变化[J].中华实验外科杂志,2012,29(3):488-490.
[6] Henderson E L,Geng Y J,Sukhova G K,et al.Death of smooth muscle cells and expression of mediators of apoptosis by T lymphocytes in human abdominal aortic aneurysms[J].Circulation,1999,99(1):96-104.
[7] Lopez-Candales A,Holmes D R,Liao S,et al.Decreased vascular smooth muscle cell density in medial degeneration of human abdominal aortic aneurysms[J].Am J Pathol,1997,150(3):993-1007.
[8] Thomas C E,Ehrhardt A,Kay M A.Progress and problems with the use of viral vectors for gene therapy[J].Nat Rev Genet,2003,4(5):346-358.
[9] Naldini L.Exvivogene transfer and correction for cell-based therapies[J].Nat Rev Genet,2011,12(5):301-315.
[10] Schambach A,Zychlinski D,Ehrnstroem B,et al.Biosafety features of lentiviral vectors[J].Hum Gene Ther,2013,24(2):132-142.
[11] Hernandez S E,Settleman J,Koleske A J.Adhesion-dependent regulation of p190RhoGAP in the developing brain by the Abl-related gene tyrosine kinase[J].Curr Biol,2004,14(8):691-696.
[12] Capdeville R,Buchdunger E,Zimmermann J,et al.Glivec(STI571,imatinib),a rationally developed,targeted anticancer drug[J].Nat Rev Drug Discov,2002,1(7):493-502.
[13] He R,Guo D C,Estrera A L,et al.Characterization of the inflammatory and apoptotic cells in the aortas of patients with ascending thoracic aortic aneurysms and dissection[J].J Thorac Cardiovasc Surg,2006,131(3):671-678.
[14] Rowe V L,Stevens S L,Reddick T T,et al.Vascular smooth muscle cell apoptosis in aneurysmal,occlusive,and normal human aortas[J].J Vasc Surg,2000,31(3):567-576.
[15] Rocic P,Seshiah P,Griendling K K.Reactive oxygen species sensitivity of angiotens-in Ⅱ-dependent translation initiation in vascular smooth muscle cells[J].J Biol Chem,2003,278(38):36973-36979.
[16] Koullias G J,Ravichandran P,Korkolis D P,et al.Increased tissue microarray matrix metalloproteinase expression favors proteolysis inthoracic aortic aneurysms and dissections[J].Ann Thorac Surg,2004,78(6):2106-2110.
[17] Zhang H,Wang Z W,Wu H B,et al.Transforming growth factor-β1 induces matrix metalloproteinase-9 expression in rat vascular smooth muscle cells via ROS-dependent ERK-NF-κB pathways[J].Mol Cell Biochem,2013,375(1/2):11-21.
(2017-04-22 收稿)
Role of c-Abl Gene in AngⅡ-induced Oxidative Stress of Vascular Smooth Muscle Cells
Sun Tucheng1#,Zhou Xianwu2#,Li Huadong2etal
1Guangdong Cardiovascular Institute,Guangdong General Hospital,Guangdong Academy of Medical Sciences,Guangzhou 510080,China2Department of Cardiovascular Surgery,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
Objective To investigate the role of c-Abl gene in angiotensinⅡ(AngⅡ)-induced oxidative stress in vascular smooth muscle cells(VSMCs).Methods We constructed the c-Abl gene overexpression and silence lentiviral vectors and used lentivirus transfection method to construct c-Abl overexpression and silence VSMCs.The test group VSMCs were divided into six groups:control group,AngⅡ group,STI571 group,lenti-control group,lenti-cAbl-shRNA group,lenti-cAbl group (groups 1-6).Groups 1-3 were normal VSMCs,Group 3 was pretreated with STI571,and groups 4-6 were VSMCs transfected by lenti-control,lenti-cAbl-shRNA and lenti-cAbl,respectively.the control group was treated with normal saline for 30 min,while the other experimental groups were treated with AngⅡ(1×10-7mol/L)for 30 min,then we used Western blotting to detect the protein expression of c-Abl and p-cAbl.For determination of reactive oxygen species(ROS),the control group was treated with normal saline,while the other experimental groups were treated with AngⅡ(1×10-7mol/L)for 36 h,then flow cytometry was used to detect the oxidative stress levels of reactive oxygen species(ROS),dihydroethidium(DHE)and dihydrorhodamine(DHR),respectively.Results Compared with the control group,the expression of p-cAbl protein was the highest in the lenti-cAbl group and the weakest in STI571 and lenti-cAbl-shRNA groups.There were no significant differences in the levels of c-Abl and p-cAbl protein between lenti-control group and AngⅡ group.ROS,DHE and DHR levels increased after 36 h of AngⅡ stimulation,but the oxidative stress level of lenti-cAbl group was the highest among all the groups.Compared with the AngⅡ group,the oxidative stress levels of lenti-cAbl-shRNA group and STI571 group were reduced.Conclusion The VSMCs with the overexpressing c-Abl gene was successfully constructed by lentiviral vector technique.The increase of c-Abl gene expression was positively correlated with the oxidative stress of VSMCs stimulated by AngⅡ.
lentiviral vector; c-Abl gene; VSMCs; oxidative stress; angiotensinⅡ
*国家自然科学基金资助项目(No.81370416)
R543.1
10.3870/j.issn.1672-0741.2017.04.003
#共同第一作者
孙图成,男,1973年生,副教授,E-mail:suntucheng@126.com;周先吾,男,1991年生,医学硕士,E-mali:zhouxianwu1991@hotmail.com
△通讯作者,Corresponding author,E-mail:jiangxionggang@hotmail.com

