褪黑素减轻内质网应激改善发育早期铅暴露小鼠海马组织的tau蛋白过度磷酸化*
刘晓峰, 陈 娟, 欧启水△
1福建医科大学附属第一医院检验科,福建医科大学附属第一医院基因诊断研究室,福州 350005 2华中科技大学同济医学院基础医学院生物化学与分子生物学系,武汉 430030
褪黑素减轻内质网应激改善发育早期铅暴露小鼠海马组织的tau蛋白过度磷酸化*
刘晓峰1, 陈 娟2, 欧启水1△
1福建医科大学附属第一医院检验科,福建医科大学附属第一医院基因诊断研究室,福州 3500052华中科技大学同济医学院基础医学院生物化学与分子生物学系,武汉 430030
目的 探讨褪黑素(Melatonin,MT)对发育早期铅暴露小鼠海马组织tau蛋白磷酸化的影响及可能的作用机制。方法 健康C57BL/6小鼠随机分为4组:正常对照组(Con组,全程正常饮用水喂养)、发育早期铅暴露组(Pb组,出生至出生后第21天母鼠给予0.2%醋酸铅水)、单独MT干预组(MT组,正常非暴露对照鼠在12月龄后给予含50 mg/mL MT饮用水干预3个月)及MT干预联合铅暴露组(MT+Pb组,出生至出生后第21天母鼠给予0.2%醋酸铅水,并于12月龄后给予含50 mg/mL MT饮用水干预3个月)。采用石墨炉原子吸收光谱仪测定各组小鼠的血铅和海马铅含量,Morris水迷宫检测空间学习记忆功能,Western blot检测海马tau蛋白的磷酸化程度、内质网应激标志分子GRP78和CHOP的蛋白表达水平。结果 与Con组相比,Pb组小鼠血铅和海马铅含量均明显升高(均P<0.05),给予MT干预并未影响血铅和海马铅含量;且Pb组小鼠海马tau蛋白磷酸化水平增强(P<0.01),而给予MT干预后,相比Pb组,MT+Pb组小鼠海马tau蛋白磷酸化水平明显降低(P<0.05);与Con组相比,Pb组小鼠海马内质网应激标志分子GRP78和CHOP蛋白表达水平均明显升高(均P<0.05),而MT干预后,相比Pb组,MT+Pb组GRP78和CHOP蛋白表达水平显著下降(均P<0.05)。结论 MT可改善发育早期铅暴露小鼠海马tau蛋白的过度磷酸化,并改善其学习记忆功能,其具体机制可能与调控内质网应激有关。
褪黑素; 发育早期铅暴露; 内质网应激; tau蛋白磷酸化
铅(lead,Pb)是一种常见的环境重金属污染物,具有较强的神经毒性,可造成神经生理损伤及认知功能缺陷等。近年来,环境铅暴露所致神经毒性在神经退行性病变发生中的作用逐渐受到关注[1]。研究发现,长期低水平的铅暴露可能是阿尔茨海默病(Alzheimer’s diseases,AD)发病的重要环境危险因素,特别是Wu等[2]的研究发现发育早期的环境铅暴露可增加个体成年期发生AD的风险。进一步的研究显示,发育早期的铅暴露可导致成年小鼠海马tau蛋白过度磷酸化[3],从而参与AD病变的发生。然而,对于这种铅暴露引发tau蛋白过度磷酸化的具体机制,目前尚不清楚。
新近研究发现:慢性铅暴露可引发内质网应激(endoplasmic reticulum stress,ER stress)[4]。内质网是真核细胞内重要的亚细胞器之一,是膜蛋白和分泌性蛋白进行正确折叠和加工修饰的重要场所。未折叠或错误折叠的蛋白大量聚积、正常蛋白的过度蓄积以及胞内钙离子平衡被破坏等,均可触发ER stress。其中葡萄糖调节蛋白78(GRP78)和转录因子C/EBP同源蛋白(CHOP)作为ER stress的标志分子,二者表达增高预示着ER stress的发生[5]。同时,有研究报道内质网应激发生后可激活tau蛋白磷酸化的关键激酶GSK-3β,从而促进tau蛋白磷酸化[6]。上述研究提示:慢性铅暴露可经ER stress参与tau蛋白的磷酸化。
褪黑素(melatonin,MT)是由松果体腺分泌的内源性激素,又称松果体素,在很多生理活动和病理过程中都起到重要的调节作用,如促进睡眠、调节时差、抗衰老、调节免疫等。研究显示,老年阶段个体合成分泌MT的功能减退,特别是AD患者血浆和脑脊液中MT水平均明显下降,且有证据表明AD患者MT水平的下降与其认知功能减退呈正相关[7]。AD患者给予MT治疗后,可明显改善患者的认知记忆功能。已有的研究表明,MT可通过调节tau蛋白磷酸化关键酶的活性以及抗氧化作用来改善tau蛋白的过度磷酸化,发挥抗AD作用[8]。
然而对于MT可否通过调控内质网应激而改善发育早期铅暴露所致的tau蛋白过度磷酸化,目前尚未见报道。本研究通过分娩后的母鼠给予醋酸铅水建立发育早期铅暴露小鼠模型,并经MT干预以观察MT对发育早期铅暴露小鼠海马tau蛋白磷酸化的影响,探寻其机制是否经调控ER stress而发挥作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂 褪黑素(MT)和醋酸铅购自美国Sigma公司。实验中所用抗体:GRP78(货号:ab21685)、CHOP(货号:ab53081)、t-tau(货号:ab80579)、p-tau(Ser396)(货号:ab109390)及GAPDH(货号:ab181602)购自英国Abcam公司,辣根过氧化物酶(HRP)标记二抗以及WB显色液等购于碧云天生物技术研究所。其余化学试剂均为国产分析纯。
1.1.2 实验动物及其分组处理 选择8周龄健康C57BL/6小鼠[由福建医科大学实验动物中心提供,实验动物许可证号SCXK(闽)2014-0003],SPF级,实验动物参照《福建医科大学实验动物饲养指南》进行,饲养过程中能自由饮水、取食,饲养环境维持12 h昼夜节律,并保持温度在(23±2)℃。适应性喂养后,并按雌雄比例2∶1配对合笼,经阴栓确认的孕鼠进行单笼饲养,随机分为两组:发育早期铅暴露组和非暴露组(对照组),待分娩后,铅暴露组母鼠给予含0.2%醋酸铅的饮用水染毒至断乳(第21天),而非暴露对照组母鼠给予正常无铅饮用水喂养。
繁殖获得的子鼠,经正常饲养至12月龄后,MT干预小鼠给予含50 mg/mL MT的饮用水喂养3个月,非干预组仍按正常饮用水喂养;干预结束后(15月龄),先进行行为学实验(水迷宫检测),然后处死动物进行后续其他实验。
1.2 实验方法
1.2.1 发育早期铅暴露小鼠模型的建立、MT干预及分组 参考文献[3]的方法,通过采用母鼠分娩后至子鼠断乳(第21天)期间给予母鼠含0.2%醋酸铅饮水的方法建立发育早期铅暴露小鼠模型,并参考台湾学者Wu等[9]的方法,经饮水方式给予MT进行干预。
实验动物共分为如下4组:正常对照组(Con组,全程正常饮用水喂养),铅暴露组(Pb组,出生至第21天母鼠给予0.2%醋酸铅水),单独MT干预组(MT组,正常非暴露对照鼠在12月龄后给予含50 mg/mL MT饮用水干预3个月)及MT干预联合铅暴露组(MT+Pb组,出生至第21天母鼠给予0.2%醋酸铅水,并于12月龄后给予含50 mg/mL MT饮水干预3个月)。
1.2.2 Morris水迷宫检测实验 Morris水迷宫测试系统为一黑色圆形水池,直径为120 cm,髙为60 cm,里面盛有不透明水,水温维持在(23±2)℃。隐藏平台为一有机玻璃圆柱形平台,直径为10 cm,位于水面下方1.5 cm,并将其置于目标象限的中央区。隐藏平台训练期间,小鼠每天进行4次训练,连续训练6 d。实验开始时,将小鼠沿着池壁轻轻放入水中,入水象限是除了隐藏平台所在象限外的其他3个象限,采用随机方式确定其入水象限的顺序。小鼠找到隐藏平台的时间,即隐藏平台潜伏期(escape latency,s),规定为60 s,严格控制,如果小鼠爬上平台,并在平台上停留15 s视为找到平台。训练结束后24 h(第7天),移去隐藏平台检测实验动物的空间记忆能力,其中动物寻找平台的潜伏期、运动轨迹以及在目标象限的停留时间(time in target quadrant)等作为评价其空间学习记忆能力的主要指标。
1.2.3 血清和海马铅含量测定 水迷宫实验结束后,采用10%水合氯醛溶液(按0.1 mL/10 g体重)腹腔注射麻醉小鼠,用摘眼球法采集各组小鼠血液,用含有肝素钠的冻存管-20℃保存备用;通过颈椎脱臼处死上述各组小鼠,并迅速摘取其海马组织,采用石墨炉原子吸收光谱仪分别测定各组小鼠的血铅和海马组织中的铅含量。
1.2.4 Western blot检测蛋白的表达 水迷宫检测结束后,处死各组小鼠,获取脑组织,并分离其海马组织,提取总蛋白,采用BCA法测定蛋白含量。蛋白样品经SDS-PAGE凝胶电泳分离、转膜、封闭,分别加入待测蛋白[如p-tau(Ser396)、GRP78、CHOP等]一抗过夜,后经辣根过氧化物酶HRP标记二抗孵育,采用Bio-Rad凝胶成像系统扫描成像,并进行后续定量分析。
1.3 统计学方法
2 结果
2.1 发育早期慢性铅暴露小鼠模型的建立
本研究中我们采用母鼠分娩后至子鼠断乳(第21天)期间通过给予母鼠含0.2%醋酸铅饮水的方法建立发育早期铅暴露小鼠模型,以子鼠为研究对象,正常喂养至12月龄后,通过饮水方式给予50 mg/mL的MT后期干预3个月。
在干预结束后(约15月龄)采用石墨炉原子吸收光谱法检测血液和海马组织中的铅含量。如图1所示:相比Con组,Pb组小鼠血铅含量明显升高,而给予MT干预后,MT+Pb组的血铅含量也明显升高(均P<0.01),与Pb组相比并未见明显差异(P>0.05)。类似地,如图1所示,Pb组小鼠海马铅含量也明显升高,而给予MT干预后,MT+Pb组的海马组织铅含量也明显升高(均P<0.01),但与Pb组相比,海马铅含量亦未见显著改变(P>0.05)。
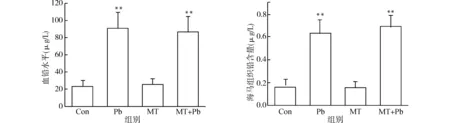
与Con组比较,**P<0.01图1 发育早期铅暴露小鼠模型血铅及海马组织铅含量Fig.1 Lead levels in the blood and hippocampus of the C57BL/6 mice with exposure to Pb at early development stage
2.2 MT干预对发育早期铅暴露小鼠空间学习记忆功能的影响
通过Morris水迷宫实验我们发现,相比Con组,Pb组的小鼠空间学习记忆功能存在明显缺陷,如图2所示:发育早期铅暴露小鼠寻找隐藏平台时间(潜伏期)明显长于Con组,而给予MT干预后,MT+Pb组较Pb组潜伏期相对缩短,差异具有统计学意义(P<0.05或P<0.01);在第7天撤去隐藏平台后,我们发现Pb组小鼠在目标象限(隐藏平台所在象限)停留时间明显少于Con组小鼠,差异具有统计学意义(P<0.05),而给予MT干预后,较单独铅暴露组,MT+Pb组小鼠在目标平台停留的时间明显增加,差异具有统计学意义(P<0.05),如图2所示。可见,发育早期铅暴露组的小鼠其学习记忆功能较对照组明显减退,而给予MT干预可改善其记忆功能减退。

与Con组比较,*P<0.05 **P<0.01;与MT+Pb组比较,# P< 0.05图2 MT对发育早期铅暴露小鼠空间学习记忆功能的影响Fig.2 MT attenuates the deficits of mouse spatial learning and memory induced by Pb exposure at early development stage
2.3 MT干预对发育早期铅暴露小鼠tau蛋白磷酸化的影响
我们采用Western blot检测了各组小鼠海马组织中磷酸化tau蛋白的表达水平。如图3所示:相比Con组,Pb组小鼠tau蛋白磷酸化(Ser396位点)水平显著上调(P<0.01),而给予MT干预后,MT+Pb组小鼠tau蛋白磷酸化水平明显下调,差异具有统计学意义(P<0.05)。可见,发育早期铅暴露可导致tau蛋白过度磷酸化,而MT干预可显著改善tau蛋白磷酸化程度。
2.4 MT干预对发育早期铅暴露小鼠内质网应激标志分子表达的影响
进一步,我们检测了ER stress标志性蛋白GRP78和CHOP的表达水平。如图4所示:相比Con组,Pb组GRP78和CHOP的表达均明显增强(均P<0.05),而MT干预后,MT+Pb组二者的表达较Pb组出现显著下降(均P<0.05)。可见,发育早期的环境铅暴露可引发ER stress,而MT可改善上述铅暴露引发的ER stress.

与Con组比较,*P<0.05 **P<0.01;与Pb组比较,# P<0.05图3 MT干预对发育早期铅暴露小鼠tau蛋白磷酸化的影响Fig.3 MT attenuates the phosphorylation of tau induced by Pb exposure at early development stage of mice

与Con组比较,*P<0.05 **P<0.01;与Pb组比较,# P<0.05图4 MT对发育早期铅暴露小鼠内质网应激标志分子表达的影响Fig.4 MT decreases the expression of ER stress marker GRP78 and CHOP induced by Pb exposure at early development stage
3 讨论
铅是当前一种较为普遍的环境重金属毒物,而中枢神经系统是其作用的主要靶器官,可导致一系列的神经生理及行为学异常。最近研究显示:环境铅暴露与AD的发生密切相关,可能是AD发病的环境危险因素。有研究揭示:发育早期的铅暴露可增加成年阶段发生AD的风险[2]。发育早期的铅暴露可导致成年阶段小鼠海马组织tau蛋白的过度磷酸化[3,10]。本实验中,我们首先通过给予含铅饮水建立发育早期环境铅暴露模型小鼠,经石墨炉原子吸收光谱法检测模型小鼠血铅和海马铅含量,发现发育早期铅暴露小鼠,成年阶段血铅和海马中铅含量均明显高于正常对照小鼠,同时水迷宫检测结果显示:发育早期铅暴露小鼠其空间学习记忆功能明显减退,这与上述结果相一致,也提示我们造模成功。经Western blot检测小鼠海马组织中tau蛋白的磷酸化程度,结果显示:发育早期铅暴露小鼠海马组织tau蛋白磷酸化(Ser396位点)程度增强。
同时基于最近研究发现慢性铅暴露可引发ER stress,而后者已证实在AD的发生发展中具有重要的作用,有望成为未来揭开AD发病机制的一个重要方向[5]。因此,本研究中我们进一步检测了ER stress的标志性蛋白GRP78和CHOP的表达情况,结果显示:在发育早期的环境铅暴露小鼠海马组织中GRP78和CHOP的表达均明显上调,提示在发育早期的环境铅暴露可触发ER stress。
褪黑素(MT)与AD发生密切相关,MT作为用于AD防治的前景药物,已受到广泛关注。但对于MT在铅暴露所致的AD样病变中的作用,目前相关报道还较少见。我们前期的研究发现,MT可显著改善tau蛋白的磷酸化程度。本研究我们通过饮水方式给予铅暴露小鼠MT干预,结果显示:MT并不影响铅暴露小鼠的血铅和海马铅含量,但MT干预可显著改善发育早期铅暴露小鼠的空间学习记忆功能,以及脑内海马组织的tau蛋白的过度磷酸化。进一步研究显示MT的干预可显著缓解发育早期铅暴露小鼠海马ER stress,ER stress标记蛋白GRP78和CHOP的表达显著下调。
因此,本研究中我们发现MT可改善发育早期铅暴露所致的脑内tau蛋白的过度磷酸化,其机制可能与调控内质网应激中的关键分子GRP78和CHOP的表达从而改善内质网应激有关。
[1] Weuve J,Press D Z,Grodstein F,et al.Cumulative exposure to lead and cognition in persons with Parkinson’s disease[J].Mov Disord,2013,28(2):176-182.
[2] Wu J,Basha M R,Brock B,et al.Alzheimer’s disease(AD)-like pathology in aged monkeys after infantile exposure to environmental metal lead(Pb):evidence for a developmental origin and environmental link for AD[J].J Neurosci,2008,28(1):3-9.
[3] Bihaqi S W,Bahmani A,Adem A,et al.Infantile postnatal exposure to lead(Pb)enhances tau expression in the cerebral cortex of aged mice:relevance to AD[J].Neurotoxicology,2014,44:114-120.
[4] Qian Y,Tiffany-Castiglioni E.Lead-induced endoplasmic reticulum(ER) stress responses in the nervous system[J].Neurochem Res,2003,28(1):153-162.
[5] Salminen A,Kauppinen A,Suuronen T,et al.ER stress in Alzheimer’s disease:a novel neuronal trigger for inflammation and Alzheimer’s pathology[J].J Neuroinflammation,2009,6:41.
[6] Ho Y S,Yang X,Lau J C,et al.Endoplasmic reticulum stress induces tau pathology and forms a vicious cycle:implication in Alzheimer’s disease pathogenesis[J].J Alzheimers Dis,2012,28(4):839-854.
[7] Liu R Y,Zhou J N,van Heerikhuize J,et al.Decreased melatonin levels in postmortem cerebrospinal fluid in relation to aging,Alzheimer’s disease,and apolipoprotein E-epsilon4/4 genotype[J].J Clin Endocrinol Metab,1999,84(1):323-327.
[8] Liu S J,Wang J Z.Alzheimer-like tau phosphorylation induced by wortmannin in vivo and its attenuation by melatonin[J].Acta Pharmacol Sin,2002,23(2):183-187.
[9] Wu S M,Lin W Y,Shen C C,et al.Melatonin set out to ER stress signaling thwarts epithelial mesenchymal transition and peritoneal dissemination via calpain-mediated C/EBPbeta and NFkappaB cleavage[J].J Pineal Res,2016,60(2):142-154.
[10] Dash M,Eid A,Subaiea G,et al.Developmental exposure to lead(Pb)alters the expression of the human tau gene and its products in a transgenic animal model[J].Neurotoxicology,2016,55:154-159.
(2017-03-25 收稿)
Melatonin Ameliorates Tau Hyperphosphorylation of Mice with Exposure to Lead(Pb)at Early Development Stage by Mediating ER Stress in Hippocampus
Liu Xiaofeng1,Chen Juan2,Ou Qishui1△
1Department of Laboratory Medicine,Gene Diagnostic Laboratory,the First Affiliated Hospital of Fujian Medical University,Fuzhou 350005,China2Department of Biochemistry and Molecular Biology,School of Basic Medical Sciences,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To investigate the effect of melatonin(MT)on tau hyperphosphorylation in hippocampus of mice with exposure to lead(Pb)at early development stage and its possible mechanism.Methods Healthy C57BL/6 mice were randomly divided into four groups:control group(
normal water),lead exposure group(exposed to 0.2% Pb acetate from postnatal day 1(PND 1)to PND 21 through drinking water),MT group(received 50 mg/mL MT through drinking water since 12-month-old for 3 months)and MT combined with lead exposure group(exposed to 0.2% Pb acetate from PND 1 to PND 21 and then given 50 mg/mL MT since 12-month-old for 3 months through drinking water).The Pb levels in the blood and hippocampus were determined by graphite furnace atomic absorption spectrometry.Morris water maze was used to detect the spatial learning and memory.The phosphorylation level of tau and the protein level of GRP78 and CHOP in hippocampus were detected by Western blotting.Results Compared with the control group,the Pb levels in the blood and hippocampus were significantly increased in lead exposure group(P<0.05),while MT treatment did not affect the Pb levels both in the blood and hippocampus.In the lead exposure group,the phosphorylation level of tau in the hippocampus was significantly increased compared with control group(P<0.01),and after treatment with MT,the phosphorylation level of tau in MT combined with lead exposure group was significantly decreased compared with the lead exposure group(P<0.05).Furthermore,the expression of GRP78 and CHOP in the hippocampus was significantly higher in lead exposure group than in control group(P<0.05),and after treatment with MT,the expression levels of GRP78 and CHOP were lower than those of the control group.Conclusion MT can ameliorate the phosphorylation level of tau in the hippocampus and defects of learning and memory in C57BL/6 mice with exposure to lead at early development stage,and this may be related with the modulation of endoplasmic reticulum stress.
melatonin; lead(Pb) exposure; endoplasmic reticulum stress; tau hyperphosphorylation
*国家自然科学基金资助项目(No.31171027,No.31670778,No.81371416);福建省卫生计生委青年课题资助项目(No.2016-1-55); 福建省自然科学基金资助项目(No.2016J05185)
R542.2
10.3870/j.issn.1672-0741.2017.04.005
刘晓峰,男,1987年生,医学博士,E-mail:liuchongyang555@126.com
△通讯作者,Corresponding author,E-mail:ouqishui@163.com
——疾病防治的新靶标

