Pfu DNA聚合酶的制备过程及其条件优化
韦 慧,曹贤明,李昱龙,涂中华,樊 奔
(南京林业大学南方现代林业协同创新中心;南京林业大学林学院,中国江苏南京210037)
从激烈热球菌(Pyrococcus furiosus)中分离的Pfu DNA聚合酶是一种在DNA复制中起聚合作用的蛋白质[1]。国内外已有的研究表明,Pfu聚合酶热稳定性强,有 5′→3′聚合酶活性和 3′→5′外切核酸酶活性[2,3],但不具有5′→3′的外切核酸酶活性,可以在催化聚合反应的同时,纠正聚合反应过程中错误掺入的碱基。因此,Pfu聚合酶具有高保真的DNA聚合活性,在PCR反应中的突变率仅为2.6%[4],是所有热稳定聚合酶中最精确的聚合酶之一,在目前的DNA扩增和测序方法中具有重要作用[5,6]。
目前,国内外研究中所使用的Pfu DNA聚合酶主要从各商业公司购置,对于进行大量分子克隆的实验室来说,这显然是一个不小的科研成本负担。事实上,Pfu聚合酶的基因已被克隆并可异源表达[7],而大部分分子生物学实验室充分具备自主生产Pfu酶的条件,如果有一套详尽可行的制备方案,研究者在实验室自主生产Pfu酶,可以大大节省科研成本。遗憾的是,尽管国内外已有少量关于Pfu酶制备的文章发表,但是由于这些文章的研究重点各不相同,均未对整个制备过程进行详细描述,蛋白质纯化过程中的一些关键细节也就无从借鉴,或者个别条件参数多有抵触,最佳条件莫衷一是。针对这种情况,本研究在蛋白质制备基本方案的基础上,从头摸索,对Pfu酶分离纯化过程中的重要条件参数一一进行了优化确认,从而建立了一套细致可靠的Pfu制备方案。依据该方案可以制备出高产量、高纯度的Pfu聚合酶,完全满足分子生物学实验室的日常克隆工作。该方案及其所优化确认的关键条件、重要参数,对于有意自我生产Pfu酶的实验室和研究单位,具有很高的参考价值。
1 材料与方法
1.1 材料
菌株:激烈热球菌(P.furiosus)由美国Diter von Wettstein实验室惠赠,大肠杆菌BL21(DE3)为本实验室保存。
培养基:LB液体培养基(1%胰蛋白胨,0.5%酵母提取物,1%NaCl)。
PCR引物:Pfu DNA聚合酶基因全长序列扩增引物为 Pfu_fr(5′-ATTTTAGATGTGGATTACATA-3′)和 Pfu_dw(5′-CTAGGATTTTTTAATGTTAAGCCAGG-3′);Pfu 酶活性验证引物为 Pfu_m_fr(5′-GACAATAAATCTCCCAACATAC-3′)和 Pfu_m_dw(5′-CCTCACTTTCTCCTCCTG-3′);16S rDNA 扩增引物为 Fr_8F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 Dw_1492R(5′-TACGGTTACCTTGTTACGACTT-3′);Pfu 酶 3′→5′外切酶活性检测引物为FBO550(5′-GTTTGTCTGCCGTGATGT-3′)、FBO807(5′-TTCGCCACAACATTGAAGA-3′)和 FBO808(即FBO807 的 3′端错配引物:5′-TTCGCCACAACATTGAAGT-3′)。
pXG-1质粒由实验室构建完成;pET1载体购自北京全式金生物技术有限公司。
聚丙烯酰胺凝胶电泳:蛋白胶配方包括聚丙烯酰胺单体双体(32∶0.8)溶液、5×separating gel buffer(100 mL)、5× staking gel buffer(100 mL);电泳缓冲液配方包括30.27 g Tris base、144.1 g glycine、10 g SDS,调pH至8.3,定容至1 L,4℃保存。AP(5%):0.5 g过硫酸铵溶于10 mL去离子水中,现配现用。
染色液:0.25 g考马斯亮蓝R250,4 mL甲醇,10 mL冰醋酸,去离子水定容至100 mL。脱色液:甲醇400 mL,蒸馏水500 mL,冰醋酸100 mL,定容至1 L。
Ni-NTA树脂柱购自生工生物工程(上海)股份有限公司,蛋白质相对分子质量marker购自Ther mo Fisher Scientific公司(美国),商业Taq酶/Pfu酶均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 Pfu聚合酶表达载体的构建
提取激烈热球菌的基因组作为模板,利用商业Pfu酶及引物Pfu_fr和Pfu_dw,PCR扩增pfu基因全长。PCR程序为:95℃变性5 min;(94℃30 s,50℃ 30 s,72℃ 50 s)×32循环;72℃延伸5 min[8]。
扩增完成之后,纯化PCR产物,然后置于新的含有Taq酶的PCR反应体系中,72℃反应加A尾10 min后再次纯化。利用T4连接酶将纯化产物与商业载体pET1酶联,将连接产物转化至大肠杆菌BL21(DE3)[9],待长出单菌落后利用引物Pfu_m_fr和Pfu_m_dw进行菌落PCR,验证pfu是否成功插入。PCR程序为:95℃变性5 min;(94℃30 s,50℃ 30 s,72℃ 50 s)×32循环;72℃延伸5 min。
1.2.2 Pfu聚合酶的诱导表达
将纯化后的含有pfu重组质粒的大肠杆菌单菌落接种到10 mL含有氨苄抗生素(100 μg/mL)的LB培养基内[10],过夜培养后按1%接种到200 mL含有氨苄青霉素的LB培养基内,200 r/min 37℃培养至OD值为0.5左右,加入94 μL的IPTG诱导表达,37℃、200 r/min震荡培养12 h。
1.2.3 Pfu聚合酶的提取与纯化
将菌液放在冰上冷却,4℃、5 000 r/min离心10 min后弃上清,然后加入超声波破碎缓冲液(57 mmol/L NaH2PO4,300 mmol/L NaCl,pH=7.5)重悬细胞团。在冰浴条件下超声波破碎细菌至菌液透明[11],即超声波模式“03”(超声30 s,间隙30 s,振幅60%)破碎20~30 min,然后将透明溶液4℃、13 000 r/min离心10 min,弃去残渣保留上清。将上清液水浴加热一段时间后再次4℃、13 000 r/min离心10 min,取上清用于镍柱纯化[12]。纯化后的蛋白质溶液进行SDS-聚丙烯酰胺凝胶电泳[13,14],检测纯化结果。此流程中未详细描述的实验条件和技术参数见结果与分析部分。
1.2.4 Pfu聚合酶的活性检测
利用梯度稀释及PCR扩增测定DNA聚合酶活力。扩增体系为10×PCR buffer(200 mmol/L Tris-HCl,pH=8.8;100 mmol/L(NH4)2SO4;100 mmol/L KCl;1 mg/mL BSA;1%(V/V)Triton X-100;20 mmol/L MgSO4)2.5 μL,2.5 mmol/L dNTP 2.5 μL,上游引物 Pfu_m_fr 1 μL,下游引物 Pfu_m_dw 1 μL,质粒模板(Pfu酶基因的质粒)5 ng,商业Taq酶0.5 μL。PCR程序为95℃变性5 min;(95℃30 s,55℃30 s,72℃ 2 min)×32循环;72℃延伸5 min。
1.2.5 Pfu聚合酶3′→5′外切酶活性检测
根据文献报道的方法[14]稍加改进,简述如下:首先将pXG-1质粒DNA和引物FBO550、FBO807(摩尔比例1∶1)混合,加入Pfu反应缓冲液(10mmol/L Tris-HCl,pH=8.0;50 mmol/L NaCl)和超纯水,构建标准反应混合液,70℃加热5 min,缓慢降至室温,使模板引物退火备用。按照同样方法将pXG-1质粒和引物FBO550、FBO808(3′端含错配碱基)混合,加入Pfu反应缓冲液和超纯水,构建标准反应混合液,然后从以上构建的标准反应混合液各取20 μL置于两个离心管中(编号A和B),在A、B管中分别加入0.5 μL、0 μL自制的Pfu酶,72℃中反应5 min后备用。另取6个离心管按1~6顺序分别编号,其中1、2号管加入上述pXG-1/FBO550/FBO807混合物3 μL,3、4号管分别加入上述A管中Pfu酶切产物3 μL,5、6号管分别加入上述B管中混合物3 μL,最后向1~6管中各加入3 μL SYBR Green I、2 μL 10× Taq 缓冲液以及 1 μL Taq酶,加水补足至20 μL,进行荧光定量PCR反应。反应条件为72℃5 min×32循环,72℃延伸10 min。
1.2.6 Pfu聚合酶的DNA污染检测
分别以大肠杆菌BL21基因组DNA和自制的Pfu聚合酶为模板,利用16S rDNA通用引物进行PCR扩增。反应体系为10×PCR buffer 2.5 μL,2.5 mmol/L dNTP 2.5 μL,引物 Fr_8F 1 μL,引物Dw_1492R 1 μL,基因组模板 2 μL,商业 Taq/Pfu酶0.5 μL,加超纯水补足至25 μL。反应程序为95℃变性5 min;(95℃30 s,55℃ 30 s,72℃ 2 min)×25循环;72℃延伸5 min。
2 结果与分析
2.1 重组载体的鉴定
将pfu片段插入载体,转化至大肠杆菌BL21(DE3)后,挑取4个单菌落震荡培养,提质粒并进行PCR验证。PCR引物为Pfu_m_fr和Pfu_m_dw。结果显示,PCR产物长度大约为850 bp,产物条带清晰明显,大小亦符合预期要求(图1)。由此可知利用该质粒可进行后续pfu表达实验。

图1 pfu重组质粒琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of pfu recombinant plasmids
2.2 Pfu聚合酶提取与纯化条件的优化确定
2.2.1 最佳诱导剂处理以及细胞破碎条件的确定
制备Pfu聚合酶的过程中,首先需要确定的是合适的IPTG诱导条件。为此,我们对所加入的IPTG浓度以及诱导时间做了不同处理,同时为了测试收集的菌体细胞短期保存于-20℃是否影响后期蛋白质表达,增加了冻融处理对蛋白质提取影响的研究。综合上述因素,设计出实验方案如表1所示。

表1 诱导剂浓度、诱导时间以及冻融处理的优化方案Table1 Optimization of inducer concentration,induction time and freeze-thaw treatment
结果如图2所示,在加入IPTG诱导4 h后提取蛋白质,Pfu聚合酶和总蛋白质的产量明显低于诱导8 h和12 h,但是诱导8 h和诱导12 h的情况并无明显差别,因此加入IPTG诱导8~12 h收获蛋白质均可。诱导剂的终浓度在0.5 mmol/L和1 mmol/L的两种条件下蛋白质产量也无明显区别。此外,超声波破碎细胞之前,进行一次冻融处理对蛋白质产量并无明显影响,因此该处理步骤可以省略。

图2 不同诱导剂浓度、诱导时间、冻融处理对Pfu聚合酶提取的影响Fig.2 Effect of different inducer concentration,induction time,and freeze-thaw treatment on Pfu polymerase extraction
2.2.2 最佳超声波破碎缓冲液类型及其pH的确定
根据以上实验结果可知,Pfu聚合酶在所提取的总蛋白质中所占的比例很低,这会降低后续柱层析的纯化效率。因此,接下来对其他提取条件进一步优化确定。由于超声波缓冲液的类型及其pH会对纯化结果产生影响,根据文献报道[9,11],我们选择3种类型缓冲液(包括前述实验所使用的缓冲液:57 mmol/L NaH2PO4,300 mmol/L NaCl,pH=7.5),并调整每种缓冲液的pH,最终共计6种缓冲液,进行测试比较。设计实验为IPTG诱导12 h后,离心收集细胞团,分别用6种缓冲液重悬,缓冲液配方及其pH如表2所示。超声波破碎后,粗酶液经过55℃震荡加热处理45 min后进行SDS-聚丙烯酰胺凝胶电泳分析。
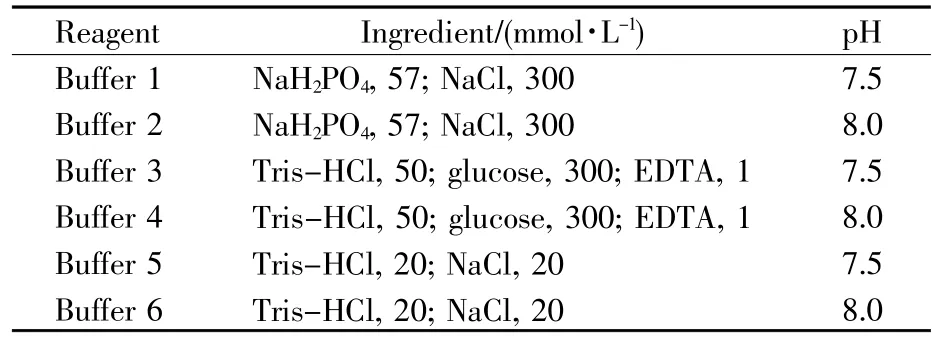
表2 所用的6种超声波破碎缓冲液配方Table2 Six buffers for ultrasonic disruption used in this study
结果如图3所示,与其他缓冲液相比,用buffer 1和buffer 2两种缓冲液进行超声波破碎得到的Pfu聚合酶含量较低,表明目前所用的磷酸盐缓冲液效果不佳;与buffer 4相比,用buffer 3、5、6进行超声波破碎得到的粗酶液中杂蛋白较多。所以根据此次实验结果,应当选择缓冲液4(50 mmol/L Tris-HCl,300 mmol/L葡萄糖,1 mmol/L EDTA,pH=8.0)作为菌体重悬及超声波破碎所用的缓冲液。

图3 不同破碎缓冲液对Pfu酶提取的影响Fig.3 Effect of different fragmentation buffers on extraction of Pfu DNA polymerase
2.2.3 最佳热处理温度以及时间的确定
超声波破碎之后,上清液加热处理可以除去大部分杂蛋白。在决定采用新的超声波缓冲液之后,对最佳热处理温度和时间进行确定。首先对热处理温度进行优化,方案如下:50℃、55℃、60℃、65℃、70℃、75℃分别加热45 min,其余操作及条件不变。实验结果如图4所示,可以看出55~75℃,随着温度升高,总蛋白质含量逐渐降低,而且Pfu聚合酶的含量也逐渐降低,其中55℃处理Pfu聚合酶含量目测最高,但是杂蛋白浓度亦较高,75℃处理后杂蛋白条带明显减少,但是Pfu聚合酶含量较低。由此决定对这两个温度(55℃和75℃)下的加热时间进一步优化确定。

图4 不同温度热处理对Pfu酶提取的影响Fig.4 Effect of different temperatures of heat treatment on extraction of Pfu
设置55℃和75℃两个温度下热处理时间分别为45 min、60 min、80 min,其余实验条件不变,操作同上。实验结果如图5所示,在两种温度下,把加热时间从45 min延长至80 min,杂蛋白含量均未明显降低,但是相对而言,75℃加热后的粗提蛋白质中Pfu聚合酶含量相对较高,这将有利于后续的柱层析纯化,因此决定选择75℃加热45 min这一条件继续进行实验。
2.2.4 最佳柱层析洗脱液中咪唑浓度的确定

图5 两个温度下不同热处理时间对Pfu提取的影响Fig.5 Effect of different heating times under two temperatures on extraction of Pfu
对所有上述蛋白质提取过程中的重要参数进行确定之后,使用镍柱纯化粗提蛋白质。纯化过程中,洗脱缓冲液中的咪唑浓度对纯化效果至关重要,因此需要通过实验确定最合适的咪唑浓度。实验中设置咪唑浓度梯度为10 mmol/L、50 mmol/L、100 mmol/L、200 mmol/L、250 mmol/L,分别洗脱上样之后的柱子,每种浓度的洗脱液冲洗2次,每次2 mL,然后将洗脱液分别进行电泳比较。实验结果如图6A所示,洗脱液咪唑浓度在10 mmol/L到100 mmol/L之间时,目的蛋白条带清晰,含量较高。为了进一步精细优化洗脱液的咪唑浓度,增设咪唑浓度为 20 mmol/L、30 mmol/L、40 mmol/L、50 mmol/L、60 mmol/L、70 mmol/L、80 mmol/L、90 mmol/L、100 mmol/L的浓度梯度,操作同上,分别洗脱上样之后的柱子,各咪唑浓度的缓冲液洗2次,每次2 mL,将第2次洗脱液收集进行聚丙烯酰胺凝胶电泳检测。结果如图6B所示,可以看出30 mmol/L是最合适的咪唑洗脱浓度。

图6 初步咪唑浓度洗脱液(A)和精细咪唑浓度洗脱液(B)的洗脱效果Fig.6 Elution effect of eluent with different concentrations of imidazole
2.3 Pfu酶制备效果及聚合活性检测
根据以上实验条件的优化结果,确定Pfu聚合酶提取纯化的最佳条件为:使用终浓度0.5 mmol/L的IPTG诱导菌体8~12 h,离心收集菌体细胞;使用缓冲液(50 mmol/L Tris-HCl,300 mmol/L葡萄糖,1 mmol/L EDTA,pH=8.0)重悬菌体并超声破碎,收集细胞破碎后的上清液,75℃热处理45 min;离心去除变性的蛋白质后使用镍柱层析分离上清中的可溶性蛋白质,并用咪唑浓度为30 mmol/L的缓冲液洗脱目标Pfu蛋白。按照这些优化后的条件参数,我们加大样品量进行了Pfu聚合酶的提取纯化,提取效果再次进行聚丙烯酰胺凝胶电泳检测,结果如图7所示,可以看出,使用上述条件可以高纯度高产量地制备出Pfu聚合酶。

图7 综合各项优化条件之后的Pfu制备效果Fig.7 Pfu preparation effect after comprehensive optimization conditions
利用PCR反应测试所制备的Pfu酶的DNA聚合酶活性,并与商业Pfu酶(Takara公司)进行比较。扩增结束后取1~2 μL产物电泳检测,结果如图8所示,可以看出自制的Pfu酶可以很好地扩增得到2 000 bp左右的DNA片段,扩增活性等同于所选用的商业酶。
2.4 Pfu酶3′→5′外切酶活性检测
我们对所制备的Pfu酶3′→5′外切酶活性亦进行了检测。由实验结果(图9)可知,阳性对照组(1、2 号样品)的 Ct值分别为 8.23、6.62,表明pXG-1质粒/正确引物可被商业Taq酶催化发生聚合反应,扩增出双链pXG-1质粒;阴性对照组(5、6号样品)的Ct值分别为24.92、28.85,表明引物末端错配碱基若不经Pfu酶外切,则几乎无法由Taq酶催化进行聚合反应;实验处理组(3、4号样品)的Ct值分别为14.16、14.41,介于阴性对照和阳性对照之间,说明含3′错配碱基的引物经自制Pfu酶处理之后,Pfu具备的3′→5′外切酶活性可将不匹配碱基切除,为Taq酶催化聚合反应提供条件。上述结果证明,自制的Pfu DNA聚合酶具有良好的3′→5′外切酶活性。

图8 提取制备的Pfu酶DNA聚合活性测试Fig.8 DNA polymerase activity test of self-prepared Pfu enzyme
2.5 DNA污染检测
通常原核细菌异源表达的DNA聚合酶很难避免DNA污染,而DNA污染会对PCR反应造成多种负面影响,比如错误地将污染的DNA进行扩增[15,16],因此有必要检测原核表达的DNA聚合酶中的DNA残留。本研究选择16S rDNA作为检测DNA残留的目标片段。从图10可以看出,经过25个PCR扩增循环之后,与阳性对照(以大肠杆菌BL21基因组为模板)相比,加入自制Pfu酶为模板的反应体系中没有明显的DNA扩增,因此可以确定,经纯化后的Pfu酶基本不含有DNA污染。
3 讨论

图9 荧光定量PCR法确定自制Pfu酶的3′→5′外切活性Fig.9 Determination of 3′-5′exonuclease activity of self-prepared Pfu by fluorescent quantitative PCR

图10 PCR检测自制Pfu酶的DNA残留Fig.10 PCR detection of residual DNA in self-prepared Pfu solution
本文主要对Pfu聚合酶的详细制备条件展开了研究,对Pfu酶纯化过程中的一系列最优实验条件进行了遴选确认,建立了一套利用大肠杆菌作为宿主菌异源表达重组Pfu酶的精细的实验方案。实验得到的优化条件包括:1)添加IPTG至终浓度为0.5 mmol/L,诱导时间为8~12 h,可得到高产量表达的Pfu蛋白;2)将菌体细胞破碎后的上清在75℃水浴加热45 min可以有效去除大部分杂蛋白;3)超声波破碎缓冲液优选配方为:50 mmol/L Tris-HCl,300 mmol/L葡萄糖,1 mmol/L EDTA,pH=8.0。由于目的蛋白与组氨酸结合,组氨酸的等电点为7.56,若缓冲液的pH低于7.56,组氨酸将呈酸性带正电荷,从而与带正离子的镍柱互相排斥,这样就降低了目标蛋白质与镍离子的特异性结合能力;而当缓冲液的pH高于7.56时,组氨酸呈碱性,带负电荷,与带正电荷的镍离子结合,使目的蛋白更为牢固的结合在镍柱上;4)柱层析过程中,洗脱缓冲液中的最佳咪唑浓度为30 mmol/L。经过检测表明,制备得到的Pfu酶具有不亚于商业Pfu酶的DNA聚合活性,且其中基本不含大肠杆菌的基因组DNA残留,所以完全满足普通PCR反应要求。
本文提供的Pfu聚合酶提取纯化方法,为后续大量制备Pfu酶奠定了坚实的基础。同时,该生产方案以及提取纯化方法优化的思路,对需要自主制备DNA聚合酶的实验室具有重要的借鉴意义。

