屎肠球菌降胆固醇作用的初步研究
吴 边,柳陈坚,李雅迪,尚 云,李晓然*
(1.云南省第一人民医院普外二科,中国云南昆明650032;2.昆明理工大学附属医院普外二科,中国云南昆明650032;3.昆明理工大学生命科学与技术学院,中国云南昆明650500)
物质生活水平的不断提高改变了人类的饮食方式,高蛋白质高脂肪的饮食给人类健康带来了越来越多的负面影响。其中,心脑血管疾病已经成为威胁人类健康的一大重要因素[1]。血清胆固醇含量过高被认为是诱发高血压、冠心病等心血管疾病的重要因素,降低血清胆固醇水平直接关系到人类的健康水平[2,3]。目前,常用的降固醇药物可以有效降低血管中的胆固醇含量[4]。例如,他汀类药物能有效抑制体内胆固醇的从头合成途径,已被广泛应用于临床治疗。然而他汀类药物在临床上依然存在着一定比例的副作用和不确定性,尤其是在高剂量使用时[5]。例如,他汀类药物可导致横纹肌溶解症与肝脏细胞损伤,进而破坏机体内新陈代谢系统的功能[6]。因此,找寻可以增加治疗范围且毒副作用小的方法势在必行。
国内外大量研究表明,某些益生菌可有效降低生存环境中的胆固醇含量,且因其副作用小等优点一直以来成为益生菌相关研究的热点,然而大多数研究均集中于乳杆菌属[7,8],对肠球菌属的研究相对较少。Divyashri等[9]研究证明,Enterococcus faecium CFR 3003菌株在模拟胃肠道环境下,具有良好的生存能力和生化特性,但未对该菌株是否具有降胆固醇能力进行深入研究。
本研究首先检测了22株分离自云南传统发酵食品的屎肠球菌(E.faecium)的降胆固醇能力,并从中筛选出3株降胆固醇能力较佳的菌株,分析其耐酸耐胆盐能力、溶血性能、对抗生素的敏感程度、胆盐水解酶活性,以初步分析其胆固醇降解机制,为后续降胆固醇功能性发酵食品的研发提供菌种保证和理论基础。
1 材料与方法
1.1 材料与试剂
本研究所使用的22株屎肠球菌现均保藏于昆明理工大学生命科学与技术学院应用微生物研究室。
实验用主要培养基:MRS肉汤培养基(pH 6.2±0.2,OXOID公司,英国);MRS改良培养基,该培养基以胆固醇代替葡萄糖作为培养基中唯一碳源,胆固醇浓度为0.192 mg/mL,其余MRS培养基组分和比例不变;MH培养基(广东环凯微生物科技有限公司);BHI培养基(北京奥博星生物技术有限责任公司)。
实验用主要试剂:胆固醇(北京鼎国昌盛生物技术有限责任公司);甲醇(色谱纯,美国MREDA公司;分析纯,东营天正化工有限公司);浓硫酸(重庆川东化工集团有限公司);牛胆盐(北京奥博星生物技术有限责任公司);无菌脱纤维羊血(广州蕊特生物科技有限公司);异丙醇(天津风船化学试剂科技有限公司);甘氨胆酸钠(上海源叶生物科技有限公司);牛磺胆酸钠(TCI公司,日本)。
实验用主要溶液:FeSO4-冰乙酸-浓硫酸显色剂,将FeSO4100 mg溶于1 mL蒸馏水中,再加入100 mL冰乙酸混合溶解,然后与100 mL浓硫酸缓慢混匀,冷却后备用;胆固醇标准液,精确秤取0.192 g胆固醇,用蒸馏水定容至1 L,即得浓度0.192 mg/mL的胆固醇标准液,然后梯度稀释得浓度依次为 0 mg/mL、0.048 mg/mL、0.096 mg/mL、0.144 mg/mL、0.192 mg/mL的标准液;甘氨胆酸钠标准液,精确称取0.004 9 g甘氨胆酸钠溶解于10 mL的甲醇中,即得浓度为1 mmol/L目标溶液,然后梯度稀释得浓度依次为0.8 mmol/L、0.6 mmol/L、0.4 mmol/L、0.2 mmol/L的标准液。
1.2 仪器与设备
恒温摇床(ZHWY-200D,上海智诚分析仪器有限公司);电子分析天平(SI-234,Sartorius公司,德国);超声波细胞破碎机(SCIENTZ-IID,宁波新芝生物科技股份有限公司);PCR仪(PCR system 2720,ABI公司,新加坡);高速冷冻离心机(3-18K,Sigma公司,德国);紫外分光光度计(GENOVA公司,英国);恒温水浴槽(KTS-2346 AS ONE,日本);YP-1002N电子天平(上海恒平科学仪器有限公司);金属浴(FUNAKOSHI公司,日本);HPLC仪和反相柱(Agilent Technologies Inc.,美国)。
1.3 方法
1.3.1 菌株复壮
将菌株用MRS液体培养基复壮两次后,当各菌株活菌数达到1012cfu/mL时,按4‰接种量将菌株接种至特定的MRS液体培养基中,37℃静置培养至所需的时间。
1.3.2 降胆固醇功能性屎肠球菌的测定
利用略作改良的皂化-比色法[10]对22株屎肠球菌的降胆固醇能力进行检测。将复壮后的菌株接种至50 mL MRS改良培养基中,37℃静置培养72 h,然后按照皂化-比色法处理并于490 nm波长下测定被测样品的OD值。同法处理胆固醇标准液,以胆固醇标准液浓度为横坐标,吸光度值为纵坐标绘制标准曲线,最终根据被测样品的吸光度值计算样品中胆固醇含量,并以公式计算被测菌株的胆固醇去除率:Rc=(a-b)/a×100%,其中a表示培养基初始培养时的胆固醇浓度,b表示培养结束后培养液中胆固醇浓度。从得到的结果中,筛选出3株降解能力较佳的菌株进行后续研究。
1.3.3 屎肠球菌耐酸和耐胆盐能力的检测
利用平板计数法对3株屎肠球菌的耐酸能力进行检测,具体操作步骤参照已有文献[11]进行:将复壮后的菌株接种至pH分别为2.0和3.0的新鲜MRS液体培养基中,37℃静置培养3 h。在0 h、1 h、2 h、3 h时间点分别吸取100 μL菌液调节 pH至6.2(与MRS培养基相同)后涂布于MRS琼脂培养基上,37℃静置培养24 h左右,记录菌落数。
耐胆盐能力检测同上,即复壮后的菌株分别接种至含不同胆盐浓度的MRS液体培养基中,胆盐质量浓度分别为:0.3%、0.5%、1%,静置培养后涂布于MRS琼脂培养基上培养,记录菌落总数,不含有胆盐的无菌水作为空白对照。
1.3.4 屎肠球菌胆盐水解酶(bile salt hydrolase,BSH)活性的检测
利用高效液相色谱法检测3株屎肠球菌的BSH活性[12]。样品前处理方法如下:将复壮后的菌株接种至含有1 mmol/L的甘氨胆酸钠和牛磺胆酸钠的新鲜MRS液体培养基中,37℃静置培养24 h后,在1 mL样品中加入6 mol/L HCl使样品酸化(终止BSH活性反应)。甘氨胆酸钠作为标准品被测定。在1 mL样品中加入4 mL异丙醇,充分混匀10 min,然后在11 641 r/min下离心10 min,随后将4 mL上层有机相移至干净的试管内,在85℃下蒸发溶剂,随后将胆盐提取物重新溶解在800 μL甲醇中,再用0.45 μm过滤器过滤,保存在-20℃以备后续检测。
色谱条件:溶剂A为HPLC专用甲醇;溶剂B为0.01 mol/L乙酸钠(用磷酸调节pH至4.3),含有65%甲醇。流动相为35%溶剂A和65%溶剂B,无梯度洗脱,流速为1 mL/min。注射样品:10 μL,紫外线波长检测为202 nm;保留时间为10 min。以甘氨胆酸钠标准液浓度为横坐标,峰面积为纵坐标绘制标准曲线。最终根据被测样品的峰面积计算培养基中甘氨胆酸钠的含量,并以公式计算检测菌株对甘氨胆酸钠的降解率:Rs=(c-d)/c×100%,其中c表示培养基初始培养时的甘氨胆酸钠浓度,d表示培养结束后培养基中甘氨胆酸钠浓度。
1.3.5 屎肠球菌降胆固醇能力的检测
在含有胆盐的MRS液体培养基中培养3株屎肠球菌,利用略作改良的皂化-比色法检测其降解胆固醇的能力。然后将复壮后的菌株接种至50 mL胆盐浓度为0.3%的 MRS改良培养基中,在37℃下静置培养72 h后,利用皂化-比色法测定培养基上清液中胆固醇的含量,从而测定菌株降解胆固醇的能力是否发生改变。
1.3.6 屎肠球菌的安全性评估
屎肠球菌溶血性试验[13]:将复壮后的菌株按平板法接种于含5%的无脱纤维蛋白羊血的BHI培养基中,37℃培养48 h,随后观察菌株的溶血情况。金黄色葡萄球菌作为阳性对照。
屎肠球菌抗药性检测:利用略作改良的琼脂扩散法(NCCLS 2003)检测屎肠球菌的抗药性。具体步骤如下:取复壮后的菌液1 mL离心,得到菌体沉淀,用无菌生理盐水洗涤菌体沉淀2次后,重新悬浮菌液。然后,取适量的菌液按平板法涂布于MH琼脂培养基中。待平板凝固后用无菌镊子取药敏纸片贴于平板表面,37℃培养24 h后,测量抑菌圈直径。以大肠埃希菌ATCC 25922(菌株保藏于昆明理工大学应用微生物实验室)作为标准质控菌。
1.4 数据处理与分析
本研究所得实验数据经Microsoft Excel 2010及RSD值计算统计软件处理,所得平均值和标准偏差均由两个以上样品的测量结果经计算得到,结果均以平均值±标准偏差(±s)表示。
2 结果与分析
2.1 屎肠球菌降解胆固醇的能力
以胆固醇标准浓度为横坐标,490 nm下的吸光度值为纵坐标进行线性回归分析,得线性回归方程 y=1.792x+1.45×10-6,R=0.999 (R2=0.999 7)。如表1所示,这22株屎肠球菌均具有体外降解胆固醇的能力,其降解能力为85.93%~21.25%。其中SP5-6L菌株的体外降解率高达85.93%,与其他研究菌株相比,具有一定的胆固醇降解优势。
为了探讨上述菌株在体内应用的可能性,对其进行了耐酸耐胆盐试验。其中,多数菌株在胆盐条件下不能很好的生存。故文中主要选取在胆盐条件下生长良好的3株菌(SP5-6L、JS2和ML13-5)进行后续实验。SP5-6L菌株在含有胆盐的MRS液体培养基中胆固醇降解率为45.55%,与之前不含胆盐时的降解率相比,显著降低(图1),这可能是因为该菌株虽然可以耐受一定浓度的胆盐,但是其生长还是受到胆盐的影响,所以在培养过程中,活菌数也显著减少,从而造成其胆固醇降解率大幅度降低。而JS2菌株与ML13-5菌株在胆盐存在情况下,虽然其胆固醇去除率有一定升高,但涨幅不明显(图1)。Ilavenil等[14]的研究表明,戊糖小球菌KCC-23菌株在含有0.3%胆盐培养时,其胆固醇的去除率可达到70%左右。这与本文结果并不一致,可见,本研究中3株菌降解胆固醇的原理可能并不是通过BSH催化胆盐由结合型转变成游离型进而沉淀胆固醇,具体的机制还需要进一步研究。
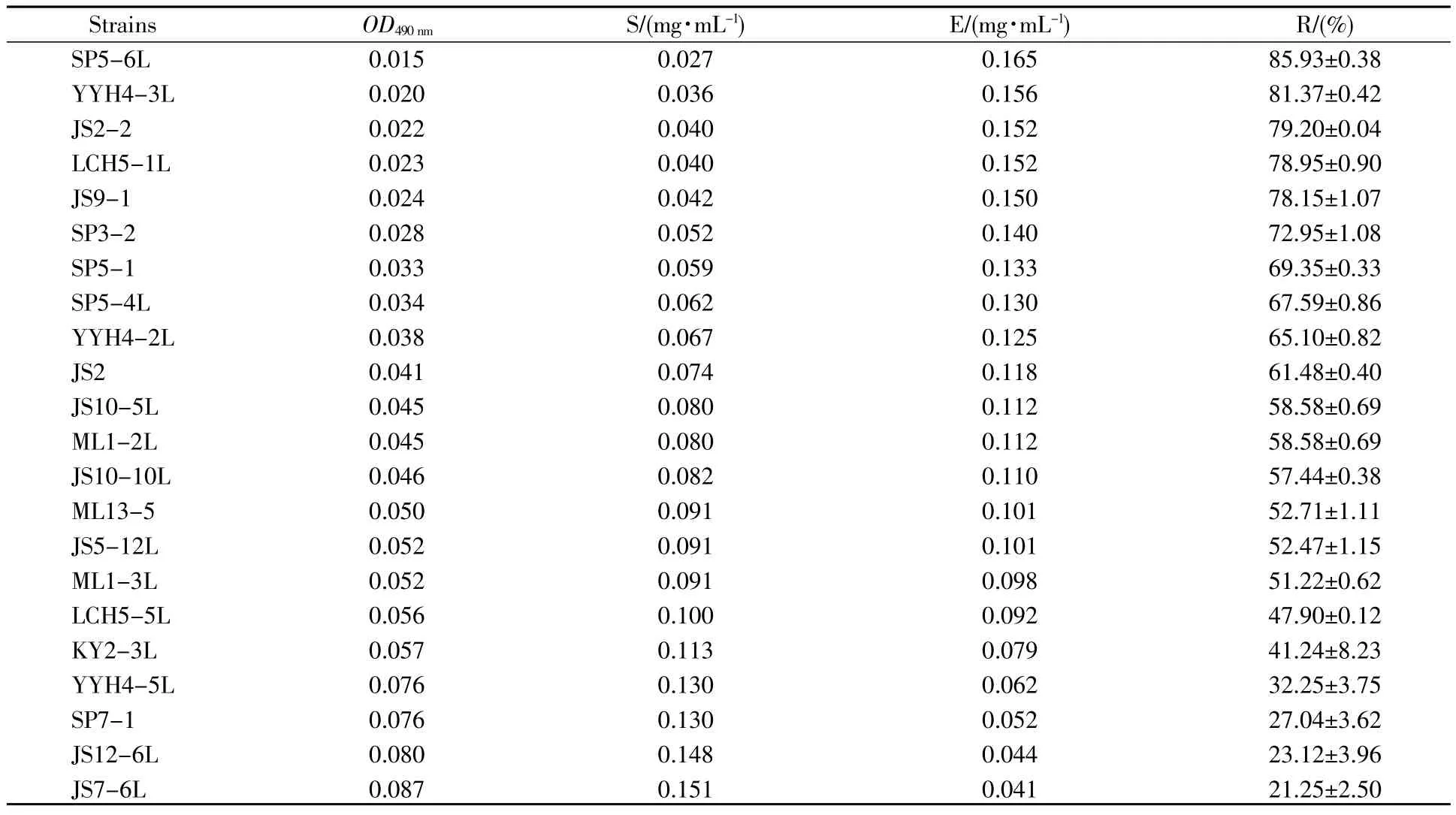
表1 屎肠球菌降解胆固醇能力Table1 The cholesterol-reducing ability of 22 E.faecium strains

图1 培养基中有无胆盐对3株菌株降解胆固醇能力的影响Fig.1 Influence of the bile salt on the cholesterol-reducing ability of the probiotics
2.2 屎肠球菌耐酸耐胆盐能力和BSH活性
通过在培养基中添加不同的酸和胆盐浓度来探讨酸和胆盐对这3株菌生长的影响。在前述结果(表1)中,SP5-6L菌株具有最高的胆固醇去除率(85.93%),但是进一步的实验显示:其无法耐受酸的影响,胆盐浓度也会影响其生长,log cfu/mL值由13.03降到7.56(表2)。另外两株菌的生长也受到酸和胆盐的一定影响,在pH 3.0以及不同的胆盐浓度下,JS2菌株的活菌数降低至50%左右;ML13-5菌株受到酸的影响要大于胆盐,在酸性条件下,其活菌数大约下降至50%左右,而在不同浓度的胆盐下,活菌数还能有原来的70%以上(表2)。在Mandal等[15]的研究中,乳酸片球菌的生长也受到酸的影响,说明体内较低的pH还是会对益生菌造成较大影响。
多数学者认为,细菌中存在几种胆固醇降解机制,其中一种机制是胆固醇的溶解度取决于胆盐的溶解度,菌株的BSH可以催化结合型胆盐转变成游离性胆盐,而后者可以与甘氨胆酸钠或牛磺胆酸钠结合形成沉淀,并由粪便排出体外,从而降低胆固醇含量[15]。这提示,甘氨胆酸钠的含量变化可以从侧面反映菌株BSH活性的变化。表3的结果显示,在SP5-6L、JS2、ML13-5这3种菌株培养后培养基中的甘氨胆酸钠浓度大大降低,由1 mmol/L降低到0.28±0.05 mmol/L,由此证明这3株菌具有较强的BSH活性。Anandharaj等[16]研究证实乳杆菌属的菌株在含有甘氨胆酸钠的环境培养后,甘氨胆酸钠的浓度也从6 mmol/L降低至1.25±0.12 mmol/L,由此证实这3株屎肠球菌具有BSH活性,且在胆盐存在条件下,仍然具有一定的水解活性。
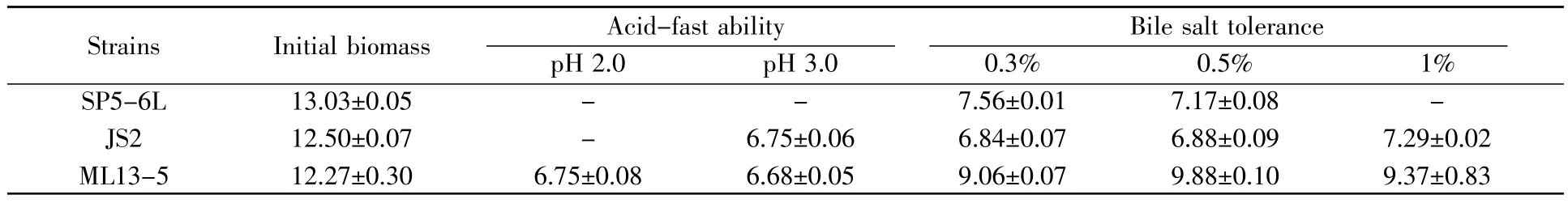
表2 屎肠球菌的耐酸耐胆盐能力(log cfu/mL)Table2 Acid and bile salt tolerance of E.faecium strains(log cfu/mL)
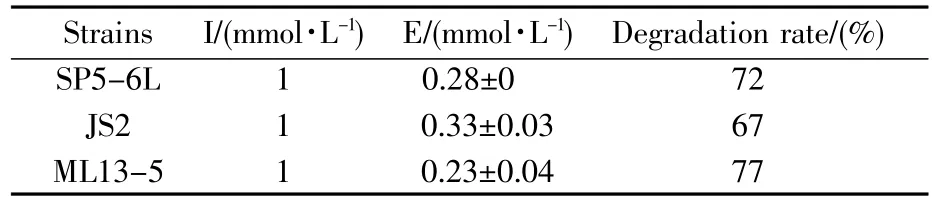
表3 屎肠球菌中胆盐的溶解度Table3 The activity of BSH of probiotics
2.3 屎肠球菌的安全性
溶血性试验表明,文中所选3种屎肠球菌均无溶血性,都不会引起红细胞破裂,也不会产生溶血环,说明这3株菌不产生溶血素,对人体相对安全(图2)。
屎肠球菌对抗生素的敏感性测试结果表明,这3株菌对万古霉素、诺氟沙星具有抗性,SP5-6L菌株和JS2菌株对链霉素、庆大霉素具有敏感性。此外,SP5-6L菌株对氨苄青霉素具有抗性,而对其他5种抗生素表现为中间抗性;JS2菌株对四环素具有敏感性,对利福平具有抗性,而对其他4种抗生素表现为中间抗性;ML13-5菌株对氨苄青霉素具有敏感性,对链霉素表现为中间抗性,而对其他6种抗生素具有抗性(表4)。

图2 三株屎肠球菌(A)和金黄色葡萄球菌(B)的细菌溶血试验Fig.2 The hemolysis of the three E.faecium strains(A)and the Staphylococcus aureus strain(B)
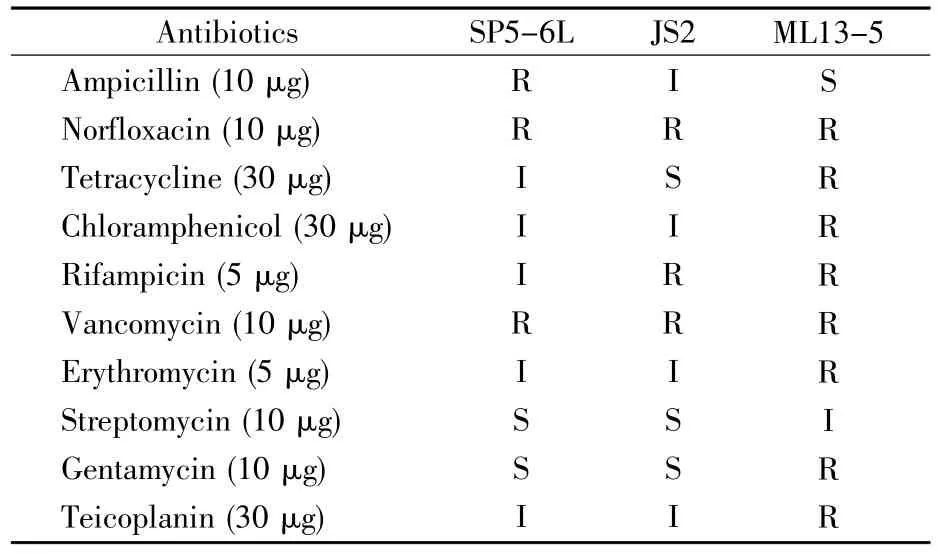
表4 屎肠球菌的抗药性Table4 The antibiotic resistance of E.faecium
3 结论
心脑血管疾病一直以来威胁着人类健康,探索其有效的预防和治疗方法迫在眉睫。经过半个世纪的研究和探讨,已有充分的证据证明乳酸菌可以有效降低动物或人体胆固醇水平[17~19]。目前提出的乳酸菌降低胆固醇的作用机制假说之一是:细菌产生的BSH催化结合型胆盐转变成游离型胆盐,后者与胆固醇结合以沉淀形式排出体外,从而达到降低人体内胆固醇水平的目的[7,20,21]。
本研究所选用的22株屎肠球菌具有不同程度的体外降解胆固醇能力(表1)。根据胆盐耐受能力选取3株菌进行进一步研究,结果显示,所选用的3株屎肠球菌都有较强的BSH活性(表3),表明传统发酵食品中可能存在大量具有胆固醇降解能力的屎肠球菌及其他种益生菌,在对这些菌株进行系统研究后开发具有降胆固醇能力的健康食品是非常有必要的。
在模拟胃酸环境下,SP5-6L菌株几乎无法生长,由此证明该菌株耐酸能力较差,而JS2菌株与ML13-5菌株的活菌数虽然较初始培养时减少一半(表2),但还是可以证明这两株菌具有一定的耐酸性,在体内有潜力通过胃酸的极端环境而到达肠道。SP5-6L菌株耐胆盐能力较差(表2),这可能是由于BSH催化胆盐变成胆汁酸,降低了培养基中的pH(培养后pH为4.3),而SP5-6L菌株的耐酸能力较差,这样活菌数显著减少,胆固醇的去除率也随之降低。此外,在培养基中添加胆盐后发现,JS2菌株的胆固醇去除率无任何变化,而ML13-5菌株的去除率则增长16%,可能的原因是:屎肠球菌可以产生一定的有机酸,在酸性条件下,胆固醇与胆汁盐共沉淀使得胆固醇水平降低[22]。
肠球菌在食物防腐和发酵方面发挥关键作用,而且可在人体和哺乳动物的肠道中产生益生元[23],但是该菌种有时也会引发一些人类疾病,诸如菌血症、心内膜炎等感染病症[9,24]。因此,本文对SP5-6L、JS2、ML13-5这3株菌实施了溶血性试验和抗药性测试。结果证明这3株菌无溶血性,但是它们对10种抗生素的敏感性不尽相同,其中,ML13-5菌株对10种抗生素都具有一定抗药性。因此,虽然本研究对这些菌株的安全性做了相应试验,但是远远不能说明这些菌株能作为食品或药品发酵菌株投入到相应的生产中。待今后对其危害性进行进一步评估后才能考虑是否可将这些菌株投入到相应的生产应用中。

