苔藓植物化学生物学研究进展*
张教真,娄红祥
(山东大学药学院天然产物化学生物学教育部重点实验室 济南 250012)
苔藓植物(bryophytes)是高等植物中最低等的类群,他们植物体矮小,无维管组织,也没有花的结构,在分类学上界于藻类(algae)和蕨类(pteridophytes)之间。目前世界范围内的苔藓植物有约24000 种,在绿色陆地植物中,种类仅次于种子植物。它们的生命力非常强,分布广泛,无论是高山湖泊还是极地都可以看到苔藓植物的踪迹[1-4]。
苔藓植物包括为苔纲(Hepaticae,liverworts)、藓纲(Musci,mosses)和角苔纲(Anthocerotae,hornworts)三大类群[3]。油体(oil body),是苔藓植物中一类特殊的细胞器,外覆一层膜,仅存在于苔纲植物中(图1)。油体的作用学术界尚有争议,目前更为人所接受的推测是,它可以用来储存萜类芳香类等次级代谢产物,并进而起到化学防御的作用[5]。这也从一个方面解释了为何从苔类植物中分离得到的次级代谢产物在数量和结构新颖程度上都远大于其他两类苔藓植物。
苔类植物中的次级代谢产物主要以萜类和芳香类化合物为主,其中双联苄化合物被认为是苔类植物中的特征性成分,在其他高等植物中鲜有发现[2]。由于苔藓植物植株矮小,鉴定困难,难于富集的特点,长期以来,其化学成分研究一直为人所忽略。近年来随着分析测试仪器灵敏性和精密度的提高,苔藓植物研究呈现出的复杂多样的次级代谢产物,广泛的生物活性,以及化学分类与生物合成方面的意义与规律,受到越来越多的关注。本文结合国内外研究现状以及本课题组研究进展,对苔藓植物化学生物学研究作出总结。
1 苔藓植物研究概述
1.1 苔藓植物特殊的进化位点与生态意义
虽然目前学术界对最早的苔藓化石有所争议,但可以肯定的是,苔藓植物是地球上出现最早的高等植物,明确的证据表明,苔藓植物出现在陆地上的时间不会晚于距今4.75 亿年的中奥陶世[6]。作为高等植物的最低等类群(图2),苔藓植物没有维管组织和真正的根,但拥有陆生植物进化所有关键性突破:多细胞的二倍孢子体,配子体的顶端分生组织,孢子体的顶端分生组织和细胞组织分化。正是这些特征为苔藓植物在形态和生理上适应陆地生活提供了可能。科学家通过分析苔藓植物地钱模式种(Marchantia polymorpha)的基因序列发现,相比于轮藻(charophycean algae,陆生植物的起源),该陆生植物基因组能够编码全新的生物化学通路,新的植物激素信号通路,并增加了转录因子家族多样性;同时,相比于其他已经测序的陆生植物,地钱在大多数调节通路上显示出低的遗传冗余性,这一点与陆生植物的祖先十分相似[7]。上述研究在分子系统学的角度进一步证实了苔藓是水生到陆生的过渡态植物,值得一提的是,变水特性(poidilohydric)是大部分苔藓植物的重要特点,即苔藓在周边环境变得干燥后,可将体内含水量变得很低,一旦环境条件变得潮湿,又可以迅速吸干水分,回复正常的生理代谢活动。这一特性可导致林中沼泽或湖泊逐渐变为陆地,为其他高等植物的生长创造条件,也使得苔藓在生态保护中发挥着重要作用。

图1 苔藓植物的三大类群与苔纲植物中不同类型的油体
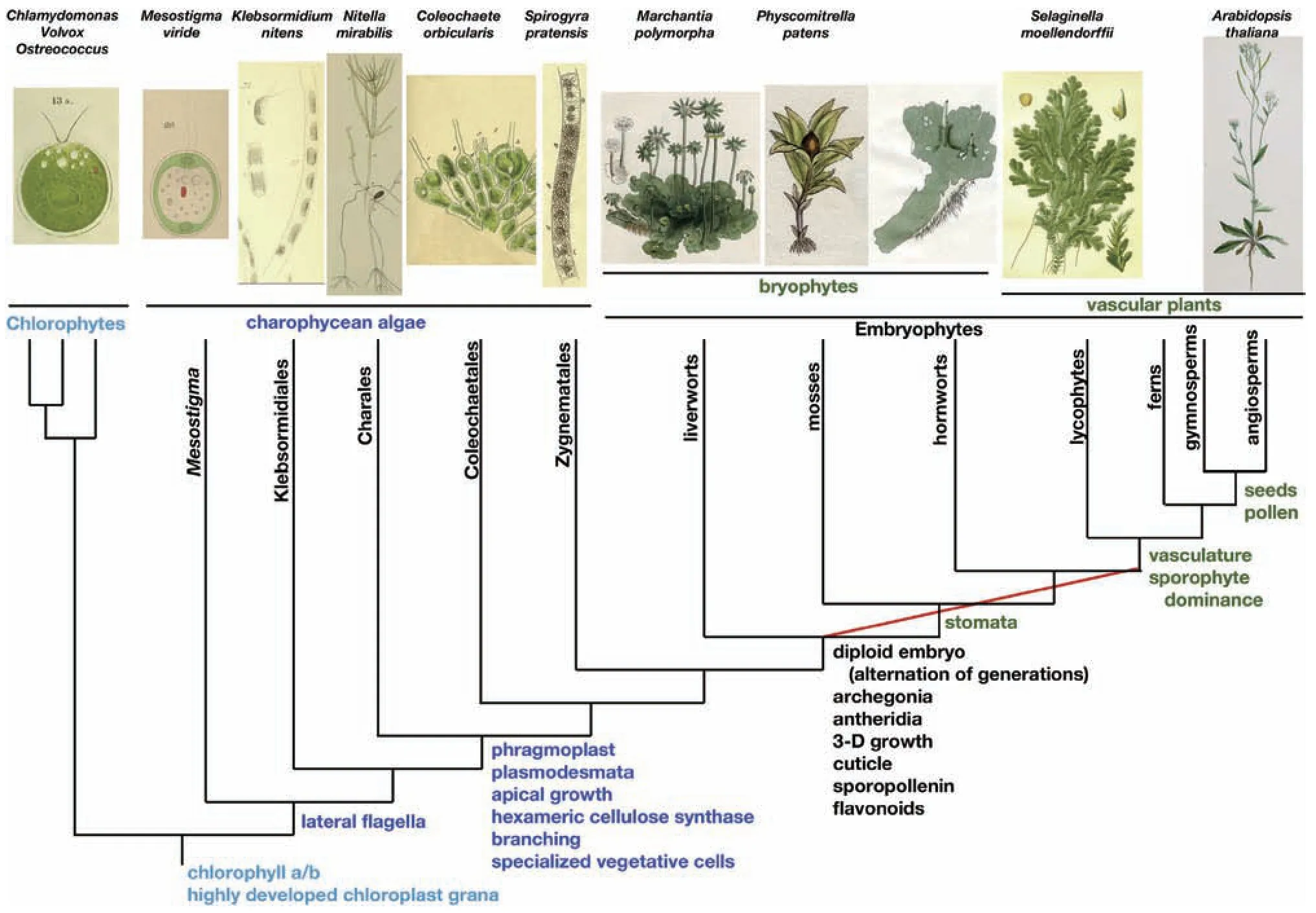
图2 苔藓植物在植物界中的进化位置[7]
1.2 苔藓植物化学与生物学多样性
1.2.1 苔藓植物的化学成分及其特性
苔藓植物是生物活性天然产物的重要来源。尤其是近年来从苔类植物中分离获得了大量结构新颖且活性显著的萜类、芳香类化合物,Askawa 等曾对此作出多次综述[8-10],现将苔类植物次级代谢产物结构特点概括如下:
(1)苔类植物次生代谢产物结构类型基本覆盖了天然产物的所有结构类型,但以萜类化合物和联苄类化合物为主。90%苔类植物含有油胞或细胞中含有油体结构,科学家证明油体是苔类植物合成和储存萜类化合物及联苄类化合物的单元。
(2)苔类植物中的化合物特别是联苄和部分萜类化合物常以二聚体或多聚体形式存在,如苔类植物中的双联苄、二聚倍半萜、二聚二萜等化合物。如从疏叶剪叶苔(Herbertus sakuraii)和马来西亚产硬须苔(Mastigophora diclados)中分离得到的mastigophorenes A-D 为剪叶苔烷型倍半萜的二聚体。从尖瓣光萼苔(Porella acutifolia)分离得到的bisacutifolones A-C则为绿叶苔烷型倍半萜的非对称结构的二聚体。波瓣合叶苔(Scapania undulata)中分离的scapaundulins A-B 是半日花烷型二萜化合物的二聚体。从羽苔属植物Plagiochila moritziana中分离得到的plagiospirolides AD为倍半萜和二萜化合物通过Diels-Alder加成反应后的产物。而在岐舌苔(Schistochila glaucescens)中分离得到的化合GBB A和B则是倍半萜类化合物与双联苄类化合物结合的二聚体。
(3)有些结构的化合物如绿叶苔烷(pinguisane)、全萼苔烷(gymnomitrane)、小萼苔烷(myltaylane)、环小萼苔烷(cyclomyltaylane)和vitrane 型倍半萜以及sacculatane 型二萜等迄今仅在苔类植物中发现,而不存在于高等植物、真菌、海洋生物中。
大环双联苄类化合物是苔类植物的一类典型化合物,迄今已鉴定80 余个。除riccardin C 最近也从报春花属植物Primula macrocalyx中分得外,其它所有大环双联苄仅在苔类植物中发现。
(4)与高等植物相比,苔类植物发现的多数倍半萜及一些二萜类化合物为高等植物中存在的相应化合物的对映异构体,但补身烷(drimane)、吉马烷(germacrene)和愈创木烷(guaiane)等型倍半萜以及松香烷(abietane)、克罗烷(clerodane)和半日花烷(labdane)等型二萜除外。
1.2.2 苔藓植物次级代谢产物的生物学活性
苔藓植物中的萜类和芳香类化合物具有广泛的生物学活性,包括抗肿瘤、抗菌、抗真菌、抗病毒、抗氧化、肌肉松弛、神经保护、昆虫拒食、酶抑制、杀寄生虫、杀软体动物及植物生长调节等。对双联苄类化合物抗肿瘤、抗真菌和逆转耐药等活性及作用机制的研究表明,该类化合物活性显著且作用机制明确,可作为新药开发的先导化合物(详见第2部分)。对苔藓植物活性成分的深入发掘表明,该类植物是活性天然产物的巨大宝库,值得更加深入研究。化学家与植物学家、药理学家应密切合作,开展多学科交叉的苔藓植物化学生物学研究,加强活性成分的筛选和作用机制研究,快速发现有应用价值的活性先导化合物[7-10]。
对于3 h和6 h累积降水的距平相关系数和均方根误差的评估结果与上述24 h累积降水的结果相一致,集成之后的结果相比最优方案有所提高。从TS评分中也发现,集成后也稍次于最优方案。由此发现通过简单集合平均可有效地解决各种方案预报不稳定的问题,充分发挥各种方案的优势,降低预报误差,提高预报技巧。
1.3 苔藓植物的化学分类学研究
20世纪60年代,在植物系统分类学与植物化学之间出现了一门新的交叉学科,即植物化学分类学(chemotaxonomy),又称植物化学系统 学(chemosystematics),是利用化学特征,来研究植物各类群之间亲缘关系,探讨植物界的演化规律,即从分子水平上来研究植物分类和系统演化的一门学科。
与高等维管植物相比,苔藓植物个体矮小,以致其形态鉴定与系统分类难度较大,因而研究其次级代谢产物对其分类具有重要意义。在苔藓植物中,90%的苔类都有油体,但藓类植物和角苔类植物中不含有油体。苔纲,藓纲,角苔纲三纲之间的化学成分具有较大的差异,这种化学上的差异显然支持植物分类学家对苔藓植物划分成苔纲,藓纲,角苔纲的观点。日本学者Asakawa 曾对苔藓植物的化学分类做了详细具体的综述[12,13],系统整理了叶苔亚纲的36个科,和地钱亚纲的7 个科的不同种属植物的化学成分与系统分类的关系。本课题组在苔藓化学生物学方面的研究也使得苔藓植物化学分类学不断取得新的进展。相信未来随着对人们苔藓植物研究的日益重视,积累的化学资料将越来越丰富,同时伴随着分子生物学资料的积累和介入,苔藓植物化学分类学将会取得更大的突破。

图3 苔藓植物中的新骨架化合物
2 本课题组在苔藓植物化学生物学方面研究进展
2.1 苔藓植物中特殊化学成分的研究
2.1.1 联苄类化合物的快速发现与结构多样性制备
本课题组建立了通过HPLC/TLC-MS 与生物自显影技术相结合,快速发现苔藓植物中双联苄类化合物的方法,发现了一系列具有抗真菌/抗肿瘤活性的双联苄类化合物[14-16]。为了进一步拓展该类化合物在新药研发方面的潜力,我们利用全合成法对四种双联苄类化合物地钱素C、片叶苔素D、羽苔素E 和dihydroptychantol A 进行制备,并在此基础上通过醚化、溴代、Mannich 反应等制备一系列结构新颖的活性衍生物[17-19]。
2.1.2 新骨架萜类化合物的发现
苔类植物是结构新颖的萜类化合物的重要来源。在粗疣合叶苔(Scapania parva)中分离得到的scaparvin A[20],在多形带叶苔(Pallavicinia ambigua)中分离得到的pallambins A 和B[21],在裸蒴苔(Haplomitrium mnioides)中分离得到的haplomintrins A和B[22]以及hapmnioides A-C[23],都是本课题组在苔类植物中分离得到的骨架新颖的二萜类化合物,最近,我们在圆叶羽苔(Plagiochila duthiana)中得到了两个骨架新颖的倍半萜类化合物plagiochianins A and B(图3)[24]。
在寻找苔藓植物中特殊化学成分的过程中,本课题组首次在苔藓中发现光催化反应参与天然产物合成过程的后修饰,是天然产物多样化生成的重要步骤。pallambins A 和B[25],haplomintrins A 和B,haplomintrins D-G[26]等新骨架化合物都被证明可由已知的半日花烷型二萜经光致重排得到。
2.1.3 活性化合物多靶点生物学研究以及活性化合物库的建立
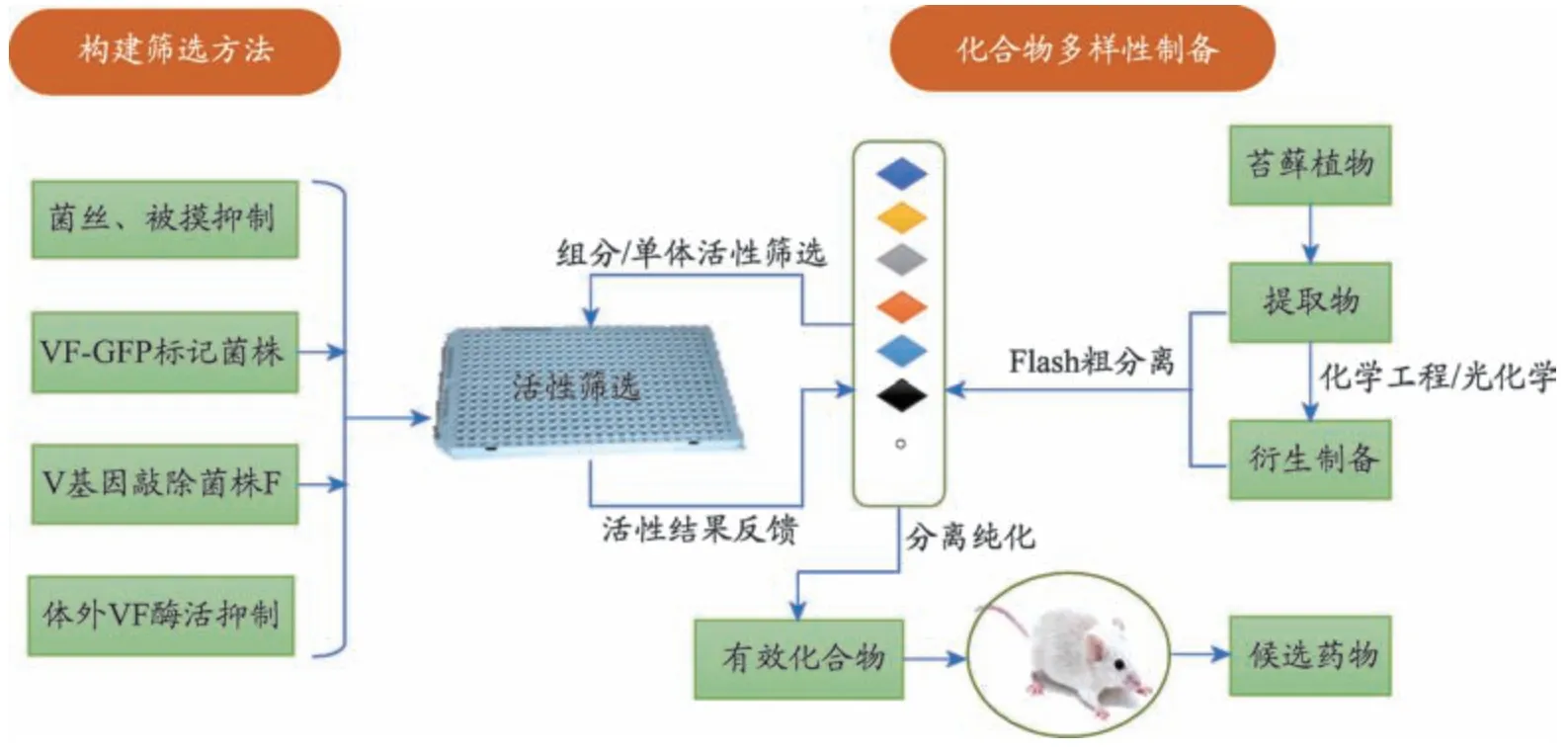
图4 苔藓植物中抑制菌丝毒力化合物高通量筛选方法
本课题组通过多种手段评价了分离得到的化合物的生物学活性,并进行相应机制研究与成药性研究。本课题组首次发现双联苄类化合物(地钱素C 及其衍生物)为新型微管蛋白解聚剂[28],并发现双联苄衍生物(RD-N)能够特异性靶向溶酶体,通过亚细胞导向实现了双联苄类化合物精准给药,提高治疗指数[29]。此外,多种萜类化合物被发现具有抗肿瘤,抗炎,植物生者调节等作用[23,27,30]。在对我国逾100种苔藓植物进行系统的化学生物学研究的基础上,我们发现了新化合物350 余个,构建形成了超过3000 个化合物的苔藓化合物库,为创新药物发现奠定了物质基础
2.2 苔藓植物化学成分抗真菌毒力研究
真菌感染发病普遍,侵袭性真菌感染死亡率更是高达40%。真菌毒力因子的表达与真菌对宿主的侵袭、感染、器官组织破坏等密切相关。抑制真菌毒力因子是发现新型抗真菌药的重要策略,本课题组建立了以真菌毒力因子为靶点的抗真菌药物筛选平台,实现了抗真菌化合物的高通量筛选(图4)。苔藓植物具有不被真菌感染的特性,说明其体内具有大量的抗真菌物质。我们发现发现苔藓植物中的双联苄、萜类化合物等能过通过抑制真菌菌丝形成、抗粘附、抑制被膜形成、抑制外排泵表达等方式发挥抗真菌作用[31-34]。
以riccardin D为代表的双联苄类化合物能够通过下调真菌粘附、抑制菌丝和被膜生长相关通路基因表达、改变细胞膜甾醇组成、促进Dpp3 合成Farnesol 等途径降低真菌毒力[33]。密叶三瓣苔(Tritomaria quinquedentata)中的倍半萜类化合物ent-iLL 对CDR基因敲除的白色念珠菌表现出较强的抗真菌和抑制菌丝的活性,而对野生型菌无效。我们通过药物胞内含量测定以及ent-iLL 与CDR 抑制剂RD 联用表现出更强活性,验证了ent-iLL 是Cdrs 的底物的猜想,并通过GC-MS和RT-PCR研究了ent-iLL的抑菌机制,发现其能够干扰甾醇合成来发挥其抑菌活性[34]。
2.3 苔藓植物特殊的生物合成过程研究
苔藓植物富含次生代谢产物,但是由于除小立碗藓之外的其他苔藓植物遗传背景尚不清楚,加之苔藓植物与维管植物亲缘关系比较远,根据保守序列进行基因克隆有很大困难,所以对苔藓植物次生代谢产物生物合成途径研究最初主要依靠同位素追踪。本课题组构建了苔藓植物组织培养体系,研究了苔藓植物特有成分双联苄等生物合成过程中的关键酶,揭示了生物合成规律与其他高等植物的差异,提出了生物合成规律与植物进化的关系。
苔藓植物富含联苄类化合物,而且是最早出现黄酮类化合物的植物,这两类化合物共同来源于苯丙烷途径,起始于苯丙氨酸,在这个途径中,苯丙氨酸裂解酶(L-phenylalanine ammonia-lyase,PAL),4-羟基肉桂酰辅酶A连接酶(p-coumarate CoA ligase,4CL),查尔酮合成酶(chalcone synthase,CHS),羧酸茋类合成酶(stilbenecarboxylate synthase,STCS),查尔酮异构酶(chalcone isomerase,CHI),黄酮合成酶(flavone synthase,FNS)等都是关键酶。本课题组通过构建苔藓植物组织培养体系建立cDNA 文库,EST 测序,转录组测序等方法,获得了这些关健酶基因及调控这些基因表达的转录因子,并鉴定了其功能,为下一步通过代谢工程生产这些化合物奠定了基础。通过研究双联苄的生物合成规律,发现苔藓植物中的双联苄和陆地其他高等植物中的黄酮拥有共同的起始生源,关键的STCS 合成酶的结构微小差异造成了苔藓植物中生成联苄。而其他高等植物合成黄酮的巨大差异,这对揭示苔藓植物的进化规律具有重要的意义[35-39]。
最近,本课题组对苔类植物CHI 的功能及进化进行了深入研究研究。传统观点认为,有催化功能的CHI 仅存在于维管植物中,I 型CHI 在植物界普遍存在,而具有更广泛底物选择性的Ⅱ型CHI 仅存在于豆科植物中,而且是由I 型CHI 经基因复制而来,是更为晚期的进化事件。我们通过分析苔类植物转录组数据和江南卷柏基因组测序数据,筛选到查尔酮异构酶CHI家族基因进行研究,通过进化树分析,体外生化实验及体内遗传学实验证明苔类植物和江南卷柏不含有I型CHI,而是普遍含有II型CHI,能以柚皮素查尔酮为底物生成柚皮素,还能将异甘草素转变成甘草素,这是首次证明Ⅱ型CHI 在非豆科植物中存在,同时也证明非维管植物中含有有功能的CHI。这些结果更新了关于查尔酮异构酶进化的认识,表明有功能查尔酮异构酶的出现是一个古老的事件,发生在苔藓植物种群出现之前[40]。
3 结语
正如古诗文中所说的“苔花如米小,也学牡丹开”,虽然苔藓没有真正的花,人们看到的只是它的苞蒴。但对苔藓的化学和生物学研究已经表明,苔藓中的化学成分以及其生物意义并不比高等植物逊色。相信未来,随着化学,药理学,植物学等多学科共同研究的不断深入,会让更多的人看到苔藓植物的光彩与价值。