乳腺上皮-肌上皮病变的临床病理分析
王 帅,梅 丽,吕 明,郭黎黎
(1.吉林省肿瘤医院 病理科,吉林 长春130012;2.吉林大学第一医院 联合超声科)
1970年Hamperl[1]首次描述了乳腺腺肌上皮瘤(AME),认为该疾病是由腺上皮和肌上皮共同增生形成的良性肿瘤。随着进一步的研究发现,这类疾病表现为乳腺导管和小管内上皮不同程度的增生,伴有周围多灶性或弥漫梭形或立方形肌上皮细胞增生,增生的肌上皮细胞形态多样,有时需要通过免疫组织化学标记才能区别,因此曾有人定义该疾病为乳腺上皮-肌上皮病变。在2012年世界卫生组织出版的乳腺肿瘤分类中明确把这类疾病定义为乳腺上皮-肌上皮和肌上皮病变,镜下可见乳腺导管和(或)小管内上皮与肌上皮这两类细胞构成的病变。由于该疾病较少见,故临床病理诊断中容易误诊,本文总结10例乳腺上皮-肌上皮病变,通过探讨临床影像学、病理形态及免疫组化标记特点来认识及分析该疾病。
1 材料与方法
1. 1 临床资料查阅2012年-2017年我科明确诊断的乳腺上皮-肌上皮病变患者10例,年龄 27-40岁(表1)。患者一般无明显症状,大部分为体检或无意中发现,个别患者出现乳头溢液。超声表现为低回声区,一般边界尚清,其中1例为囊实性回声,边界清,磁共振乳腺平扫加增强加弥散显示:乳腺内可见囊实性肿物-实性部分向腔内突出状,T1WI呈略低-略高信号,T2WI呈等-明显高信号,高b值DWI上呈环形高-实性部分结节状高信号,ADCmap呈高-实性部分呈略低信号(低信号部分ADC值约0.882×10-3s/mm2;高信号部分ADC值约2.070×10-3s/mm2),动态增强早期呈不规则环形强化,局部可见壁结节,呈明显强化,病灶内其余部分未见确切强化,病灶整体长径约2.7 cm(SE701,IM36),多点测量时间信号强度曲线呈早期迅速上升后平台型(图1)。

10例乳腺上皮-肌上皮病变临床病理资料
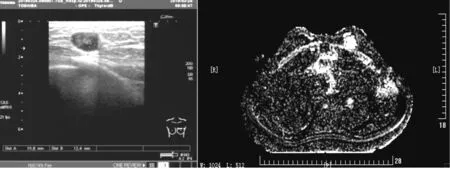
图1 T1WI呈低信号,T2WI及压水呈高信号,DWI上呈低信号,增强后少许囊壁强化
1.2 方法全部病例均通过手术切除完整送检,离体后30分钟内用10%的中性福尔马林固定液剖开固定12-24小时,常规石蜡包埋, 行HE染色和相应的免疫组织化学染色。免疫组织化学染色采用 ENVISION 两步法,全部抗体均通过全自动免疫组化染色仪进行染色(罗氏VENTANA)。免疫组化抗体均购自北京中杉金桥公司:CK、Vim、P63、Ki67、S-100、CK14、CK5/6、CD10、CgA、Syn、ER、PR、Calponin。
2 结果
2.1 大体检查肿瘤直径 1.8-2.7 cm不等,切面灰白或灰红色,质地软,局部可见囊性区。
2.2 镜下检查乳腺导管和小管内上皮不同程度的增生,伴有周围多灶性或弥漫梭形或立方形肌上皮细胞增生(图2、3)。乳腺导管和小管内腺上皮呈立方形或矮柱状,有部分病例可见顶浆分泌,胞浆嗜酸性,核仁细小或不明显,缺乏异型性,部分腺管内上皮呈乳头状增生。肌上皮表现出形态多样,可呈透明胞浆样、嗜酸性或浆细胞样(玻璃样变),排列方式也成多样性,如:巢状、梁状、片状或条索状。常常表现为腺管周围增生的肌上皮呈鞘状或套袖样增生。
2.3 免疫组化病变中增生的腺上皮CK、CK7强阳性,CK5/6(图4)、EMA、ER、PR均有不同程度的阳性表达,增生的肌上皮免疫组化标记SMA、P63(图5)、CD10、Calponin(图6),但CK呈弱阳性(图7)。ER、PR均呈阴性表达。Ki67大部分低表达。

3 讨论
乳腺肌上皮和上皮-肌上皮病变的谱系相对较广,仅仅单纯的肌上皮细胞增生可以见于许多种乳腺良性增生性疾病中,如腺病、复杂硬化性增生和导管内乳头状瘤等。当病变呈灶状或弥漫性改变时称为肌上皮增生病,又称腺肌上皮瘤病。腺肌上皮瘤多为老年女性,常为单发、界限清楚的无痛性肿块,多发生在乳腺的外周部。切除不净可复发。大体肿瘤界限清楚、较硬,可呈分叶状或结节状,平均直径1-2.5 cm,可见小囊腔。乳腺肌上皮瘤极罕见,通常采用扩大切除。大体肿瘤通常界限清楚,边缘不规则,质硬,可有灶性出血。多形性腺瘤在乳腺罕见,主要见于老年女性。约26%的多形性腺瘤伴有导管内乳头状瘤,少数病例可有复发。
单纯的肌上皮细胞增生,镜下显示肌上皮数目增多,细胞体积增大,呈圆形、卵圆形或短梭形,胞浆透明或嗜酸性。细胞核呈卵圆形或梭形。当肌上皮和腺上皮均呈单层增生时,细胞密度增加,腺管清楚地呈现双层细胞图像,当单纯肌上皮增生时,腺管可以被挤压的变狭长,这时腺上皮一般不明显或仅能见到少数残留细胞。肌上皮增生病一般镜下呈多灶性或弥漫性改变,立方状或梭形的肌上皮沿腺管外或内部增生,可进一步分为2种形态:(1)管内增生型:增生的梭形肌上皮呈明显的栅栏状排列,肌上皮可有纵形的核沟(类似于移行细胞),通常缺乏细胞的不典型性和核分裂像;(2)管周增生型:腺管周围的肌上皮有不同程度的增生,常伴有间质硬化或变性,似硬化性腺病,增生的肌上皮可有非典型性。腺肌上皮型的腺病镜下显示圆形或不规则形的小腺管弥漫分布,腺管一般被覆立方-柱状上皮,腺管周围的肌上皮明显增生,可具有透明性的胞浆。一般增生的细胞缺乏不典型性和核分裂像,可有鳞状上皮化生及大汗腺化生,也可以伴有腺肌上皮瘤。肌上皮增生病,一般病变较局限性,呈单纯性肌上皮增生。腺肌上皮瘤一般是界限清楚的肿物,镜下肌上皮细胞呈片状显著的增生,当小叶上皮出现透明细胞变时肌上皮可不明显。一般腺肌上皮瘤多数呈现导管内乳头状瘤的变型,仅有少数来自小叶的增生,典型病变基本结构是腺管外周有明显增生的肌上皮细胞,腺管呈圆形或卵圆形,内衬腺上皮呈立方或低柱状,而周围的肌上皮呈梭形或多边形,胞浆透亮、嗜酸性,在腺体间呈多层、片状、条索状和(或)巢状分布,通常被基底膜及纤维血管间质分隔开来。镜下腺上皮深染的胞浆和肌上皮淡染透明的胞浆形成鲜明对比。Tavassoli[2]根据病变镜下结构及肌上皮形态的不同,将该病变进一步分为3种类型。(1)梭形细胞型:以梭形肌上皮增生为主,呈巢片状分布,其中夹杂少量腺腔。(2)小腺管型:主要为外绕肌上皮内衬腺上皮大小不等的小腺管组成,肌上皮可不明显,腺上皮胞质可淡染或有嗜酸性颗粒。(3)小叶型:周围的纤维组织向肌上皮结节内生长,将肿瘤分隔成小叶状。增生肌上皮核分裂罕见,通常≤3个/10HPF。可有大汗腺、皮脂腺和鳞状化生。结节状病变的纤维间隔可有透明变、粘液样变或梗死,其周围可有卫星病灶。小管状病变可有浸润性边缘。少数可完全位于扩大的囊腔内。免疫组化:肌上皮P63、calponin、SMMHC等肌上皮标记物阳性,Zhu等[3]研究发现乳腺腺肌上皮瘤中肌上皮细胞SMA和Calponin表达同样可靠。HCK可有阳性,LCK、ER、PR、Desmin和Her-2通常阴性,LCK腺上皮成分阳性。Gandhi等[4]对乳腺腺肌上皮瘤行免疫组织化学检测发现,以P63在肌上皮中的表达最为可靠。有的学者通过研究发现,对于这类疾病肿瘤性的肌上皮和正常肌上皮在免疫表型上是有所不同,肿瘤性的肌上皮并不是表达所有的肌上皮标志物,因此日常工作中建议要同时使用多种肌上皮标记物从而最大限度的检测出是否存在肌上皮[5]。
乳腺肌上皮和上皮-肌上皮病变需要和以下疾病鉴别诊:(1)恶性肌上皮瘤:恶性肌上皮瘤比良性肌上皮瘤多见,如为良性仅需局部扩大切除,而恶性者要行根治性乳腺切除加淋巴结清扫,并辅以术后放化疗,因此诊断上区分两者对于临床是十分必要的。一般当病变出现明显的细胞异型性和多形性,核分裂像大于5/10HPF和KI67指数大于10%,并见坏死时,则应考虑恶性肌上皮瘤的诊断。(2)多形性腺瘤:两者可能是一组相似的肿瘤,前者一般形态多样,组织结构复杂,常有腺管状结构、粘液软骨样基质及与其相过度的肌上皮,因此两者基本上可以区分。(3)梭形细胞癌:一种伴有广泛梭形细胞分化的浸润性乳腺癌,现归类于化生性癌,镜下肿瘤由腺癌小管和肿瘤性的梭形细胞构成,常有鳞状上皮化生(细胞一般比较温和),免疫组化标记梭形细胞表达CK7,可见actin、P63阳性的细胞通常散在分布或灶状分布。(4)纤维瘤病:一种不常见的局部浸润性病变,通常无特定的结节状病灶,病理学特征与起源于其他部位的纤维瘤病相同,肿瘤细胞呈束状或交错状排列,细胞偏温和,形成特征性指状突起浸润于病变临近的乳腺导管和小叶周围,免疫组化标记CK和S-100阴性,actin少数细胞阳性,β-catenin核阳性。(5)肌纤维母细胞瘤:肿瘤细胞间常可见宽大透明样变的胶原束,肿瘤向周围组织挤压呈膨胀性生长,瘤细胞表现为成纤维细胞样,相对较温和,炎症性细胞常罕见,免疫组织化学标记VIM和desmin阳性。SMA和CD34表达不一。CK、CD10、P63和calponin通常阴性。(6)无色素性梭形细胞型恶性黑色素瘤:通常伴有原发部位或(和)乳腺皮肤病变相关,肿瘤细胞异型性更明显,可见核沟、核膜皱褶、核内包涵体以及大的嗜酸性核仁,偶尔肿瘤细胞可以呈淋巴细胞样、上皮样、组织细胞样、梭形及横纹肌样等多种形态,免疫组化标记CK和actin阴性,HMB45、S-100及Melan-A阳性。

