氯喹对肝癌细胞体内外生长的影响及其与自噬的关系
胡若冰,杨玉秀,李修岭,丁辉,韩双印,丁松泽,孙锁峰
(郑州大学人民医院 消化内科,河南 郑州 450003)
肝细胞癌(hepatocellular carcinoma,HCC,以下简称肝癌)是世界范围内常见恶性肿瘤之一,约占人类肿瘤6%,具有浸润、转移性强特点,其病死率仅次于胃癌和肺癌,严重威胁着人们的生命健康和生活质量[1-2]。据世界卫生组织(World Health Organization,WHO)统计,2012年全世界一半以上新发生肝癌患者来自我国,肝癌早期临床症状不明显,确诊时多数患者已达中晚期,切除率不超过30%,肝癌术后易复发,化疗易产生耐药性,导致肝癌预后效果较差,5年总生存率不超过10%[3-4]。因此,研究肝癌发生机制并寻找有效治疗手段迫在眉睫。肝癌发生发展过程极其复杂,涉及多种分子信号通路参与。氯喹(chloroquine)是一种治疗疟疾、类风湿性疾病的药物,同时也是自噬(autophagy)抑制剂,可通过选择性地抑制细胞酸性溶酶体的降解作用而抑制自噬,导致细胞死亡[5-6]。氯喹可以通过miR-26 b 靶向调控Mcl-1水平诱导肝癌细胞Hep G2凋亡[7],氯喹还可以使肝癌组织G0/G1期细胞周期停滞,诱导DNA损坏并促进细胞凋亡[8]。细胞生理反应不仅含有增殖、凋亡、侵袭、迁移过程,还包括细胞自噬。自噬属于II型程序性死亡,参与细胞生物学进程。虽然氯喹对肝癌细胞有抑制增殖、促凋亡的作用,但是有关氯喹对肝癌组织自噬的研究报道较少,本研究通过肝癌细胞Huh7体外实验以及建立肝癌Huh7裸鼠肿瘤模型,探讨氯喹对肝癌的抑制作用以及对自噬的影响,为临床肝癌治疗方案制定,提供参考依据。
1 材料与方法
1.1 实验材料
SPF级实验用裸鼠(北京维通利华实验动物有限公司),人肝癌细胞株H u h 7 购自中国科学院(上海),自噬体膜蛋白微管相关蛋白1轻链3-I I/自噬体膜蛋白微管相关蛋白1 轻链3-I(microtubule-associated protein 1 light chain 3,LC3-II/LC3-I)、p62一抗(Thermo Fisher),LC3(Sigma)、p62(MBL)。
1.2 实验方法
1.2.1 动物培养 SPF 级实验用裸鼠75 只(购自北京维通利华实验动物有限公司),雌雄各半,6~8 周龄,体质量18~22 g,平均体质量(20.8± 1.5)g。所有裸鼠均饲养于SPF 级屏障系统内。饲养条件:温度22~26 ℃,相对湿度40%~60%,所用饲料、饮用水和垫料等均经严格消毒灭菌并定期进行更换。
1.2.2 细胞培养 人肝癌细胞株Huh7 购自中国科学院(上海),培养于含10% 胎牛血清的DMEM培养基中(含1% 青链霉素),37 ℃,5% CO2恒温孵育箱中培养并传代。待细胞增长至107时终止,PBS 润洗,胰酶消化,经台盼蓝染色并显微镜下计数活细胞>90%,收集至1.5 mL EP 管中。
1.2.3 MTT 法检测细胞活力 为了检测不同浓度氯喹对细胞活力的影响,将生长至对数期的Huh7肝癌细胞以密度为5×104/mL 接种于96 孔板, 0.2 mL/孔,预培养24 h,分为3 组,每组各3 孔,使其氯喹最终浓度分别为0、25、50 µmol/L,分别于培养6、12、24 h 时加入20 µL/ 孔MTT (5 mg/mL),弃去培养基,加入150 µL/孔DMSO,震荡混匀,用酶标仪检测各孔细胞在570 nm 波长处的吸光度(absorbance,A)值,计算细胞存活率并绘制浓度- 存活曲线。
1.2.4 Huh7 皮下移植瘤模型的建立与分组 将生长指数其的Huh7 细胞调整至2.0×108/mL,分别取0.1 mL 细胞悬液接种于75 只裸鼠右前肢腋部皮下,6 d 后裸鼠皮下即可长出瘤块。将75 只荷瘤裸鼠随机分为对照组、氯喹低剂量及高剂量组,每组各25 只。氯喹处理组裸鼠分别于建模后第7 天经腹腔注射氯喹(Selleck 公司)25、50 mg/(kg·d),对照组则注射等体积的生理盐水,连续处理30 d并密切观察裸鼠的存活状态。30 d 后所有裸鼠腹腔注射0.8% 戊巴比妥(60 mg/kg),待裸鼠失去意识后处死,收集肿瘤标本并备用。测量各组肿瘤体积,采用游标卡尺测量肿瘤长径(a)、短径(b),肿瘤体积=(ab2)/2。
1.2.5 免疫组化 石蜡组织标本包埋后连续切片,固定于玻片上,50 ℃烘箱中烘1 h 后,二甲苯、100% 乙醇、95% 乙醇、80% 乙醇及75% 乙醇依次进行水化,蒸馏水洗涤3 次,然后置于柠檬酸钠溶液中加热2 次,每次8 min,PBS 洗涤3 次,3%H2O2溶液中浸10 min,PBS 洗涤3 次后,滴加LC3 和P62 抗体稀释液,4 ℃孵育过夜。PBST洗涤3 次后用羊抗兔二抗室温孵育1 h,PBST 洗涤3 次,DAB 显色(中杉金桥),苏木精复染,0.1%HCl 分化,蓝化,梯度酒精脱水干燥,二甲苯透明,中性树胶封固。免疫组化结果的评估由专业病理学人员采用进行判定,每张组织切片随机选取8 个视野,综合阳性细胞数及着色程度两项内容进行打分。其中着色程度:与背景一致为 0 分,浅黄色1 分,棕黄色2 分,深褐色3 分;阳性细胞数所占百分比:阴性为0 分,<25%为1 分,25%~50%为2 分,51%~75 为3 分,>75%为4 分。两项乘积为最终得分。
1.2.6 Western blot 检测 分别取各组裸鼠肿瘤组织100 g,加入300 µL 组织裂解液充分裂解 40 min 后,14000 r/min 离心10 min,取上清液加入5×SDS 上样缓冲液并于沸水浴中煮15 min,电泳及转膜结束后,5% 脱脂牛奶室温封闭1 h,分别用1:1000 稀释的LC3 及P62 抗体4 ℃孵育过夜,次日PBST 洗膜3 次,然后用1:5000 稀释的羊抗兔二抗室温孵育2 h 后PBST 洗膜3 次,ECL 显影。
1.3 统计学处理
采用SPSS 17.0统计学软件并进行统计分析,计量资料均采用平均数±标准差(±s)的形式表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t法;计数资料采用率(%)来表示,比较采用χ2检验;不同时间点各组细胞增殖分析采用重复测量方差分析。检验水准ɑ=0.05。
2 结 果
2.1 氯喹对Huh7 肝癌细胞增殖的影响
不同浓度氯喹(25、50 µmol/L)处理Huh7肝癌细胞,采用MTT法检测氯喹处理6、12、24 h时增殖抑制率。M TT法检测显示,3 组间差异有统计学意义(F组间=1912.094,P=0.000),且两两比较有统计学差异;时间差异有统计学意义 (F时间=29.297,P=0.000),时间与分组有交互作用(F交互=376.407,P=0.000),显示时间因素的作用随分组的不同而不同。3 组间两两比较:在0 h,3组差异无统计学意义(F=0.137,P=0.873),在6、12、24 h组间差异有统计学意义(F=238.906、1120.115、1906.623,P<0.001);且在同一时间点(6、12、24 h), 3组间两两比较有统计学意义(P<0.001)。时间两两比较:24 h与0、6、12 h比较差异均有统计学意义(P<0.001),12 h与6 h比较差异有统计学意义(P=0.021),6 h与0 h比较差异有统计学意义(P=0.028)。统计分析结果显示,与对照组 (0 µmol/L)比较,氯喹处理组细胞存活率均明显降低(均P<0.05),呈现出浓度、时间依赖性(图1)(表1)。
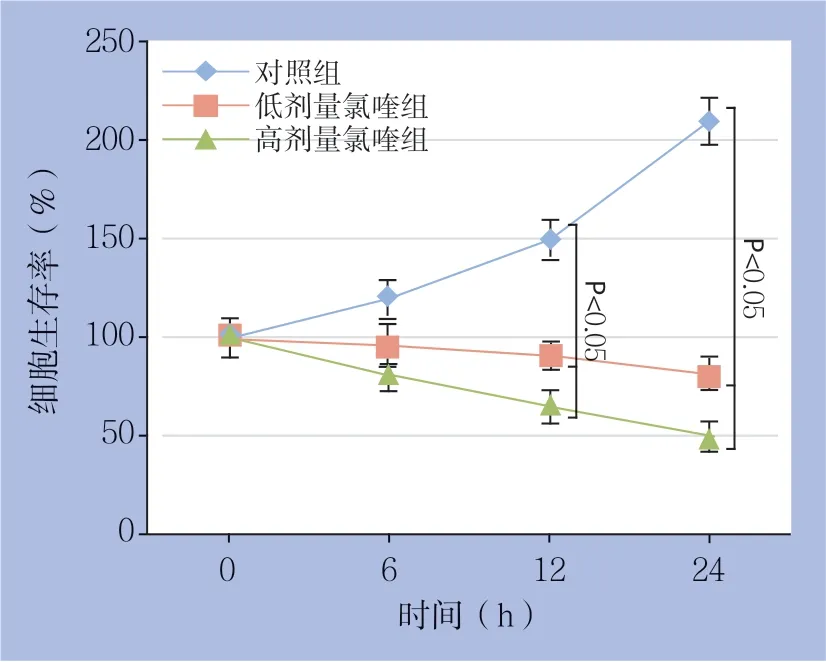
图1 各组Huh7 细胞的生长曲线Figure1 The growth curves of each groups of Huh7 cells
表1 各组Huh7 细胞增殖抑制率比较(±s,%)Table1 Comparison of the inhibitory rates among the three groups of Huh7 cells (±s,%)
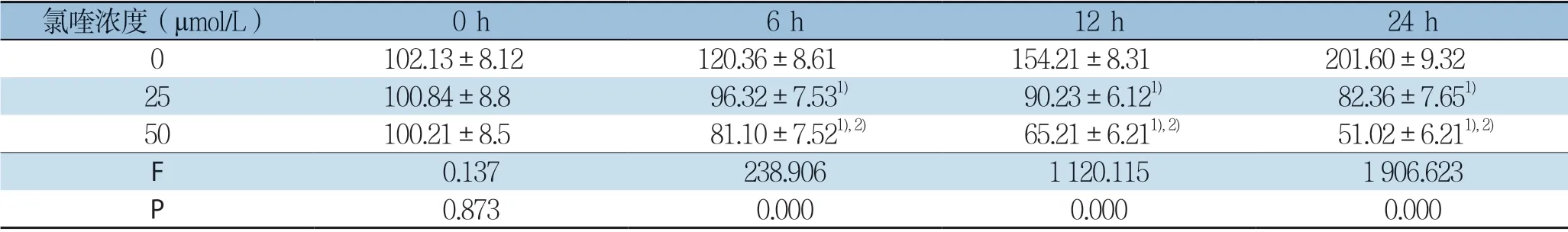
表1 各组Huh7 细胞增殖抑制率比较(±s,%)Table1 Comparison of the inhibitory rates among the three groups of Huh7 cells (±s,%)
注:1)与对照组比较,P<0.05;2)与低剂量氯喹组比较,P<0.05Note:1) P<0.05 vs.control group; 2) P<0.05 vs.low-dose chloroquine group
氯喹浓度(µmol/L) 0 h 6 h 12 h 24 h 0102.13±8.12120.36±8.61154.21±8.31201.60±9.3225100.84±8.896.32±7.531) 90.23±6.121) 82.36±7.651)50100.21±8.581.10±7.521),2) 65.21±6.211),2) 51.02±6.211),2)F 0.137238.9061120.1151906.623 P 0.8730.0000.0000.000
2.2 氯喹对裸鼠肝癌移植瘤生长的影响
通过皮下注射Huh7肝癌细胞建立肝癌裸鼠模型,并用不同剂量氯喹进行干预30 d,观察各组肿瘤生长情况。结果显示,3组肿瘤体积差异有统计学意义(F=1120.296,P=0.000)。与对照组比较,低剂量氯喹组和高剂量氯喹组裸鼠肝癌生长速度明显减缓(P=0.034,P=0.004)。与低剂量氯喹组比较,高剂量氯喹组裸鼠肝癌生长速度明显下降(P=0.015)。每个时间点上3组肿瘤体积比较:在0 、3、6 d时间点上差异无统计学差异(P>0.05);9、12、15、18、21、24、27、30 d时间点是差异均有统计学意义(均P<0.05)(图2)(表2)。
2.3 免疫组化检测各组裸鼠移植瘤组织LC3、p62 水平
各组裸鼠LC3、p62免疫组化检测及其定量分析结果显示,与对照组相比,低剂量氯喹组、高剂量氯喹组LC3、p62水平升高,差异均有统计学意义(均P<0.05);与低剂量氯喹组相比,高剂量氯喹组LC3、p62水平升高,差异均有统计学意义(均P<0.05)(图3)(表2)。
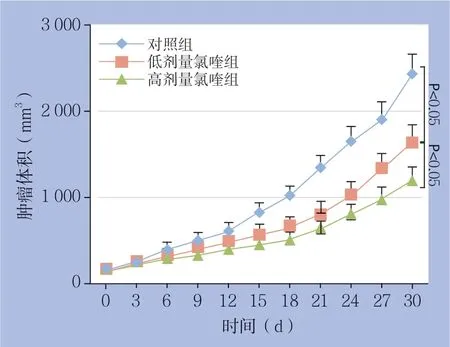
图2 各组裸鼠移植瘤的生长曲线Figure2 The growth curves if the xenograft in each group of nude mice
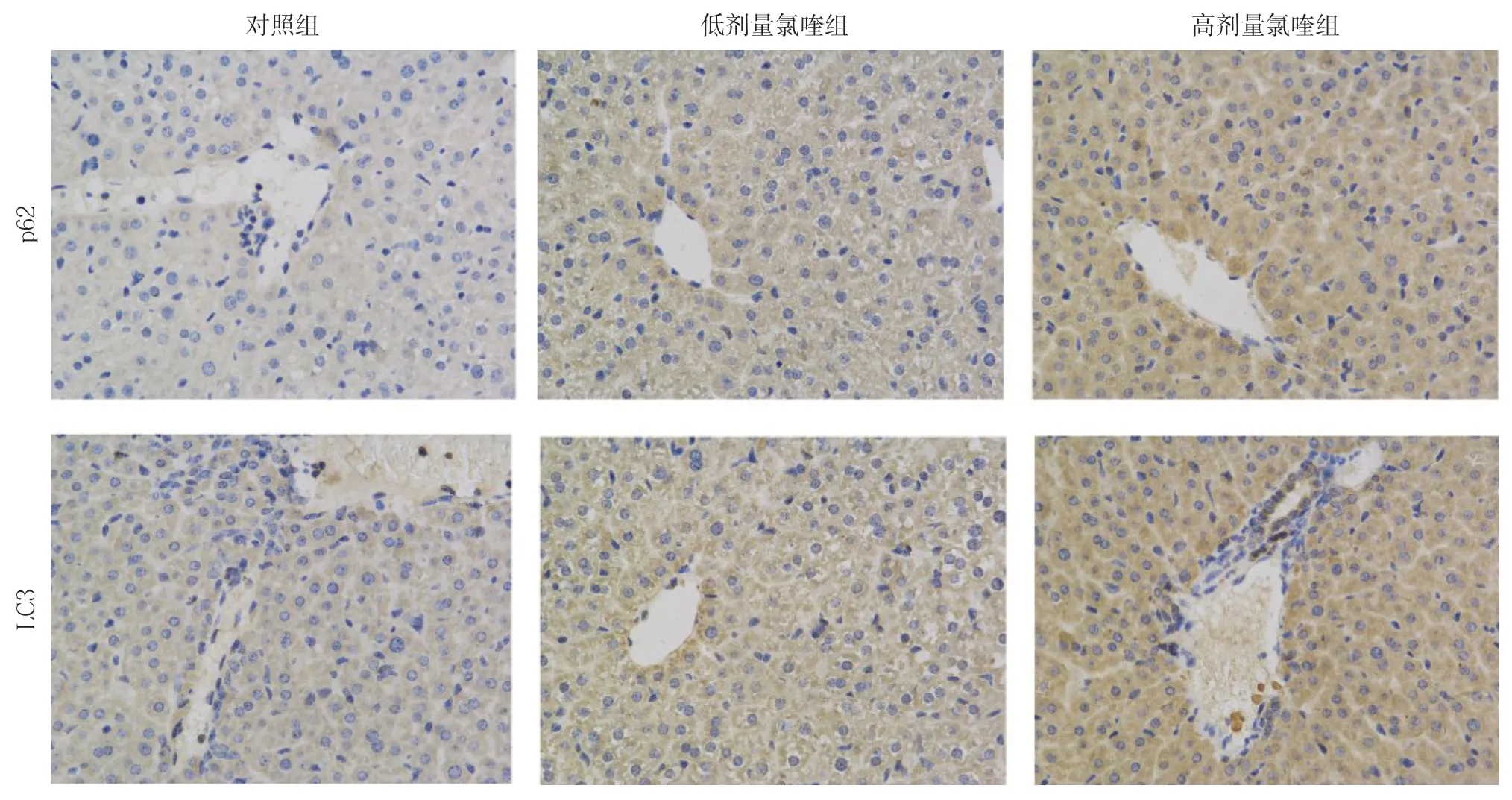
图3 免疫组化检测各组裸鼠移植瘤组织中LC3、p62 的表达(×200)Figure3 Immunohistochemical staining for LC3 and p62 expressions in the xenografts in in each group of nude mice (×200)
表2 各组裸鼠肝癌组织中LC3、p62 表达评分比较(±s)Table2 Comparison of the scores of LC3 and p62 expressions among the three groups (±s)
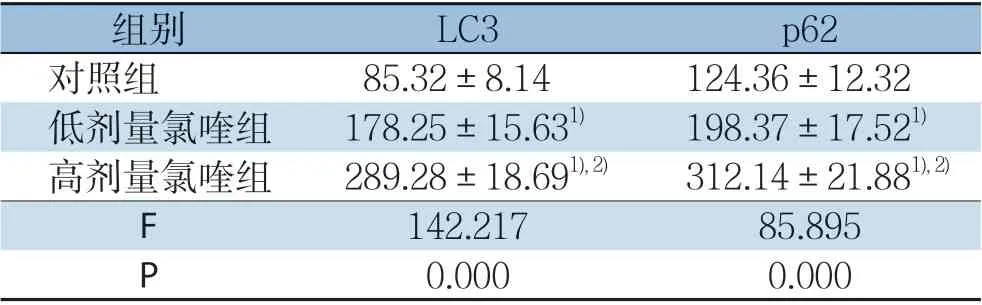
表2 各组裸鼠肝癌组织中LC3、p62 表达评分比较(±s)Table2 Comparison of the scores of LC3 and p62 expressions among the three groups (±s)
注:1)与对照组比较,P<0.05;2)与低剂量氯喹组比较,P<0.05Note:1) P<0.05 vs.control group; 2) P<0.05 vs.low-dose chloroquine group
组别 LC3 p62对照组 85.32±8.14124.36±12.32低剂量氯喹组 178.25±15.631) 198.37±17.521)高剂量氯喹组 289.28±18.691),2) 312.14±21.881),2)F 142.21785.895 P 0.0000.000
2.4 Western blot 检测各组裸鼠移植瘤组织LC3-II/LC3-I、p62 水平
Western blot检测结果显示,与对照组比较,低剂量氯喹组、高剂量氯喹组LC3-II/LC3-I、p62水平升高,差异均有统计学意义(P<0.05);与低剂量氯喹组比较,高剂量氯喹组LC3-II/LC3-I、p62水平升高,差异均有统计学意义(均P<0.05)(图4)(表3)。
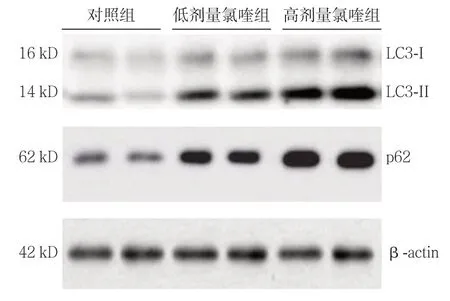
图4 Western blot 检测LC3-II/LC3-I、p62 的表达Figure4 The expressions of LC3-II/LC3-I and p62 determined by Western blot
表3 各组裸鼠移植瘤组织中LC3-II/LC3-I、p62 表达量比较 (±s)Table3 Comparison of the expression levels of LC3-II/LC3-I and p62 in the xenografts among the three groups of nude mice (±s)
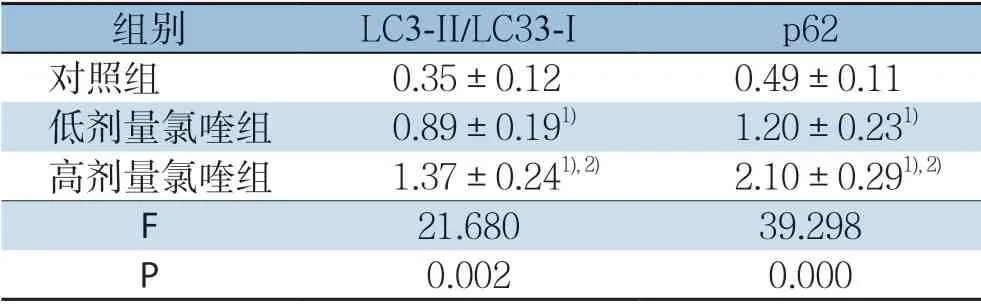
表3 各组裸鼠移植瘤组织中LC3-II/LC3-I、p62 表达量比较 (±s)Table3 Comparison of the expression levels of LC3-II/LC3-I and p62 in the xenografts among the three groups of nude mice (±s)
注:1)与对照组比较,P<0.05;2)与低剂量氯喹组比较,P<0.05Note:1) P<0.05 vs.control group; 2) P<0.05 vs.low-dose chloroquine group
组别 LC3-II/LC33-I p62对照组 0.35±0.120.49±0.11低剂量氯喹组 0.89±0.191) 1.20±0.231)高剂量氯喹组 1.37±0.241),2) 2.10±0.291),2)F 21.68039.298 P 0.0020.000
3 讨 论
3.1 氯喹对肝癌细胞生长的影响
氯喹是含有4-氨基喹啉环结构人工合成化合物,因其具有较高的趋溶酶体特性而在溶酶体内高度聚集,抑制某些酶的活性,导致细胞信号传导发生改变。氯喹不但在疟疾、免疫性类风湿疾病方面具有较好治疗效果,而且在肿瘤治疗过程中也涉及异常自噬。Hu等[8]认为氯喹可以通过以阻滞肝癌细胞周期以及DNA损坏以促进细胞凋亡,从而影响肝癌组织生长。朱文斌等[9]研究证实氯喹可以通过抑制细胞周期蛋白(cyclin E1)、细胞周期蛋白依赖性激酶(CDK2)水平,增加细胞周期抑制蛋白P21、P27含量,阻滞细胞周期于G0/G1期,从而抑制肺癌细胞A549生长。本研究结果显示氯喹可以降低肝癌细胞Huh7存活率,同时裸鼠移植瘤实验结果也显示氯喹可以降低移植瘤体积,抑制移植瘤生长,此结果与前人研究相似,氯喹可能是通过影响肝癌组织细周期、凋亡来抑制肿瘤组织生长。Lin等[10]发现氯喹可以通过靶向基底自噬与增强细胞凋亡来抑制膀胱癌细胞生长。Liu等[11]显示氯喹可以阻断自噬、诱导线粒体介导的细胞凋亡来抑制肺癌细胞A549生长。Gao等[12]发现氯喹可以抑制TACE诱导的细胞自噬,失去对凋亡的抗性,促使细胞凋亡,从而有助于抑制肿瘤生长。由此表明氯喹抑制肝癌组织细胞生长是通过阻滞细胞周期于G0/G1期,影响细胞增殖,从而组织生长;同时还存在另一种猜测:氯喹可能会通过影响肝癌细胞自噬来调节肝癌组织生长。
3.2 氯喹对肝癌细胞自噬的影响
自噬是真核细胞内由内质网脱落的膜结构包裹胞内需降解的细胞器、蛋白质等形成自吞噬体,后与溶酶体融合形成自噬溶酶体,并降解其内容物,以维持细胞自身生长代谢和细胞成分更新,参与细胞分化,生长调控,组织修复,抗原呈递以及外界应激等多种生理过程[13-14]。细胞处于饥饿状态时,可通过自噬使胞内营养成分循环利用,以维持细胞活力[15]。癌症晚期时,肿瘤细胞增殖加快,自噬有助于肿瘤细胞在药物毒性、胞内营养供给压力下细胞活力的维持[16]。因此,抑制或阻断自噬会提高肿瘤治疗效果。
自噬溶酶体功能形式需要活性水解酶参与,氯喹是溶酶体靶向药物,氯喹可通过抑制多种蛋白酶活性,从而抑制蛋白水解、糖脂代谢等多种代谢途径,导致自噬体内物质无法通过溶酶体降解,自噬性囊泡大量累积,溶酶体膜通透性改变一起肿胀、破裂,最终导致细胞死亡[17-18]。已有研究[19-21]表明,氯喹可促进食管癌、胰腺癌、结直肠癌、非小细胞肺癌、乳腺癌等肿瘤细胞死亡。本研究结果显示,氯喹处理后裸鼠肝癌组织中自噬相关蛋白LC3-II和P62蛋白的含量显著升高。自噬体形成涉及多种蛋白参与,LC3是判断细胞自噬活性标志物之一。LC3包括LC3-І和LC3-II两种形式,LC3-І位于胞浆中,LC3-І通过羧基与脂质共价连接转化为LC3-II,聚集于自噬体膜[22-23]。自噬体与溶酶体结合时,LC3-І解离循环至胞质中,LC3-II依旧位于自噬溶酶体内膜上,LC3-II含量与自噬膜囊泡数量呈正比[24-25]。P62可经自噬过程被选择性降解,是细胞自体吞噬特异性底物[26]。自噬被抑制,P62上游表达增强或下游降解被阻断均可导致P62大量积聚,因此,P62水平可作为自噬流的检测指标[27-28]。本研究与前人研究结果相似,由此表明,氯喹可能抑制了自噬溶酶体形成和自噬小体在溶酶体的降解,导致自噬体累积。肿瘤细胞处于激活状态,其通过自噬降解有害物质和代谢产物,保证自身存活。氯喹抑制自噬后,肿瘤细胞可能由于自噬能力降低导致有害物质大量积累,导致无法适应肿瘤微环境,最终使其生长受到抑制。此外,已有研究[29-31]证明氯喹联合其他化疗药物使用能显著增强肿瘤细胞对化疗药物的敏感性,表明氯喹可以抑制肝癌组织细胞自噬,从而抑制肿瘤细胞生长。
综上所述,氯喹可以通过调节肝癌中LC3、P62水平,抑制肝癌组织细胞自噬,从而抑制组织细胞增长。但本研究所得结论只是基于体外细胞实验与体内裸鼠动物实验多得,临床中是否具有相同趋势以及氯喹临床应用剂量还需要进一步探索与研究。

