基于多参数磁共振成像的影像组学列线图在识别脑白质高信号半暗带中的应用研究
浙江省人民医院 放射科,浙江 杭州 310014
引言
脑白质高信号(White Matter Hyperintensity,WMH)指MRI的T2WI或者FLAIR图像上侧脑室旁或半卵圆中心弥漫性高信号区域,是脑小血管病的主要影像指标[1]。已有研究显示WMH与认知衰退、抑郁、阿尔茨海默病以及中风有关[2],然而现有的WMH临床治疗的效果尚不确定[3-4],因此预防或减缓其进一步进展尤为重要。
脑白质高信号半暗带(White Matter Hyperintensities Penumbra,WMHp)指在常规影像上表现正常,但血流灌注和微观结构已发生改变的区域,是WMH的早期阶段[5],如果能早期从常规的MR序列中发现异常,就能尽快的进行干预治疗,防止WMH的进展。
影像组学是放射学领域的一个新兴学科,它利用先进的图像处理技术从影像图像中提取大量定量特征[6],通过高通量分析和特征选择来构建一个完整的生物标记进行疾病预测和分析[7-8]。已有研究通过图像定量特征对正常脑白质微观结构改变进行了分析[9],但是否可以通过分析WMH周边视觉正常区域的微观结构改变以明确WMHp的存在值得商讨,因此本研究开发了基于多参数磁共振成像的影像组学列线图用于识别WMHp并使用外部数据进行验证,旨在探讨其临床可行性。
1 资料和方法
1.1 一般资料
回顾性分析2012年至2017年的我院PACS系统中在同一台MR机器上有两次标准化头颅影像学检查的患者,且两次检查间隔时间>1年。白质高信号患者纳入标准如下:① 两次磁共振检查确定为白质高信号进展型;② 没有脑部其他病史;③ 每名患者的磁共振图像质量良好。在这些患者中,有22名患者被排除,原因如下:① 两次磁共振检查白质高信号无进展;② 合并有其他脑部疾病;③ 图像质量不佳。最终,本次研究共纳入了57例白质高信号进展患者,并选取年龄相匹配的相同数量健康查体患者作为对照。2012年4月至2016年12月归为训练组(n=80),2017年1月至2017年11月归为验证组(n=34)。
1.2 MRI图像采集
所有入选患者均用3.0T MR(Discovery MR 750,GE Healthcare,Waukesha,美国)进行扫描。包括轴向T2 PROPELLER序列及FLAIR序列,采集参数如下:T2 PROPELLER:切片厚度:5 mm;间隔:1.5 mm;TR/TE:3500~5000 ms/115 ms;FOV:22 cm×22 cm;像素矩阵:448×448;ETL:32;带宽:62.5。FLAIR:切片厚度:5 mm;间隔:1.5 mm;TR/TE:9000 ms/120 ms;FOV:22 cm×22 cm;像素矩阵:288×192;ETL:18;带宽:50。
1.3 影像组学特征选择和影像组学标签构建
本研究对脑白质高信号患者的前后两次检查进行对比,将在后一次检查中进展为新白质但第一次表现正常的区域定义为脑白质半暗带,使用ITK-SNAP软件基于白质高信号患者的T2WI和FLAIR图像选择半暗带勾画感兴趣区域(Region of Interest,ROI),并在健康查体者的图像上选择相同区域进行ROI划分,具体选择ROI符合以下标准:① 每个患者只选择一个最大的ROI,且大于100像素;② 脑白质高信号患者与健康者的ROI形态和大小相同;③ 健康人的ROI位置选择与脑白质高信号患者半暗带区ROI位置相似;④ 半暗带区ROI位置只选择与脑白质高信号灶相邻的区域。之后将分割的ROI文件导入AK软件并选择直方图特征、形态学特征、哈拉利克特征、灰度共生矩阵特征和游程矩阵特征五大类纹理参数进行特征提取。对提取的纹理特征进行预处理后通过训练组使用最小绝对收缩与选择算子算法(Least Absolute Shrinkage and Selection Operator,LASSO)对提取特征选择最有益特征并构建影像组学标签,使用计算公式获得每个受检者标签分数值以反映产生半暗带风险。标签在训练组和验证组的预测准确性使用受试者工作特性(Receiver Operating Characteristic,ROC)曲线评估。
1.4 脑白质高信号半暗带预测模型的构建和评估
在训练组中对每个潜在预测变量包括性别、年龄、高血压、血脂、抽烟、饮酒、心脏病、糖尿病和影像组学标签分数值进行单因素Logistic回归分析,筛选出半暗带的独立预测因子。之后通过多变量Logistic回归构建预测模型并制作影像组学列线图。列线图效能由验证组进行验证,并使用Hosmer-Lemeshow检验分析拟合度,ROC曲线评判列线图的诊断准确性。根据列线图计算每个患者半暗带预测值并分为高风险组和低风险组,通过分析不同风险组中实际WMHp病例,确定其临床效果。
1.5 特征提取一致性分析
使用组内和组间相关系数(Intraclass Correlation Coefficient,ICC)进行特征提取一致性评估。选择30例随机图像分别由两位放射科医师独立进行图像分割。组内ICC值由放射科医师A(具有10年脑部MRI经验)两次提取计算,组间ICC值由放射科医师A首次提取和放射科医师B(具有15年脑部MRI经验)提取计算。当ICC大于0.75时被认为是一致好,剩余的图像分割由放射科医师A独立执行。
1.6 统计学分析
统计分析采用SPSS 17.0和R软件进行。计数数据以百分数表示,测量数据以(±s)表示。采用Kolmogorov Smirnov检验对定量资料进行正态性检验。正态分布的数据用(±s)表示,非正态分布的计量资料用中位数(上、下四分位数)表示,计数资料以频数表示。计数资料采用χ2检验,计量资料采用独立样本t检验。使用单因素logist回归选择白质半暗带的独立预测因子,多因素Logist回归构建预测模型。LASSO算法使用R软件中的“glmmet”软件包进行,另外使用“rms”软件包进行列线图构建。
2 结果
2.1 患者的临床资料比较
性别、年龄、高血压、血脂、抽烟、喝酒、心脏病和糖尿病在训练组和验证组之间无统计学差异(P<0.05),见表1。在训练组和验证组中,WMHp患者与正常健康者之间糖尿病和影像组学标签均存在统计学差异(P<0.05),见表2。
2.2 影像组学特征提取的一致性检验
基于两次测量的医师A计算的组内ICC值为0.824~0.951。第一次测量的医师A和医师B之间的组间ICC值一致性为0.736~0.904,显示了特征提取在组内和组间较高的一致性。

表1 训练组和测试组临床因素比较
2.3 影像组学标签的建立和准确性评判
使用AK软件从T2WI和FLAIR图像中共提取了656个纹理特征,特征提取、优化及选择流程图如图1所示。使用LASSO算法从T2WI和FLAIR中分别筛选出3个和7个最有价值的图像特征构建影像组学标签,包含灰度共生矩阵特征3个和游程矩阵7个,标签诊断准确性在训练组和验证组中分别为0.893和0.834,特异性为78.8%和78.3%,敏感性为85.2%和77.8%。通过LASSO模型构建影像组学标签并使用线性公式计算每个患者的影像组学标签分数值以反映WMHp的风险,公式如下:



图1 特征降维流程图
2.4 影像组学列线图的构建和验证
单因素Logistic回归分析显示糖尿病和影像组学标签是预测WMHp的独立预测因子,基于独立预测因子通过多因素logistic回归构建预测模型并制作模型列线图,见表3和图2。列线图预测WMHp的准确率分别为0.881和0.862,见图3。Hosmer-Lemeshow 检验在训练组和验证组间均无统计学差异(P>0.05),表明没有偏离拟合。基于所有患者使用ROC曲线评估列线图、影像组学标签和糖尿病的准确性,三者的AUC分别为0.829、0.819和0.640,见图4。根据列线图得出每名患者的风险系数后,根据训练组中最佳诊断截值(cut-off:0.642),将患者分为高风险组和低风险组,高风险组与低风险组中的WMHp病例数无统计学差异(P>0.05)。
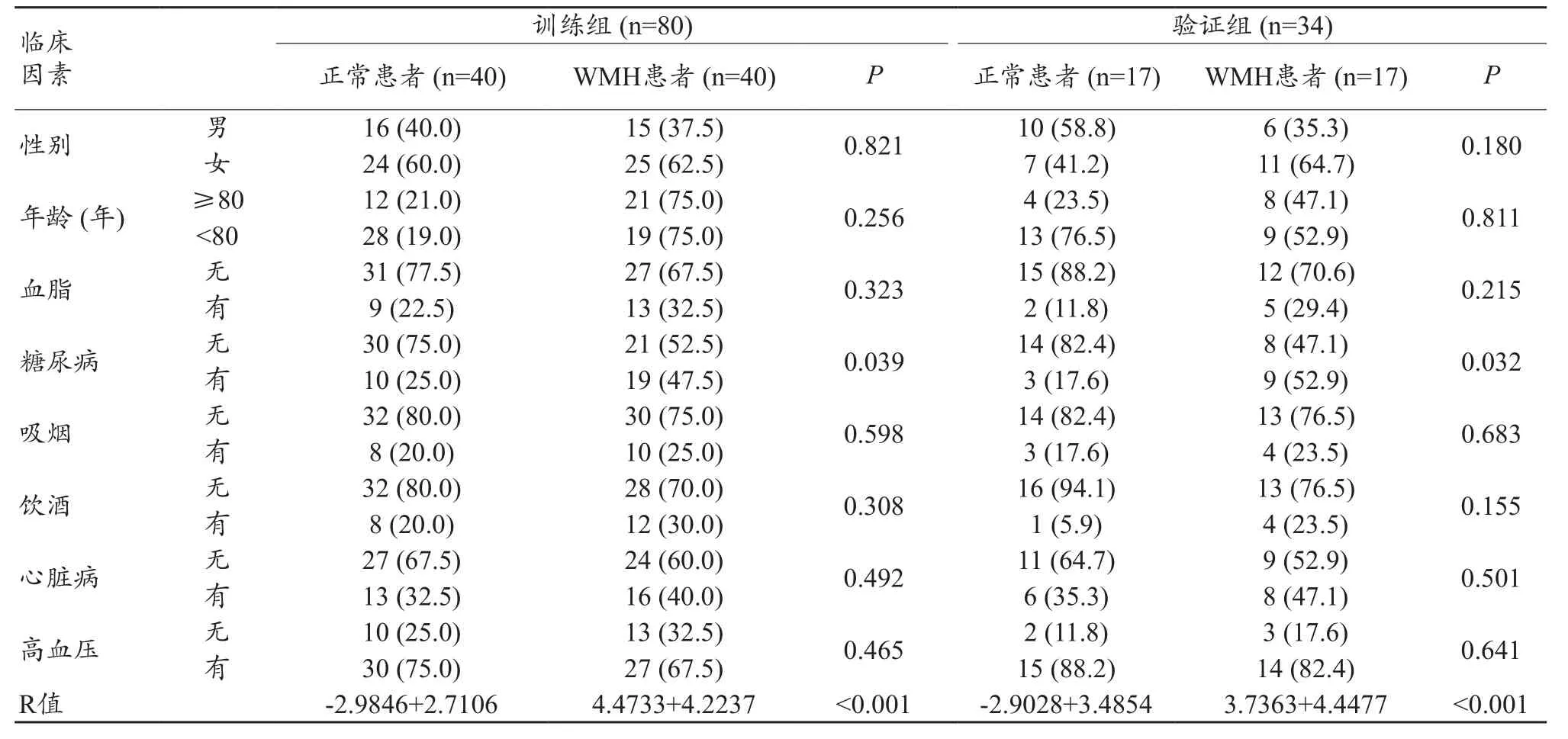
表2 训练组和测试组中白质高信号患者与健康体检者临床因素比较 [n (%)]

表3 预测白质高信号进展区的Logistic回归分析

图2 预测白质高信号半暗带的影像组学列线图

图3 影像组学列线图的诊断效能图

图4 构建列线图的预测因子及列线图的全样品诊断效能图
3 讨论
本研究使用磁共振多序列提取特征构建影像组学列线图,结果显示可以很好识别WMHp,同时通过列线图区分的高风险组具有半暗带的风险性显著增加,验证了影像组学模型的临床效能。
在衰老中,WMH通常定义为脑白质不可逆的损伤,而现阶段的研究已经将WMHp的概念引入了WMH中,与其他健康的白质相比,WMHp白质随着时间的推移更容易转换为WMH,但值的注意的是在向WMH转换过程中可以通过治疗血管因素来逆转WMHp的状态[10-11],因此早期识别WMHp尤其重要。而本次研究显示使用影像组学模型可以很好的进行WMHp识别,影像组学中的标签因子主要由T2WI和FLAIR序列提取的纹理构成,并且只有共生矩阵和游程矩阵两大类,提示只有高阶纹理才能识别WMHp的存在。另外在提取的纹理中GLCMEntropy_ALLDirection_offset1均存在于两个序列中,而共生矩阵中的熵值反映了图像灰度分布不均匀程度和纹理粗细度,这表明WMHp的存在导致图像的复杂程度,这些图像复杂性变化可能是一些脑白质高信号病理改变的结果,包括水含量的增加和髓磷脂含量的降低,从而导致MR信号强度不太均匀[12-13],这也提示共生矩阵中的熵值可以作为预测早期的脑白质高信号细微病理生理变化的标记物,换句话说,在WMHp状态可以预测后续成像中新的WMH形成。此外本次研究也发现游程矩阵参数在模型中占有较大比例,它主要是反映了纹理的粗糙程度和方向性,具有方向性的纹理在某个角度会具有较长的游程[14],而正常白质纤维束排列规则且定向,当髓鞘损伤后,组织失去规则结构,从而变厚变模糊[15],这可能是造成游程矩阵参数较多的原因。
脑白质高信号变的MRI纹理分析多集中于多发性硬化患者,而某些MRI序列类型(包括DTI,FLAIR和磁化转移成像)在WMHs中的信号特性也显示出异质性,反映了病理基质的异质性[16-17]。本研究的结果也证实了以上研究结果,结合T2WI和FLAIR序列的脑白质高信号变的几种纹理特征可很好的鉴别WMHp。在一般老年人群中,基于磁共振横断面研究显示白质结构与认知障碍有关,如阿尔茨海默病[18],以前的MRI纹理分析研究表明,纹理分析可能对于鉴别WMHp不太敏感[19]。然而,他们的研究均使用的是单一的序列进行纹理分析,这有可能导致结果的不稳定性,而在本次研究中,我们对T2WI和FLAIR这两个最容易识别WMH的序列并进行了联合分析,这可以极大的提高研究结果的稳定性,据我们所知,这是第一个使用多序列纵向研究影像组学识别WMHp的研究,而且列线图的制作可以进行量化分析,通过量化半暗带区几率有可能反应白质的损伤程度,从而进一步推断WMH的严重程度。
本次研究还有一定局限性,首先样本量不够大,需要进一步扩大样本量来验证模型的可靠性。其次两个时间图像的精确匹配会有一定偏差,即使两幅图像都来自标准化扫描。但是,本研究使用的是临床上常用的5 mm厚层图像,并且由于体积效应的影响,匹配后效果可能并不会影响最终结果。最后本次研究纳入的WMHp区只是在脑白质高信号的周围带,也就是说无脑白质高信号区出现的WMHp未纳入本次的研究中,这可能会造成结果一定偏差。
综上所述,本研究首次使用影像组学构建了识别WMHp模型并制作了其列线图,它不仅能快捷方便的进行WMHp识别,而且有助于量化WMHp的风险性,从而指导后续更进一步临床诊疗决策。

