宿主因子ZFAT 影响抗流感病毒固有免疫因子MxA 表达的研究
黄海翔,宋洋铭,施建忠,赵东明,杨孝朴,陈化兰*
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点开放实验室,黑龙江 哈尔滨 150069)
世卫组织截止2020 年1 月20 日的实验室监测数据显示,H5N1 高致病性禽流感病毒(Highlypathogenic avian influenza,HPAI)的累计致死率高达52.85%[1],而流感病毒在水禽和哺乳动物之间的跨物种传播能力则是这一疾病周期性在人群中爆发的原因之一,长期的病原-宿主共进化使得不同物种体内表达的MxA 均具有广谱抑制RNA 病毒复制的能力,而哺乳动物体内表达的黏病毒抵抗蛋白(Myxo⁃virus resistance protein A,MxA)则对H5N1 高致病性禽流感病毒(HPAIV)有较高的敏感性[2-3]。流感病毒的感染过程中通常存在病毒蛋白与宿主因子相互结合并拮抗或增强特定生物学功能的情况,例如流感病毒NS1 与宿主DOK6 蛋白的相互作用使得NS1 蛋白抑制干扰素表达的功能受到拮抗[4-5],因而这一过程中流感病毒密切参与并影响了宿主的蛋白互作网络[6-7]。参照生物学通用互作库数据集(BioGrid,https://thebiogrid.org/),本实验利用组学映射数据筛选的方法取得了流感病毒感染进程相关的蛋白-蛋白互作(PPI)结果,通过富集运算筛选了互作组因子以后重点分析了包含抗流感免疫因子的互作网络,发现包含AT 钩结构域锌指蛋白(Zinc-finger and AT hook domain containing protein,ZFAT)可能调控MxA 表达活性的信息。ZFAT 最早由Shirasawa[8]等人在甲状腺自身免疫病模型中鉴定并发表,因其在造血干细胞分化调控和外周血淋巴细胞稳态机制中的基础性作用而受到关注[9],尽管目前未有详细阐明ZFAT 参与抗流感免疫机制的报道,但是ZFAT 与其他多个抗流感因子在PPI 网络中的密切联系使得ZFAT 极有可能参与了抗流感免疫进程,本实验拟利用siRNA 干扰技术下调ZFAT 蛋白表达,检测ZFAT 沉默对流感病毒复制的影响,并在流感病毒感染条件下检测ZFAT 沉默对MxA 和干扰素等其他固有免疫因子表达活性的影响。
1 材料与方法
1.1 主要实验材料总RNA 提取试剂盒(DP419)购自天根生化科技(北京)有限公司;反转录试剂HiS⁃cript III RT SuperMix for qPCR(+g DNA wiper)(R323)及qPCR 试剂ChamQ Universal SYBR qPCR Master Mix(Q711)购自南京诺唯赞生物科技有限公司;Primestar DNA 聚合酶(R045A)购自TaKaRa 公司;转染试剂Li⁃pofectamine LTX and Plus Reagent(15338100)、 Lipofectamine RNAiMAX Transfection Reagent(13778)、Ham's-F12-K、Opti-MEM 细胞培养基以及胎牛血清均购自赛默飞世尔科技公司;环乙酰亚胺(Cyclohexi⁃mide,CHX,GC17198)购自GlpBio 公司;siRNA 合成于上海吉玛制药技术有限公司;4×蛋白上样缓冲液(P1015)购自Solarbio;鼠抗ZFAT 单克隆抗体(sc-398058)购自圣克鲁斯生物技术有限公司,兔抗MxA(37849S)、GAPDH(2118)多抗以及DyLight 800 近红外荧光染料偶联二抗(5151,5257)购自CST公司。
1.2 细胞系、病毒以及鸡胚A549 以及HEK293T细胞系由本实验室保存;流感病毒A/Anhui/2/2005(AH05)(H5N1)由禽流感国家参考实验室鉴定及保存;10日龄SPF鸡胚由中国农业科学院哈尔滨兽医研究所实验动物中心提供
1.3 ZFAT 影响MxA 表达的生物信息学预测利用BioGrid 互作组学数据库获取ZFAT 和MxA 相关的一、二级映射网络,在Cytoscape 软件中制作图谱,将合并网络依据CytoHubba 插件计算得出的各节点degree值并分级排布,最后通过富集分析获取抗流感免疫的宿主因子名单,经融合后筛选MxA 相关互作链条并将包含ZFAT 及中间节点的最简网络选出,单独绘图以方便后续验证及分析。
1.4 qPCR 引物设计与合成依据GenBank 中人源ZFAT(57623)、MxA(4599)、IFNA1(3439)、IFNB1(3456)、IFNL1(282618)、IRF3(3661)、IRF7(3665)、IRF9(10379)mRNA 序列,利用Primer-BLAST 设计qPCR 引物(表1),引物由吉林库美生物技术有限公司合成。

表1 qPCR 引物Table 1 Primers for qPCR
1.5 ZFAT siRNA 的设计与筛选依据GenBank 人源ZFAT(57623)mRNA 序列设计3 条独立的siRNA(表2),每条siRNA 取20 pmol 加入50 μL Opti-MEM培养基中,混匀后加入1.5 μL RNA iMAX 试剂,滴状混匀,室温静置孵育15 min,悬浮干扰A549 细胞后37 ℃继续培养36 h。试验设scrambled siRNA 干扰后的A549细胞为对照,通过qPCR 和western blot 试验检测上述siRNA 干扰对ZFAT 的转录和翻译的抑制效果并选取最佳siRNA用于后续实验。

表2 siRNA 序列Table 2 siRNA sequence
收获经ZFAT siRNA 和scrambled siRNA 干扰的A549 细胞,按照总RNA 提取试剂盒说明提取RNA,测量样品浓度后每份样品取1 μg RNA 反转录,利用ChamQ Universal SYBR qPCR Master Mix 进 行qPCR 检测,选取表1 中ZFAT-qPCR-F/R 引物对按照表3 程序检测ZFAT 的转录活性,GAPDH-qPCR-F/R 引物对用于检测A549 细胞内参基因GAPDH 的转录活性,通过相对定量计算2-ΔΔCt值得到目的基因表达差异,利用GraphPadPrism 7进行统计学分析。
表3 qPCR 反应程序Table 3 qPCR program
收获经ZFAT siRNA 和scrambled siRNA 干扰的A549 细胞,制备western blot 检测样品,经电泳、转膜、5%脱脂乳封闭后,以稀释的鼠抗ZFAT 和GAP⁃DH 抗体(1∶1 000)4 ℃过夜孵育,次日经室温孵育近红外荧光染料偶联二抗(1∶500)1.5 h 后,western blot检测ZFAT和GAPDH 的条带亮度,采用ImageJ 软件进行相对灰度值分析。
1.6 流感病毒复制的滴定试验流感病毒原液经倍比稀释后以MOI 0.001 感染经ZFAT siRNA 和scram⁃bled siRNA 干扰的A549 细胞,37 ℃孵育1 h 后吸净上清并用PBS 洗涤细胞,加入1 mL Opti-MEM 培养基置于37 ℃孵育,24 hpi、48 hpi 分别收获培养基上清并接种于10日龄SPF鸡胚中测定EID50。
1.7 流感病毒同步感染试验与ZFAT 沉默后对MxA和干扰素等其他固有免疫因子表达活性的检测流感病毒以MOI 1 感染CHX 处理后的ZFAT siRNA 和scrambled siRNA 干扰A549 细胞,4 ℃孵育1 h 吸净上清并用PBS 洗涤细胞,加入1 mL Opti-MEM 培养基置于37 ℃孵育,分别于6 hpi、12 hpi收获细胞样品,将scrambled siRNA 干扰设为对照,选取表1 中除ZFATqPCR-F/R 以外的所有引物对,GAPDH-qPCR-F/R 用于检测细胞内参基因,参考1.5 所示方法,收获流感病毒感染前后的A549 细胞样品,利用表3 所示程序通过qPCR 检测抑制ZFAT 表达在流感病毒感染前后对MxA、 IFNA1、 IFNB1、 IFNL1、 IRF3、 IRF7、IRF9、JAK1 以及STAT1 转录活性的影响,同时参照1.5 所示western blot 方法,利用兔抗MxA 一抗检验下调ZFAT表达后对MxA翻译的影响。
2 结 果
2.1 生物信息学预测BioGrid 互作组学数据经融合和富集算法处理后,在Cytoscape 软件中利用Cyto⁃Hubba 插件将节点分级排列,选取以MxA 和ZFAT 为中心的一级和二级网络单独绘图(图1),图示中ZFAT 与MxA 处于同一个互作关系网,节点颜色表示与该节点蛋白存在直接互作的蛋白数量,红色越深则表示该节点参与的互作关系越复杂,其中热休克蛋白B1(HSPB1)及与之直接互作的干扰素刺激基因15(ISG15)、三联基序蛋白25(TRIM25)均有参与抗流感免疫的报道[10-12],因而该网络可以被简单划分为相对独立的两个部分,即以MxA 表达调节为核心功能的PPI 网络和以ZFAT 为中心的PPI 网络,其中HSPB1 是与ZFAT 存在直接互作的3 个蛋白之一,在连接两个网络的同时也体现出ZFAT 具有参与固有免疫进程的潜在可能,考虑到MxA 通常是受到固有免疫信号调控的下游效应分子,推测ZFAT 可能对MxA 的表达或功能具有调控作用。

图1 ZFAT 影响MxA 表达的生物信息学预测结果Fig. 1 Bioinformatical prediction for ZFAT influencing MxA expression
2.2 ZFAT siRNA-3 干扰后ZFAT 蛋白表达的检测结果ZFAT siRNA 和scrambled siRNA 干扰后的A549细胞经37 ℃孵育36 h 后收获细胞样品,将scrambled siRNA 设为条件对照,通过qPCR 及western blot 试验检测ZFAT siRNA-1、ZFAT siRNA-2、ZFAT siRNA-3在A549 细胞上的干扰效果。qPCR 结果显示,siRNA干扰A549细胞中ZFAT的2-ΔΔCt值相比对照细胞分别下调了2.97%、73.73%(p<0.01)和91.33%(p<0.01),其中ZFAT siRNA-3 干扰效果最佳(图2)。Western blot结果显示ZFAT 在ZFAT siRNA-3 干扰的A549 细胞中出现表达抑制现象,ZFAT 条带的相对灰度值相比对照下调了77.10%(图3),表明通过ZFAT siRNA-3干扰A549细胞可以有效降低ZFAT的转录和翻译活性。
图2 ZFAT 影响MxA 表达的生物信息学预测结果Fig. 2 Bioinformatical prediction for ZFAT influencing MxA expression
图3 ZFAT siRNA-3 干扰抑制ZFAT 蛋白表达Fig. 3 ZFAT protein expression inhibited by ZFAT siRNA-3 interference
2.3 下调ZFAT 蛋白表达对流感病毒复制影响结果将流感病毒以MOI 0.001 感染ZFAT siRNA-3和scrambled siRNA干扰后的A549细胞,24 hpi、48 hpi分别收获无血清培养基上清,通过接种鸡胚测定EID50。结果显示病毒滴度在24 hpi 和48 hpi 相比对照分别降低了2.61 倍(p<0.05)和8.25 倍(p<0.01)(图4),表明ZFAT沉默可以显著抑制流感病毒复制。
2.4 下调ZFAT 蛋白表达对MxA 的转录和翻译活性影响结果将ZFAT siRNA-3 和scrambleds iRNA 干扰后的A549 细胞进行流感病毒同步感染后6 hpi、12 hpi 分别收集细胞样品,将scrambled siRNA 干扰设为条件对照,通过qPCR和western blot 检测ZFAT表达抑制在流感病毒感染前后对MxA 转录和翻译的影响。qPCR 结果显示:在ZFAT 表达受到抑制的情况下,MxA 的2-ΔΔCt值 在 未 感 染、6 hpi 以 及12 hpi 的A549 细胞中相比对照分别上调了3.32 倍(p<0.01)、1.68 倍(p<0.01)以及1.42 倍(p<0.01)(图5),western blot 结果显示,ZFAT 沉默后的MxA 蛋白表达在未感染、6 hpi 以及12 hpi 的A549 细胞中相比对照出现上调,MxA 条带的相对灰度值分别上调了1.90 倍、1.15倍和1.19 倍(图6)。表明抑制ZFAT 的表达可以显著提升A549细胞中MxA的表达。
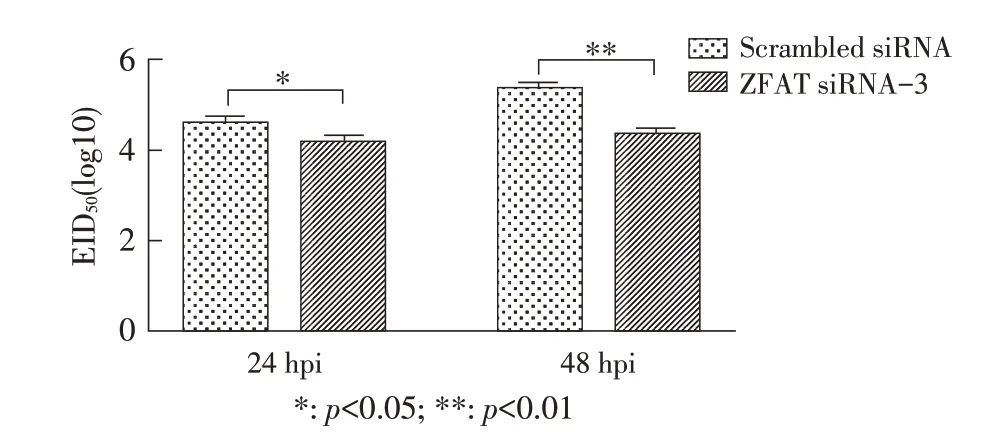
图4 ZFAT 表达沉默抑制流感病毒的复制Fig. 4 Silencing of ZFAT expression leads to the inhibition of influenza virus replication
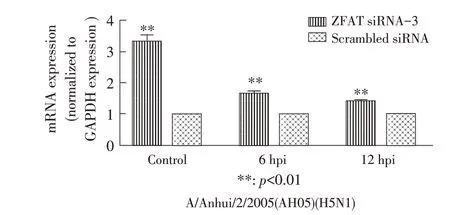
图5 ZFAT siRNA-3 干扰在流感病毒感染前后的A549 细胞中上调MxA 转录活性Fig. 5 MxA transcription activity in A549 cells upregulated by ZFAT siRNA-3 interference before or after influenza virus infection
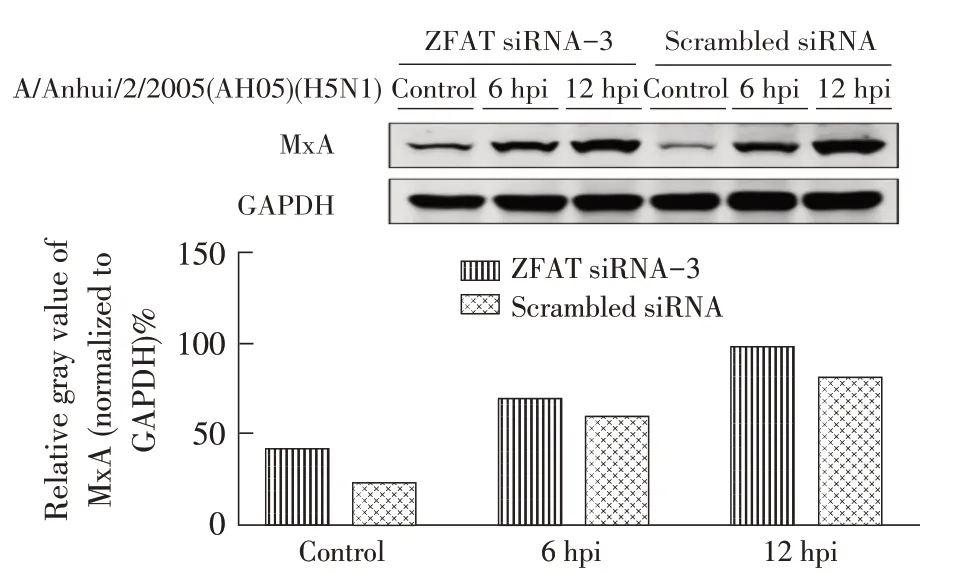
图6 ZFAT siRNA-3 干扰在流感病毒感染前后的A549 细胞中激活MxA 蛋白表达Fig. 6 MxA protein expression in A549 cells induced by ZFAT siRNA-3 before or after influenza virus infection
2.5 下调ZFAT 表达对干扰素及下游信号分子的转录活性影响结果将ZFAT siRNA-3 和scrambled siR⁃NA 干扰后的A549 细胞进行流感病毒同步感染后分别收集6 hpi、12 hpi的细胞样品,将scrambled siRNA 干扰设为对照,通过qPCR 检验ZFAT 的表达抑制在流感病毒感染前后对干扰素及下游信号因子转录活性的影响。qPCR 结果显示,ZFAT 沉默使得A549 细胞在6 hpi 相比对照表现出I 型、III 干型扰素以及下游信号分子IRF3、IRF7、IRF9转录活性的显著上调,其中IF⁃NA1、IFNB1 和IFNL1 的2-ΔΔCt值分别相比对照上升了2.02 倍、1.84 倍以及1.42 倍(p<0.05);IRF9、JAK1、STAT1 的2-ΔΔCt值在12 hpi 相比对照呈现显著抑制,分别降低了0.52 倍、0.29 倍以及0.37 倍(p<0.01)(图7)。表明下调ZFAT 蛋白表达可以广泛影响干扰素及其干扰素受体下游信号分子的转录活性。
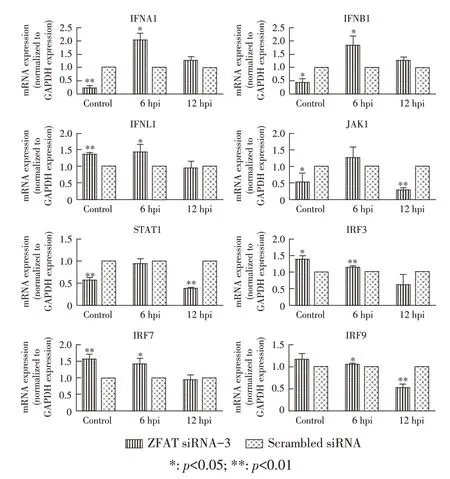
图7 对干扰素及其下游信号分子转录活性的qPCR 检测结果Fig. 7 Transcriptional activity of IFNs and downstream molecules detected by qPCR
3 讨 论
流感病毒在宿主体内的复制过程始终受到固有免疫系统的监控和抗病毒免疫机制的抑制[13-14],病原-宿主共进化使得病原不断获得有效的免疫逃逸机制来完成自身的复制[11]。相比于其他亚型的流感病毒,哺乳动物表达的MxA 对H5N1 禽流感病毒具有更强的特异性和敏感度,同时MxA 表达活性受到I 型、III 型干扰素的严密调控[15],MxA 通过抑制病毒vRNP 复合体的入核进程与聚合酶功能达到抑制病毒复制的作用[2]。宿主与病原长期斗争的历史使得双方不断发生适应性的进化,然而生物复杂的进化历史又使得任何适应性背后的分子机制无法成为绝对独立的单元,蛋白互作组学使得研究者有机会通过分子之间的共轭结合辨析一个复杂系统中特定因子可能发挥的作用[16]。
本实验通过蛋白互作组预测ZFAT 可能参与了固有免疫因子MxA 的表达调控,而验证实验表明下调ZFAT 蛋白表达可以显著提高MxA 的转录与翻译活性,并抑制H5N1 HPAIV 在A549 细胞中的复制,在细胞受到感染以前,下调ZFAT 表达促使A549 细胞提前进入“抵抗状态”,所以当感染发生时活跃的MxA 表达及其抗病毒效应将持续抑制病毒在宿主细胞内的复制;H5N1 HPAIV感染后,下调ZFAT表达使得细胞在显著提升干扰素及其下游信号分子转录活性的同时具有了更强的MxA表达活性与抗病毒能力。
MxA的表达激活是固有免疫信号通路末端效应的一部分,正常细胞受到病毒感染以后诱导表达大量的I 型和III 型干扰素,α 干扰素受体发出的下游信号使得大量信号转导和转录激活因子(STAT)以二聚体磷酸化形式入核并发挥转录调节功能,大幅提升干扰素应答元件(ISRE)中包括MxA 在内的所有效应分子的转录活性,以此使得细胞产生了强大的抗病毒能力[17-18],固有免疫应答产生的大量I 型和III 型干扰素是诱导MxA 表达的必要条件[15]。然而本研究中ZFAT 沉默却可以抑制未被流感病毒感染的A549 细胞中I 型干扰素的转录活性,效应分子MxA 与干扰素表达活性在ZFAT 表达下调后表现出的分化提示ZFAT 可能在正常生理条件下参与了两类固有免疫因子的转录调节,即在维持I 型干扰素转录水平的同时,抑制III 型干扰素以及MxA 等干扰素效应分子的转录活性,当病毒感染发生时,能够协助流感病毒逃避宿主免疫系统攻击的NS1 蛋白等病毒因子可能会与ZFAT 通过相互作用强化对MxA 等固有免疫效应分子的转录抑制作用;而在ZFAT 表达下调的情况下,这一免疫逃逸机制受到抑制并使得MxA 的表达高于对照细胞,进而影响流感病毒的复制,后续实验可以验证ZFAT 与H5N1 HPAIV 的相互作用并尝试找到ZFAT 锌指结构域的核酸结合位点,进一步证实ZFAT 在流感病毒感染进程中发挥的作用,相信随着固有免疫研究的深入,更多的真相将会被一步步揭示出来。

