牛疱疹病毒1型gG/TK双基因缺失株对豚鼠免疫保护效力的研究
杨 姣,王 琛,王安平,陈颖钰,李庆妮,胡长敏,陈 曦*,郭爱珍,3,4,5*
(1.华中农业大学动物医学院,湖北 武汉 430070;2.农业微生物国家重点实验室,湖北 武汉 430070;3.农业部反刍动物生物制品重点实验室,湖北 武汉 430070;4.湖北省动物疫苗工程技术研究中心,湖北 武汉 430070;5.动物生物药物教育部工程研究中心,湖北 武汉 430070)
牛传染性鼻气管炎(Infectious bovine rhinotrache⁃itis,IBR)是由IBR 病毒(IBRV)又称牛疱疹病毒Ⅰ型(Bovine herpes virus type 1,BoHV-1)引起的一种急性、接触性传染病,又称“红鼻病”或“坏死性鼻炎”[1]。BoHV-1 感染机体后,主要引起严重的呼吸道疾病、生殖道炎症和神经系统疾病等。此外,BoHV-1 可在三叉神经节或扁桃体潜伏,使感染牛终生带毒,各种应激因素可激活潜伏的病毒,引起牛发病并排毒,使本病很难消灭和根除。我国不同地区牛群IBR的感染十分普遍,IBR血清抗体阳性率与养殖优势区的分布一致,牧区及半牧区牛群的IBR 血清抗体阳性率最高可达97.83%,是严重影响我国养牛业健康发展的主要疾病之一[2]。
研制安全高效的疫苗是防控该病最有力的武器。世界动物卫生组织(OIE)规定,在对疫苗进行效力评价时,需使用2~3 月龄IBR 血清抗体阴性犊牛作为实验动物。然而,国内目前的现状很难选到抗体阴性的实验牛[3],因此建立实验室小动物模型评价IBR 疫苗免疫效力是非常必要的。目前,豚鼠已成为多种疫苗的免疫效力评价模型,如口蹄疫疫苗[4]和结核疫苗等[5]。Parreno 等也将豚鼠用于IBR 灭活疫苗的效力评价研究,结果显示豚鼠和牛体之间具有很强的相关性和一致性,可以作为替代动物模型[6],但缺失弱毒疫苗对豚鼠是否有效目前尚不清楚。
本实验室前期构建了BoHV-1 gG-/TK-株,牛体试验已证实该疫苗株毒力显著下降,能诱导体液免疫和细胞免疫反应,攻毒后可降低牛体排毒量和排毒时间,减轻临床症状[7]。为探索豚鼠成为缺失弱毒疫苗效力评价模型的可行性,本研究进行了Bo⁃HV-1 gG-/TK-株在豚鼠体内的安全性和有效性研究。
1 材料与方法
1.1 病毒、细胞和实验动物BoHV-1 野生型毒株(wt BoHV-1,No.AJ004801)和BoHV-1 gG-/TK-株由华中农业大学农业微生物国家重点实验室保存和构建。牛肾(MDBK)细胞购自中国兽医药品监察所。体质量350 g~400 g SPF 级豚鼠(BoHV-1 特异性gB 抗体检测为阴性)购自武汉科前生物股份有限公司。
1.2 主要试剂Prime STAR HS DNA Polymerase 购自TaKaRa 公司;BoHV-1 gB 抗体检测试剂盒购自美国IDEXX公司;IFN-γ检测试剂盒购自AVIVA公司。
1.3 病毒培养将保存的wt BoHV-1 和gG-/TK-缺失株分别接种于培养至单层的MDBK 细胞,37 ℃,5% CO2培养至出现细胞病变(CPE)后收毒,按常规方法[8]测定TCID50后用DMEM 培养基将病毒稀释成不同工作浓度备用。
1.4 实验设计16 只豚鼠随机分4 组,每组4 只,间隔21 d 进行两次免疫接种,两次接种途径均为肌肉注射,首免后35 d,4 组豚鼠均经鼻腔接种wt Bo⁃HV-1,具体方案见表1。
1.5 安全性检测
1.5.1 体温测定和临床症状观察 免疫前及免疫后1 d 测定豚鼠直肠温度,以后每隔2 d 测定1 次豚鼠直肠温度,分析温度变化情况;同时,从免疫前开始观察各组豚鼠临床症状,包括精神状态、饮水采食、鼻腔分泌物和眼分泌物等。
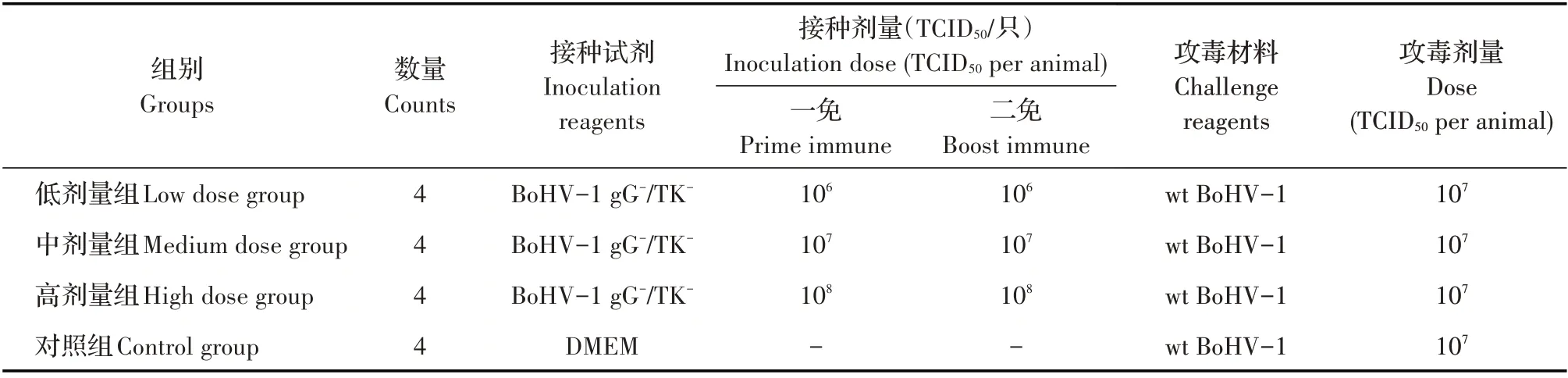
表1 豚鼠试验方案Table 1 The scheme of guinea pig experiment
1.5.2 病毒分离及鉴定 免疫前及首免后35 d 内每隔7 d 采集各组豚鼠鼻拭子,按常规方法处理鼻拭子后接种于MDBK 细胞,37 ℃培养5 d,观察CPE,出现CPE 判定为阳性。5 d 后仍无CPE 则进行盲传,若盲传3 代后仍无CPE,则判定为阴性。根据GenBank 中登录的BoHV-1 的gG 基因核苷酸序列(No.AJ004801)设计引物(F:CCGACCGCCTCCTAC ACCAGATGCT/R: GGGTGTAGGCAAGCTCACCGCAA CG),采用该引物,以病毒核酸提取试剂盒提取的阳性样本DNA 为模板,通过PCR 进行病毒株鉴定。PCR 反应体系为:模板2.0 μL,5×Prime STAR Buffer 5 μL,dNTP Mixture 2 μL;上下游引物各0.5 μL,PrimeSTAR HS DNA Polymerase 0.25 μL,补加ddH2O至25 μL。反应条件为:95 ℃5 min;94 ℃1 min、60.5 ℃45 s、72 ℃2 min,35 循 环;72 ℃10 min。PCR 产物经1%琼脂糖凝胶电泳检测。wt BoHV-1 预期扩增gG 产物长度为1 859 bp,gG-/TK-缺失株预期扩增gG 产物长度为524 bp。
1.6 特异性gB 抗体和中和抗体水平免疫前和首免后7 d、14 d、21 d、28 d 采集分离各组豚鼠血清,利用gB 抗体检测试剂盒测定血清中gB 抗体,同时各血清56 ℃灭活30 min 后采用微量细胞中和试验测定各组豚鼠各时间点血清BoHV-1 中和抗体效价。对比分析各组两种抗体水平变化规律。
1.7 IFN-γ含量的测定免疫前和首免后3 d、5 d、7 d、14 d 集分离各组豚鼠血清,利用IFN-γ 试剂盒测定各组豚鼠各时间点血清IFN-γ 含量,对比分析各组血清IFN-γ 含量变化情况。
1.8 免疫保护评价首免后35 d,4 组豚鼠均以107TCID50/只经鼻腔接种wt BoHV-1 株,每隔2 d 测量1 次直肠温度,观察记录临床症状。每日采集鼻拭子分离病毒,连续采集12 d,按照1.5.2 中方法进行病毒分离检测。攻毒后第12 d 无菌采集各组豚鼠肺,制作石蜡切片,经苏木素-伊红(HE)染色,进行肺组织病理学检测。
1.9 统计方法数据使用GraphPad Prism 5.0 软件包中的相关程序(Student's t-test)分析,数值为平均值±SEM,p<0.05 为差异显著(*),p<0.01(**)和p<0.001(***)为差异极显著。
2 结 果
2.1 安全性检测在两次免疫后,免疫组及对照组豚鼠均体温正常,偶有一过性体温升高,但平均温度不超过39.1 ℃(图1)。首免后第5 d,高剂量组1/4 豚鼠鼻腔有大量分泌物,1/4 豚鼠有少量分泌物,持续3 d;中剂量组2/4 豚鼠鼻腔出现少量分泌物,持续3 d。其余组豚鼠均未出现明显临床症状,饮水和采食均正常。表明该缺失株对豚鼠是安全的。
首免至攻毒前,各实验组豚鼠鼻拭子洗脱液接种细胞后盲传3 代,均未分离到病毒,豚鼠免疫该缺失株后并不向外排毒,进一步表明其安全性良好。
2.2 血清gB 抗体检测采集各组豚鼠血清,进行gB 抗体检测,结果显示,免疫前各组豚鼠gB 抗体均为阴性,首免后7 d,3 个免疫组均产生gB 抗体(≥55%为阳性,45%~55%为可疑)。且首免后第7 d,14 d,21 d,28 d 和35 d,3 个免疫组gB 抗体均极显著高于对照组(p<0.001),其中首免后高剂量组gB 抗体持续高于其他各组,而在首免后28 d 时3个免疫组几乎达到同一值,此后3 组共同处于平台期(图2)。表明与其他剂量组相比,高剂量BoHV-1-gG-/TK-缺失株可以快速诱导豚鼠机体gB 抗体水平达到峰值。
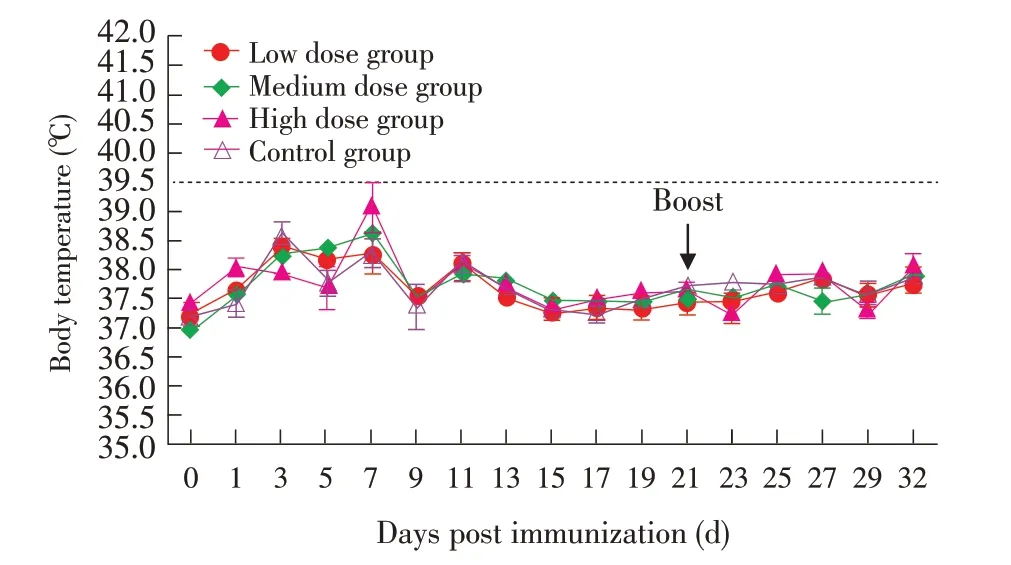
图1 免疫后豚鼠平均体温变化曲线Fig.1 Rectal temperature change of guinea pigs after immunization
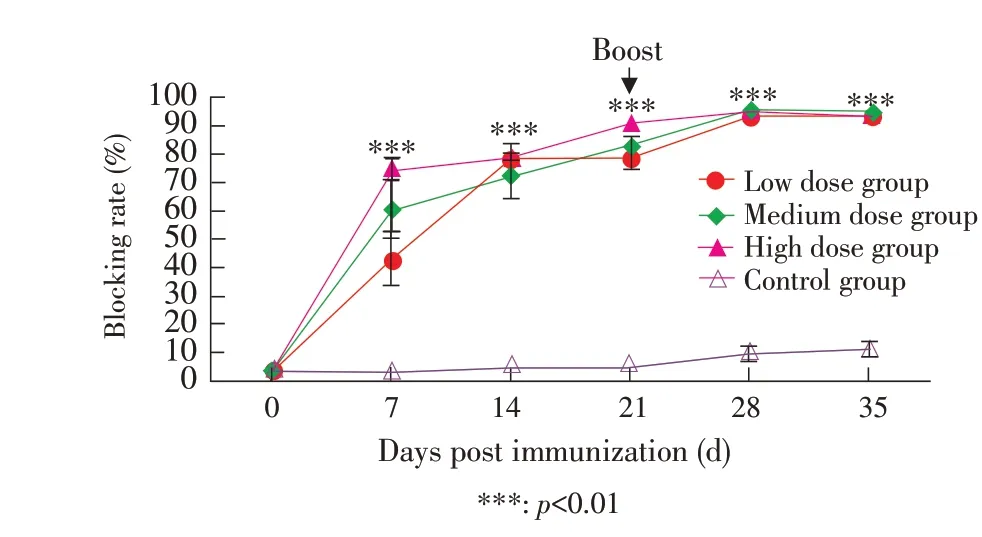
图2 免疫后豚鼠血清中的gB 抗体水平Fig. 2 gB antibody levels in guinea pigsera after immunization
2.3 血清中和抗体检测采用微量细胞中和试验法测定各组豚鼠各时间点血清中BoHV-1中和抗体效价,结果显示,首免后14 d 各组血清可检测到中和抗体,第21 d,高剂量组(1∶11.2)和中剂量组(1∶9.19)的中和抗体水平极显著高于低剂量组(1∶2.17)(p<0.01)。加强免疫后抗体水平急剧上升。第28 d,高剂量组(1∶308.00)与中剂量组(1∶193.50)之间,中剂量组与低剂量组(1∶20.80)之间,中和抗体水平差异极显著(p<0.01)。第35 d 时,高剂量组中和抗体水平稍有下降(1∶301.67),中剂量组(1∶216.95)极显著高于低剂量组(1∶74.98)(p<0.001)(图3)。表明BoHV-1 gG-/TK-株能够诱导豚鼠产生中和抗体,中和抗体水平与免疫剂量呈正相关。
2.4 血清中IFN-γ含量测定按IFN-γ 试剂盒测定各组豚鼠各时间点血清中IFN-γ 含量,结果显示,一免后第5 d,血清中IFN-γ 含量达到峰值,3 个免疫组的IFN-γ 含量各时间点均极显著高于对照组(p<0.001),其中高剂量组IFN-γ 含量>中剂量组>低剂量组,但3 个免疫组之间差异不显著(p>0.05)(图4)。表明该缺失株能在体内快速诱导IFN-γ 反应,诱导机体产生细胞免疫反应。
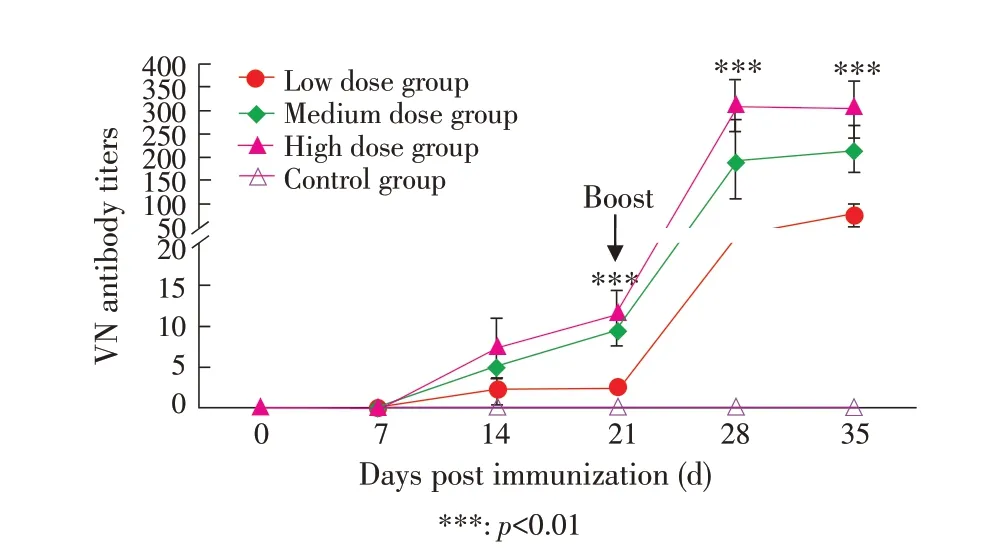
图3 各组豚鼠免疫后血清中和抗体水平Fig. 3 Neutralizing antibody (VN) titers in guinea pig sera after immunization
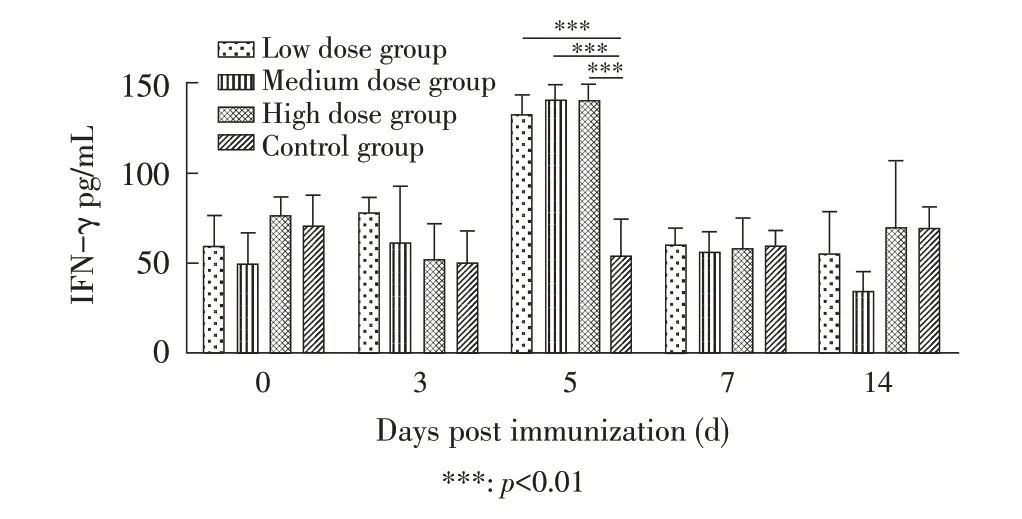
图4 各组豚鼠血清中IFN-γ 动态变化Fig. 4 Dynamic changes of IFN-γ concentration in guinea pig sera after immunization
2.5 免疫保护评价
2.5.1 体温变化和临床症状 攻毒后,各组豚鼠均体温正常。饮水和采食均正常,精神状态良好。
攻毒后第2 d,低剂量组和中剂量组各有1/4 豚鼠鼻腔出现白色分泌物,均持续7 d。攻毒后第5 d,高剂量组2/4豚鼠鼻腔出现少量分泌物,持续1 d。对照组2/4 豚鼠鼻腔出现白色分泌物,持续1 d~11 d,1/4豚鼠出现深黄色或褐色鼻腔分泌物,持续1 d~6 d。
以上结果表明攻毒后对照组出现较重临床症状,且持续时间最长;而免疫组的临床症状均减轻,且时间较短,说明该缺失株发挥了保护作用。
2.5.2 鼻腔排毒检测 攻毒后,3 个免疫组豚鼠采集的鼻拭子洗脱液均未分离到病毒,而对照组豚鼠分离到病毒,其从第1 d 或第2 d 开始排毒,平均持续时间为6 d~8 d(表2)。病毒PCR 扩增产物(部分)电泳结果显示,片段长度均为1 859 bp,判定病毒为wt BoHV-1,不是基因缺失株(图5)。攻毒后只有对照组向外界排毒,而免疫组不排毒。进一步表明BoHV-1 gG-/TK-株发挥了免疫保护作用。
2.5.3 攻毒后各组肺病理组织学变化 攻毒后采集各组豚鼠肺组织进行病理组织学检测,结果可见各组豚鼠肺组织均表现出不同程度的病理损伤。低剂量组可见肺泡壁增厚、淤血和炎性细胞浸润(图6A);中剂量组细胞病变较低剂量组稍轻(图6B);而高剂量组病变极其轻微(图6C),与正常肺的结构相似(图6D)。对照组病变最严重,可见肺泡结构消失、肺泡壁广泛增厚、局部肺泡腔内有坏死细胞、炎性细胞浸润和淤血(图6E)。表明免疫高剂量BoHV-1 gG-/TK-株使豚鼠能抵抗强毒株攻击,免疫效力最高,而低剂量和中剂量能产生部分保护效果。

表2 攻毒后豚鼠鼻腔排毒结果Table 2 Virals hedding of guinea pigs after challenge

图5 PCR 检测BoHV-1 病毒株类型Fig. 5 Detection of strain type of BoHV-1 by PCR

图6 攻毒后各组豚鼠肺的病理组织学变化(苏木素-伊红染色)Fig. 6 Histopathological examination of guinea pig lungs after challenge (HE stain)
3 讨 论
IBR 基因缺失疫苗可以选择性的对IBRV 基因进行缺失,缺失的基因可作为一种检测标志用于免疫和野毒感染动物的鉴别,是国际上IBR 根除计划中两大技术支撑之一。IBR gE 基因缺失疫苗和gG/TK双基因缺失疫苗在欧盟上市后,被欧洲许多国家和美国广泛应用于IBR 的防控和根除。但我国目前尚无IBR 类似产品上市。
本研究将构建的BoHV-1 gG-/TK-株进行豚鼠体内的安全性和有效性试验。安全性结果表明,在豚鼠体内BoHV-1 gG-/TK-株毒力明显致弱,即使最高的免疫剂量达108TCID50/只,豚鼠仍未出现明显的临床症状,且不向外排毒,疫苗株是安全的。有效性试验结果表明,双基因缺失株能诱导豚鼠产生体液免疫和细胞免疫应答,免疫应答水平与免疫剂量呈正相关,这与其在牛体中引起的免疫反应相似[7],与Parreno 等报道的IBR 灭活疫苗在豚鼠体内引起的免疫应答反应也相似[6],高剂量组诱导的中和抗体水平显著高于其他两组,该缺失株在免疫初期诱导豚鼠体内细胞因子IFN-γ 产生,从而可以激活Th1 型细胞免疫反应;gB 抗体是IBR 的特异性抗体,缺失株可以诱导豚鼠产生特异性体液免疫反应,其可能参与病毒感染后的清除;攻毒后,3 个免疫组仅个别豚鼠出现轻微临床症状,其中高剂量组症状最轻微,持续时间最短;3 个免疫组豚鼠鼻腔均不排毒,表明3 种免疫剂量均可有效抑制病毒增殖。豚鼠肺组织的病理变化显示,高剂量组无明显病理损伤,而低剂量组和中剂量组出现不同程度损伤,表明肺损伤程度与免疫剂量呈负相关,免疫剂量越大,病变程度越轻微。以上结果表明,免疫108TCID50/只的高剂量BoHV-1 gG-/TK-株能使机体完全抵抗强毒株攻击,免疫保护效力最高,而低中剂量仅能产生部分保护效果。
van Drunen 等研究表明BoHV-1 gIV(gD)亚单位疫苗能够诱导黏膜免疫和体液免疫,中和抗体水平与攻毒后保护力之间具有很强的相关性[9]。郭利等研究表明BoHV-1 LNM 株弱毒疫苗的保护效力与中和抗体水平之间存在一定的平行关系[10]。本研究也有类似发现,BoHV-1 gG-/TK-株在豚鼠体内的保护效力与中和抗体水平之间存在一定平行关系,Bo⁃HV-1 gG-/TK-株免疫后,当中和抗体效价高于1∶302时,可以对豚鼠产生良好的保护效力;1∶75<抗体效价<1∶217 时,产生部分保护效力。虽然以中和抗体为疫苗评价指标非常简单和客观,但也不能一概而论,例如,能够表达BoHV-1 gC 蛋白的人复制缺陷型腺病毒5 型重组毒株,其诱导的中和抗体水平虽然很低,但所有动物均获得了保护力[11],有研究报道中和抗体与保护力之间并无统计学相关性[12]。
本实验并未同时开展牛体的免疫效力试验,因此,目前对BoHV-1 gG-/TK-株在豚鼠和牛体的免疫效力的相关性尚不清楚,未来将开展相关工作。此外,尽管本研究确定低于108TCID50/只的接种剂量是安全的,但这并不是最低安全剂量,需要在107TCID50/只~108TCID50/只剂量之间再进行后续试验,才能确定机体获得完全保护效力时的最小免疫剂量。
综上所述,BoHV-1 gG-/TK-株在豚鼠体内是安全的,并能诱导机体产生很好的免疫保护效果。本研究为建立IBR 疫苗的豚鼠评价模型奠定了基础,同时也为IBR基因工程疫苗的研制提供重要基础数据。

