两株鸭疫里默氏杆菌的分离鉴定及生物学特性分析
陈国权,吴征卓,姚碧琼,施大军,王 娜,张天天,阎朝华,周碧君,3*,王开功,3,程振涛,3,文 明,3*
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州大学动物疫病研究所,贵州 贵阳 550025;3.贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025;4.三穗县鸭产业化建设管理办公室,贵州 三穗 556500;5.贵州千里山生态食品股份有限公司,贵州 三穗 556500)
鸭疫里默氏杆菌(Riemrella anatipestifer,RA)属于黄杆菌科里默氏菌属,是一种有荚膜、无芽孢、无鞭毛的革兰氏阴性兼性胞内菌,能感染鸭、鹅和火鸡等多种禽类,引起以纤维素性心包炎、肝周炎和脑膜炎为主要病变的鸭疫里默氏杆菌病[1-2]。目前世界上报道过的RA 血清型至少有21 种,中国主要以血清1 型、2 型和10 型为主[3]。由于不同血清型之间缺乏交叉免疫保护,药物治疗在养鸭生产过程中仍是防治RA 感染的一种重要措施,但同时也致使RA 具有广泛的耐药性,RA 已成为影响全球养鸭业最主要的病原菌之一,并造成严重的经济损失[4-5]。
外膜蛋白A(Outer membrane protein A,OmpA)作为一种主要蛋白广泛存在于革兰氏阴性细菌中,维持细胞膜的完整性[6]。OmpA 是RA 一种主要的抗原决定簇,能诱导良好的保护性免疫,且具有高度保守性。OmpA 基因全长1 164 bp,共编码387 个氨基酸,通过对该基因进行PCR 扩增及测序可对RA作出鉴定[7]。本研究通过对临床疑似RA 感染的濒死鸭心和肝组织进行细菌分离培养,通过生化试验、OmpA 基因扩增和玻片凝集试验对分离菌进行鉴定,本研究首次证实了血清11 型RA 在贵州省的存在,丰富了贵州省RA 的流行病学资料。本研究对RA 分离株进行致病性检测和耐药性分析,以期了解RA 的致病机制和耐药机制,为更好地防控RA 和开展相关研究提供科学依据。
1 材料与方法
1.1 病料样品来源及阳性菌株2019 年12 月,贵州省三穗县2 个养鸭场(分别用A、B 代替)雏鸭出现爆发性死亡病例。A、B 养鸭场原存栏雏鸭分别为11 000 只和9 700 只,均从11 日龄出现死亡现象,至调查日(A 场雏鸭16 日龄、B 场雏鸭14 日龄)已分别死亡8 000 余只和2 000 余只。2 个养鸭场发病雏鸭的临床症状相似,以神经症状和运动障碍为主。每个养鸭场分别采集处于濒死期的5 只雏鸭的心、肝和脾组织用于病原分离。RA-SS1 阳性菌株由贵州大学动物疫病研究所鉴定并保存。
1.2 主要试剂及实验动物细菌基因组DNA 提取试剂盒、2×Taq PCR MasterMix 购自天根生化科技(北京)有限公司;DL2000 DNA Marker、DL5000 DNA Marker、BamH Ⅰ、Hind Ⅲ均 购 自TaKaRa 公司;Gel Extration Kit、Plasmid Mini Kit 购 自Omega 公司;革兰氏染液购自北京索莱宝科技有限公司;胰酪大豆胨液体培养基(TSB)、微量生化鉴定管、药敏纸片购自杭州微生物试剂有限公司;新生牛血清购自浙江天杭生物科技有限公司;4%多聚甲醛购自BOSTER 公司。10 日龄健康雏鸭来源于贵州省三穗县兴绿洲农业发展有限公司。
1.3 引物设计与合成参照雷云等[8]合成RA OmpA全基因引物;参照包细明等[9]和张亚楠等[10]合成RA常见的氨基糖苷类耐药基因aac(6')-Ib、喹诺酮类耐药基因oqxB、大环内酯类耐药基因ermF、四环素类耐药基因tet(X)、氯霉素类耐药基因floR、整合子酶基因IntI1 的引物,引物由上海生工生物工程技术服务有限公司合成(表1)。
1.4 细菌的分离培养无菌采集处于濒死期雏鸭的心、肝和脾组织,划线接种于巧克力培养基,于37 ℃、5% CO2倒置培养,24 h 后观察细菌生长情况,挑取形态特征一致的单个菌落进行革兰氏染色,镜检观察染色特性及形态。通过培养特性,菌落、菌体形态,染色特性进行初步判定,将特征型单个菌落接种于TSB(含5%新生牛血清)培养基中进行纯化增殖培养备用。
1.5 分离菌的生化鉴定参考雷云[8]等和包细明[9]等选取用于鉴定RA 的微量生化鉴定管,无菌取分离菌纯培养菌液接种于生化鉴定管,37 ℃、5% CO2培养24 h~48 h,观察并记录结果。
1.6 分离菌OmpA基因的PCR 鉴定及序列分析无菌吸取1.5 mL 菌液于离心管,利用细菌基因组提取试剂盒提取分离菌总DNA。以分离菌基因组为模板,采用OmpA 基因引物进行PCR 扩增[8]。PCR 扩增产物经1.2%琼脂糖凝胶电泳检测后,利用胶回收试剂盒回收纯化目的基因。将目的基因连接至pMD19-T 载体,按分子克隆技术常规操作进行目的基因的克隆,挑取经质粒双酶切鉴定为阳性的重组质粒由华大基因科技有限公司测序,测序结果与参考序列应用MegAlign 进行核苷酸同源性比对,采用MEGA 7.0 构建系统进化树及分析。

表1 引物信息Table 1 Primers used in this study
1.7 分离菌的血清型鉴定将纯化后的RA 送至四川农业大学动物医学院禽病防治研究中心,使用血清1 型~13 型、16 型RA 阳性血清对2 株RA 进行血清型鉴定。
1.8 分离菌感染雏鸭的回归试验挑选饲养至10 d的15 只健康雏鸭,随机分为2 个实验组和1 个对照组,每组各5 只。实验组雏鸭分别腿部肌肉注射0.5 mL RA 不同分离株菌液(菌液浓度调制为3×108cfu/mL),对照组雏鸭腿部肌肉注射等量无菌TSB(含5%新生牛血清),每天按时观察雏鸭临床症状与死亡情况,直至攻毒后第7 d。取攻毒后濒死雏鸭的心、肝、脾及脑组织用4%多聚甲醛固定,由武汉塞维尔生物科技有限公司制作病理切片,通过病理切片进行组织病理变化观察。
1.9 分离菌的药敏试验根据抗微生物药物敏感性试验执行标准(CLSI)[11]的要求,采用纸片扩散法(K-B 法)对分离菌进行青霉素类、头孢类、氨基糖苷类、喹诺酮类、大环内酯类、四环素类、氯霉素类和磺胺类等8 类抗菌药物敏感性试验。
1.10 分离菌的耐药基因检测以分离菌DNA 为模板,采用aac(6')-Ib(氨基糖苷类)、oqxB(喹诺酮类)、ermF(大环内酯类)、tet(X)(四环素类)、floR(氯霉素类)和IntI1(整合子酶基因)等6 种耐药基因引物(10 μmol/L)进行PCR 扩增[9-10],PCR 扩增产物经1.2%琼脂糖凝胶电泳进行检测。
2 结 果
2.1 细菌分离培养及菌体形态观察结果无菌接种濒死鸭心和肝组织于巧克力琼脂培养基进行细菌培养。结果显示,从2 个养鸭场濒死雏鸭肝组织内各分离到1 株疑似菌株,该分离菌对营养要求较高,在普通营养琼脂培养基和麦康凯培养基中均无菌落生长,在巧克力培养基可见表面光滑、边缘整齐、半透明、中央微突起的露滴样小菌落。2 株分离菌的革兰氏染色镜检形态均为革兰阴性短小杆菌,多数呈单个状态,少数成对或呈短链状排列(图1)。分离菌菌落形态和革兰氏染色镜检形态与RA 相符,将2 株分离菌分别命名为GZ-SS01 和GZ-SS02。
图1 分离菌革兰氏染色镜检结果(×1 000)Fig. 1 Microscopic examination of the isolateds with Gram stain (×1 000)
2.2 分离菌生化鉴定结果无菌接种分离菌纯培养物于微量生化管中进行生化特性观察。结果显示,2 株分离菌均能分解尿素;氧化酶、触酶试验均为阳性;不发酵葡萄糖、蔗糖、麦芽糖和乳糖;不水解赖氨酸、鸟氨酸和精氨酸;硝酸盐还原、硫化氢、甘露醇、靛基质和VP-MR 试验均为阴性。分离菌生化特性与RA 相符,结合细菌培养特性、染色镜检结果及生化特性可初步判定2 株分离菌为RA。
2.3 分离菌OmpA基因的PCR 鉴定及序列分析结果以GZ-SS01 和GZ-SS02 分离菌的基因组为模板,采用OmpA 基因特异性引物进行PCR 扩增,结果均获得约为1 200 bp 的目的条带(图2A);使用BamHⅠ、Hind Ⅲ对重组质粒双酶切,可见约为1 200 bp的基因条带和约为2 700 bp 的载体条带(图2B)。将测序获得的OmpA 基因序列与NCBI 数据库中参考菌株OmpA基因序列进行分析,核苷酸同源性比对结果发现,2 株分离株与15 株RA 参考株的OmpA 基因序列的同源性高达93%~99.9%。系统进化树分析发现,2 株分离株与8 株RA 参考株的OmpA 基因序列聚为一簇,且置信度为100%;GZ-SS01 株与JL-RA1 株(HQ707077.1)和GZ-RA2 株(KY399233.1)亲 缘 关系最近,GZ-SS02 株与GZ-RA3 株(KY399234.1)亲缘关系最近(图2B)。综合分离菌的形态学特征、生化特性及OmpA 基因序列分析结果,判定这2 株分离菌均为RA。
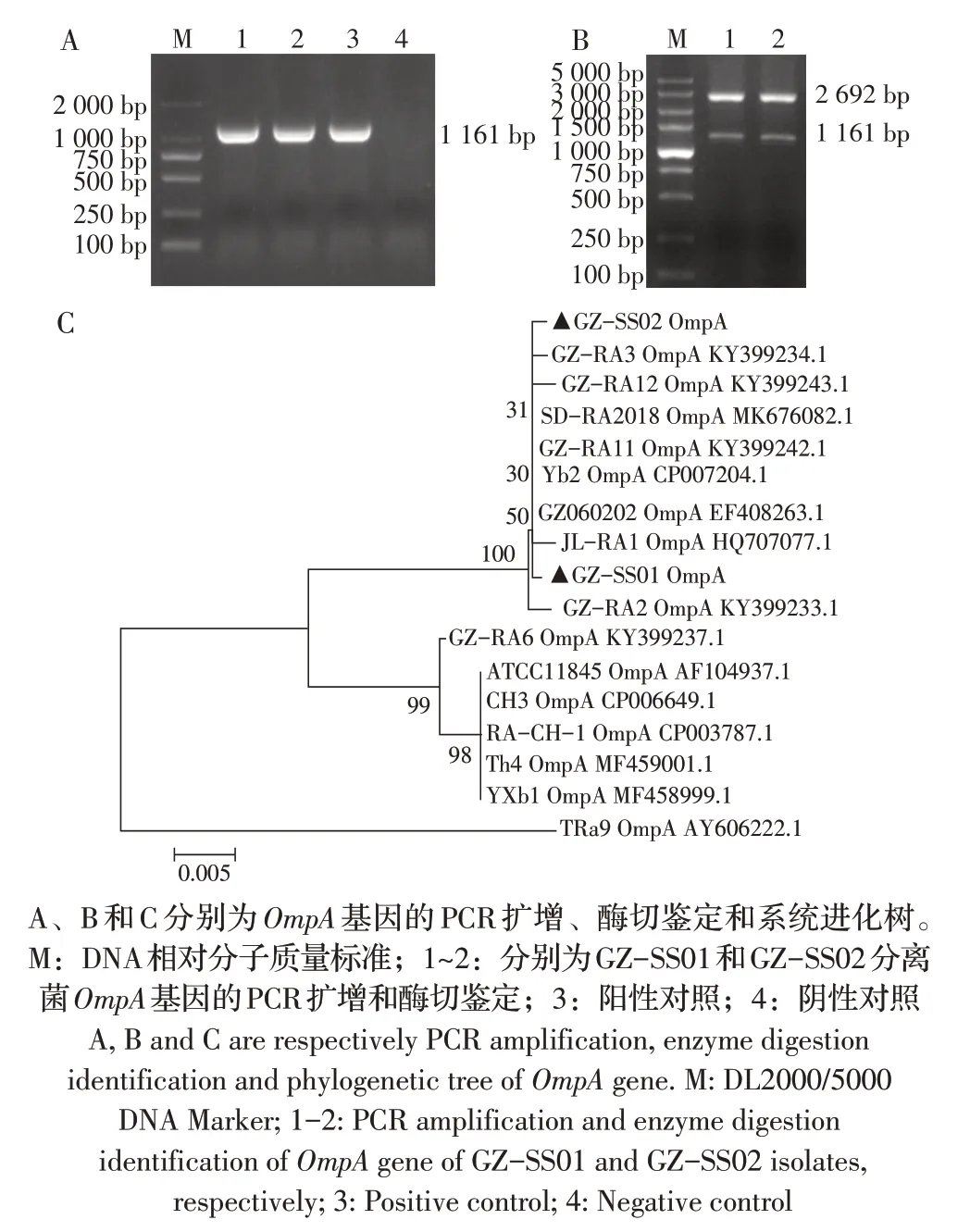
图2 基于OmpA 基因的PCR 扩增、酶切鉴定和系统进化树分析Fig. 2 PCR amplification, enzyme digestion identification and phylogenetic tree analysis based on OmpA gene
2.4 分离菌血清型鉴定结果经玻片凝集试验对分离菌进行血清型鉴定,结果显示,GZ-SS01 株和GZSS02株与血清11型阳性血清反应均能出现清晰的乳白色絮状凝集块,与血清1~10、12~13和16型阳性血清均无明显变化,由此判定2株分离菌均为血清11型RA。
2.5 分离菌感染雏鸭的致病性试验结果两组实验雏鸭经腿部肌肉分别注射不同分离株菌液,连续观察7 d。结果显示,感染12 h 后,两组实验雏鸭均出现头颈歪斜、站立不稳等明显临床症状;24 h 后开始出现死亡,呈现角弓反张状;48 h~60 h 达到死亡高峰期,其间死亡率达60%(6/10);90 h 后两组实验雏鸭全部死亡。濒死鸭心、肝和脾组织接种于巧克力琼脂培养基均能分离得到与原分离菌形态一致的菌落。对照组雏鸭在观察期均未出现感染症状或死亡。剖检濒死雏鸭,均能明显观察到心、肝及气囊表面附有纤维素性渗出物。观察人工感染90 h后濒死鸭组织病理变化可见:心外膜增厚,表面附有大量粉红色网状纤维素渗出物,有大量单核细胞和异嗜性粒细胞弥漫性浸润(图3E);肝被膜水肿增厚,表面有粉红色网状纤维渗出,混有大量淋巴细胞和异嗜性粒细胞(图3F);脾被膜水肿增厚,聚集有大量粉红色纤维素渗出,异嗜性粒细胞浸润,红髓与白髓界限不清(图3G);脑膜充血、水肿增厚,有粉红色网状纤维渗出,其间可见淋巴细胞和异嗜性粒细胞弥散性浸润(图3H)。临床症状及病理变化与发病鸭一致,表明两株分离株为该疫情的病源菌,且对雏鸭均具有较强的致病性。
2.6 分离菌药敏试验结果采用纸片扩散法(K-B法)对分离菌进行药敏试验。结果显示,2 株分离菌对哌拉西林、头孢哌酮、头孢曲松、头孢拉定、头孢氨苄、氧氟沙星和米诺环素等7 种抗菌药物敏感;对青霉素类(羧苄西林和氨苄西林)、氨基糖苷类(丁胺卡那、庆大霉素和新霉素)、大环内脂类(阿奇霉素、红霉素和麦迪霉素)、四环素类(四环素和多西环素)和氯霉素类(氟苯尼考)等5 类11 种抗菌药物耐药(表2),2株分离菌均属于5重耐药菌株。
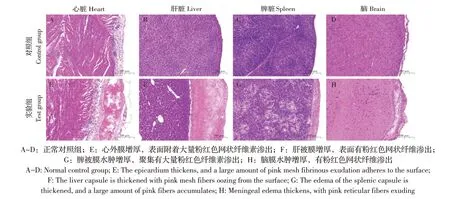
图3 RA 人工感染雏鸭90 h 后组织病理学观察结果Fig. 3 Histopathological observation results after 90 hours of artificial infection of ducks with Riemerella anatipestifer
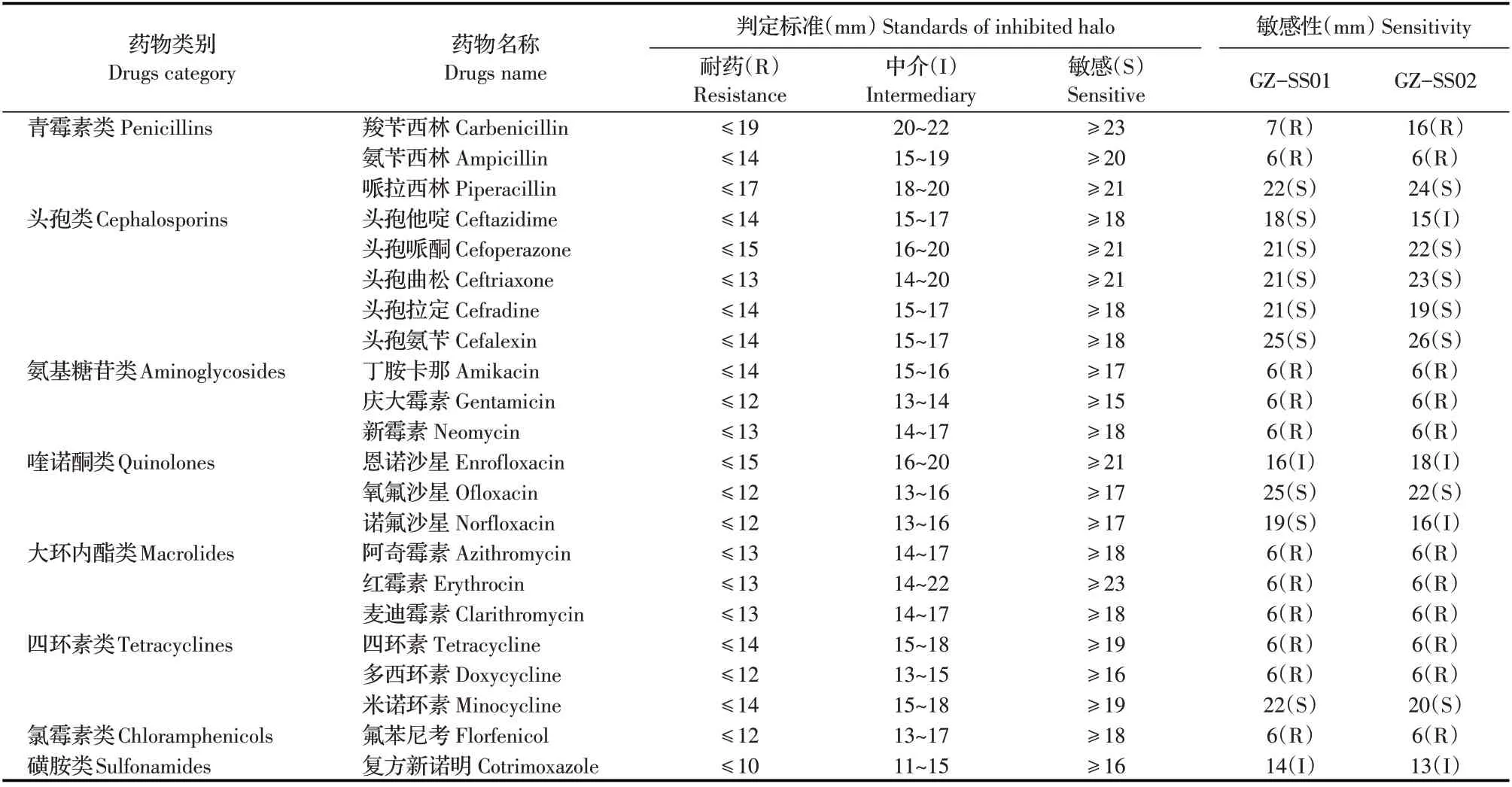
表2 鸭疫里默氏杆菌分离株的药敏试验结果Table 2 Results of drug sensitivity test of Riemerella anatipestifer isolates
2.7 分离菌耐药基因检测结果以合成的耐药基因引物进行PCR 检测,结果显示,2 株分离菌均携带氨基糖苷类耐药基因aac(6')-Ib(486 bp)、大环内酯类耐药基因ermF(460 bp)、四环素类耐药基因tet(X)(1 167 bp)、氯霉素类耐药基因floR(673 bp)和整合子酶基因IntI1(280 bp)等5 种耐药基因,均不携带喹诺酮类耐药基因oqxB(755 bp)(图4),耐药基因检测结果与耐药表型结果除四环素类中米诺环素耐药情况不一致外其余均一致。
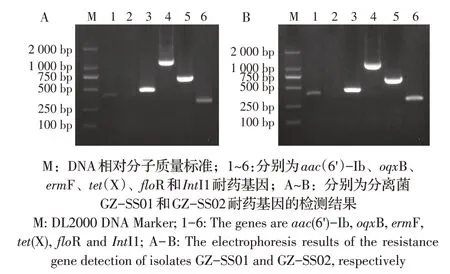
图4 分离菌耐药基因检测结果Fig. 4 PCR amplification results of drug resistance genes of the two isolates
3 讨 论
RA 对1~8 周龄的雏鸭具有很强的致病性,RA血清型众多且各型之间缺乏交叉免疫保护,掌握各个地区RA 的优势血清型对于该地RA 疫苗株的选择具有重要意义[12]。目前对RA 进行血清型鉴定主要为玻片凝集试验和试管凝集试验等血清学分型法,但该法需依赖阳性血清才能进行血清型分型[13]。本研究发现2 株血清11 型RA 分离株与其他血清型RA参考株仍处于同一基因群,进一步证实基于OmpA基因分型与血清型分型无直接关联。OmpA 是RA 引起细胞粘附、侵袭和血清抗性的主要毒力因子,存在于所有RA 血清型中,且遗传异质性较小[14]。谢永平等针对OmpA 基因保守区序列设计引物和探针建立了快速、精准检测RA 的qPCR 方法[6];包细明等选用OmpA 基因序列建立了快速诊断RA 的多重PCR 方法,可见能选用该段基因对RA 作出鉴定[15],但无法判断RA 血清型。
不同血清型RA 感染鸭引起的临床症状和病理变化基本相似,多伴有神经症状的纤维素性心包炎、肝周炎和气囊炎为特征。袁小远等研究指出血清1 型RA 感染症状主要表现为缩颈、运动困难等症状;以心、肝和气囊等浆膜表面出现明显的纤维素性渗出为主要病变[16]。雷云等用分离到的血清2 型RA 进行动物回归试验显示,攻毒后的实验鸭表现明显的歪头缩颈的神经症状;剖检见心、肝组织表面均有纤维素性渗出物,脾脏充血肿大等病理变化[17]。杨晓辉等用分离到的血清11 型RA 进行动物回归试验显示,攻毒后的实验鸭表现出头颈震颤症状,剖检可见纤维素性心包炎、肝周炎和气囊炎[18]。本研究用分离到的2 株血清11 型RA 进行动物回归试验显示,实验鸭主要以运动障碍和神经症状为主;病变主要以纤维素性心包炎、肝周炎和脑膜炎为主,部分还表现有脾被膜水肿增厚等病理变化。关于血清11 型RA 感染鸭的组织病理变化的研究报道相对较少,本研究通过对该型RA 感染鸭进行组织病理学分析,丰富了该型RA 的病理资料,为该型RA 的致病机理研究提供参考。血清11 型RA与1、2 型RA 感染引起的症状与病变基本一致,且对雏鸭都具有很强的致病性,因此很难通过观察症状和病变对RA 血清型进行区分。本研究首次证实了血清型11 型RA 在贵州的存在,为该地区科学全面地防控RA 指明了新的方向。
抗菌药物的广泛使用使RA 对多种抗菌药物产生耐药性,并出现了多重耐药菌株。研究表明RA对多种抗菌药物具有天然抗性,RA 临床分离株对氨基糖苷类、大环内酯类、喹诺酮类、氯霉素类和四环素类抗菌药物具有不同程度的耐药性[4,19]。朱元军等对我国南方部分地区120 株RA 进行耐药性分析,发现对部分氨基糖苷类、大环内酯类、氯霉素类和四环素类抗菌药物产生了严重的耐药性,且氨基糖苷类耐药基因aac(6')-Ib 的检出率高达74.1%(89/120)[20]。任晓梅等对46 株RA 进行耐药性分析,发现对氨苄西林、新霉素和红霉素等抗菌药物高度耐药[21]。本研究结果发现2 株RA 对所检测氨基糖苷类、大环内酯类和氯霉素类抗菌药物耐药,与以上研究结果基本一致;2 株RA 对喹诺酮类药物较敏感,与朱德康等[4]和任晓梅等[21]研究结果不一致。耐药基因 检 测 结 果 显 示,2 株RA 都 携 带aac(6')-Ib、ermF、tet(X)、floR 和IntI1 等5 种耐药基因,除四环素类中米诺环素耐药表型与基因型不一致外,其余耐药表型与基因型基本相符。通过对RA 的耐药表型和基因型进行比较分析可以确定RA 对某种抗菌药物的耐药程度,为指导临床合理用药提供科学依据[22]。
本研究从贵州省三穗县2 个养鸭场疑似RA 感染的濒死鸭肝组织中分离到2 株血清11 型RA,首次证实了血清11 型RA 在贵州省的存在,且均能复制出RA 感染引起的典型临床症状与病理变化,均具有较强的致病性。2 株RA 对头孢类和喹诺酮类抗菌药物较为敏感,对部分青霉素类、氨基糖苷类、大环内酯类、四环素类和氯霉素类等5 类抗菌药物呈现不同程度的耐药性,且耐药表型与基因型基本一致。

