基于液相PNA-FISH 技术的单增李斯特菌检测方法研究
杨 彤,李 可,叶子弘,吴 姗,张晓峰*,帅江冰*
(1.中国计量大学生命科学学院/浙江省生物计量与检验检疫技术重点实验室,浙江 杭州 310018;2.浙江省检验检疫科学技术研究院,浙江 杭州 310016)
单核细胞增生李斯特菌(简称单增李斯特菌)(Listeria monocytogenes)广泛存在于自然界中,该菌在4 ℃的环境中仍可生长繁殖,且对酸性、碱性条件都有极强的适应能力。单增李斯特菌同时是一种重要的人兽共患李斯特菌病的病原菌,也是李斯特菌属中唯一对人致病的病菌,与其他所有人畜共患传染病相比,李斯特菌病造成的致死率高达30%以上。单增李斯特菌病已被欧盟监测认定为最严重的食源性疾病之一,且近年来有显著的增长趋势[1-2]。快速检测单增李斯特菌可有效预防和控制单增李斯特菌疾病的暴发,目前许多国家都已经制定了相应的检验检测标准。但传统检测方法普遍存在耗时耗力,容易受到杂菌的干扰,或操作技术要求高,不能同时大批量检测等问题[3]。因此急需一种可大批量快速检测单增李斯特菌的方法。
基于液相方法的肽核酸荧光原位杂交(Peptide nucleic acids fluorescence in situ hybridization,PNAFISH)技术通常在荧光显微镜或流式细胞仪下检测其荧光信号[4]。吴姗等首次使用荧光扫描技术,对检测单增李斯特菌的荧光信号结果进行快速初筛(完成2~3 个荧光波段的96 孔扫描,耗时不超过10 min),提高了检测速率[5]。在此基础上本研究根据酶标仪所检测到的荧光强度与溶液中靶标的量成正比的原理,沿用液相荧光扫描技术及本研究室前期所设计的特异性肽核酸探针Lm-16S-2 对单增李斯特菌进行检测。液相PNA-FISH 技术克服了固相方法中洗涤不充分、检测通量低、显微镜通道对不同荧光波段存在交叉的缺陷,同时本研究经过重复性和再现性试验测定了该方法精密度。该方法为检测大批量单增李斯特菌样品提供了一个快速、准确的可行方案。
1 材料与方法
1.1 主要实验材料本研究所使用的标准细菌均购自中国医学细菌保藏管理中心,实验涉及到的所有分离菌株均来自浙江省检科院动物检疫实验室(表2);PBS购自生工生物工程(上海)股份有限公司;RNase A酶购自赛默飞世尔科技公司;脑心浸出液BHI、李氏增菌肉汤LB1、LB2购自、PALCAM 琼脂平板、NA平板均购自北京陆桥生物技术股份公司;李斯特菌显色培养基购自CHROMagarMT法国科玛嘉。本研究中Bacuni 探针是细菌通用型探针,作为阳性对照,序列为5'-CTGCCTCCCGTAGGA-3'[4];Lm-16S-2 探针是本研究室针对单增李斯特菌16S rRNA 基因片段设计的特异性探针,序列为5'-TAGTACAAAGGGTCG-3';所用探针5'均由韩国Daejeon 公司进行FAM 荧光基团标记(494 nm~522 nm)并合成。28 份家禽组织样品由浙江省检科院动物检疫实验室提供,用于后续单增李斯特菌检测。
1.2 细菌培养及液相PNA-FISH 杂交细菌在36 ℃,180 r/min 条件下振荡过夜培养至对数生长期,根据标准GB4789.2-2016[6]计算菌悬液的初始浓度。参照文献[5,7]对本研究中Bacuni、Lm-16S-2 两种探针均采用如下相同的杂交步骤:8 000 r/min 离心5 min 后弃培养基溶液,用PBS 悬浮洗涤菌体后再用80%的酒精加PBS 固定重悬1 h,取1 mL 菌悬液,8 000 r/min 离心5 min,弃固定液,加入500 μL杂交缓冲液[pH 8.0,10 mmol/L NaCl,300 pmol/mL PNA 探针,7.77%(w/v)硫酸葡聚糖,5.6%(v/v)甲酰胺,0.2%(v/v)Triton X-100;50 mmol/L Tris/HCl],60 ℃作用58 min,8 000 r/min 离心5 min 后弃杂交缓冲液,加入1 mL 预热的洗涤缓冲液(pH 9.0,10 mmol/L Tris,1 mmol/L EDTA),60 ℃温浴20 min,8 000 r/min 离心5 min,弃洗涤缓冲液,重复洗涤1 次,加入220 μL 洗涤缓冲液重悬。设置以细菌通用型探针Bacuni 为阳性对照;用相同体积不含PNA探针的杂交缓冲液代替重悬,为测定背景本底值,命名为阴性对照N1;加入杂交缓冲液前用40 μg/mL RNase 重悬裂解,水解RNA 磷酸二酯键,从而破坏靶向结合序列而不能与探针结合,测定PNA 探针杂交的目标位点,命名为阴性对照N2。取200 μL 重悬的菌液加入96 孔板中,采用SpectraMax M5 微孔板检测系统,激发光波长设置为494 nm,发射光波长设置为522 nm,进行荧光检测。对每个荧光扫描的样品均用荧光显微镜100 倍物镜及L5 通道(512 nm~542 nm)观察确证,显微镜下具有明显发光的菌体且符合目标菌形态学特点即判定为阳性[8-10]。
1.3 细菌固定条件的优化在细菌杂交前固定步骤中通常使用4%多聚甲醛对细菌形态进行固定,为避免多聚甲醛对实验人员健康的危害,本研究拟采用80%酒精加PBS(方法二)代替50%酒精加4%多聚甲醛(方法一)固定渗透细菌的方式,试验测定两种杂交前处理方法对杂交荧光强度的影响,采用F 检验和t 检验比较二者是否存在显著性差异。
具体试验方法为:选取单增李斯特菌ATCC 10890 株为目标菌,利用方法一和方法二分别测定1.2 中该菌初始菌悬液和分别稀释2 倍、3 倍、5倍、10 倍杂交后的荧光值,每个浓度样品平行测定6 次,计算平均值及标准偏差,同时按照1.2 中的方法设置阴性对照N1 和阳性对照实验。
1.4 液相PNA-FISH 方法特异性试验通过对17株单增李斯特菌、8 株非单增李斯特菌与14 株非李斯特菌(表2)测定液相PNA-FISH 方法的特异性。杂交体系按照课题组前期优化好的方案进行试验(见1.2),所有细菌分别与特异性探针、细菌通用探针进行杂交,比较两种探针荧光强度差异,共测定5次,计算平均值及标准偏差,同时设定N1、N2 两组阴性对照实验,试验结果与国标中(GB 4789.30-2016[11])细菌生化鉴定法进行比较。
1.5 液相PNA-FISH 方法敏感性试验根据上述1.2 中所得初始菌液浓度结果,10 倍系列稀释(101cfu/mL~108cfu/mL),分别取102cfu/mL、103cfu/mL、104cfu/mL 和105cfu/mL 浓度的单增李斯特菌1 μL,于李斯特菌显色培养基上划线接种(36 ℃,20 h),观察其生长情况,测定方法敏感性。再取单增李斯特菌特征性单菌落于NA 培养基上纯化培养(36 ℃,24 h),取NA 培养基上新鲜菌落进行液相PNAFISH 结合Lm-16S-2 探针方法和生化鉴定法[11]的单增李斯特菌检测。
1.6 重复性试验利用上述液相PNA-FISH 方法在短时间内对同一单增李斯特菌样品进行20 次重复检测,评价其批内、批间的重复性。批内重复性试验将同一单增李斯特菌样品分成数份,平行测定20次;批间重复性试验将同一单增李斯特菌样品分成20 份,每天测定1 份,连续测20 d。本试验分别对8 种单增李斯特菌(1:单增李斯特菌Listeria monocy⁃togenes ATCC 10890,2:单增李斯特菌Listeria mono⁃cytogenes ATCC 19118,3:单增李斯特菌Listeria monocytogenes ATCC 19112,4:单增李斯特菌Liste⁃ria monocytogenes CMCC(B)54002,5:单增李斯特菌Listeria monocytogenes CMCC(B)54003,6:单增李斯特菌Listeria monocytogenes CMCC(B)54006,7:单增李斯特菌Listeria monocytogenes CMCC(B)54007,8:单增李斯特菌Listeria monocytogenes NCTC 5348)进行杂交荧光值重复性测定,对所得数据经分析处理,得到该方法批内、批间的变异系数。
1.7 再现性试验更换不同实验室及操作人员,在1.3 中的5 个浓度单增李斯特菌菌液中挑选前4 个样品进行杂交后荧光值检测,每个样品做6 个平行,计算平均值及标准偏差,同时按照1.2 中的方法设定阴性对照N1 和阳性对照。
1.8 家禽组织样品的检测将28 份家禽组织样品按照国标方法[11]增菌分离培养后,取NA 平板培养基上经过纯化的单增李斯特菌,利用液相PNAFISH 结合Lm-16S-2 探针方法和生化鉴定方法检测样品中的单增李斯特菌,比较2 种方法的检测结果,并计算该方法同生化鉴定法的符合率。
2 结 果
2.1 细菌固定条件的优化结果通过对平板计数法计算得到单增李斯特菌ATCC 10890 菌液原始浓度为6.2×109cfu/mL。对5 个不同浓度的单增李斯特菌样品分别采用80%酒精加PBS 和50%酒精加4%多聚甲醛两种杂交前细菌固定方式,检测荧光强度(图1)。结果显示,随着菌液浓度降低,阳性对照探针组与特异性探针组的杂交荧光值均随之降低且两种探针间无明显差异。两种细菌固定方法间的F 检验和t 检验均通过SPSS 统计软件实现,结果显示,5 个不同浓度单增李斯特菌样品F 检验的p 值均大于0.05,两种固定方法对每个浓度菌液杂交荧光值均呈现方差齐性,离散程度低,不存在统计学上的显著性差异,可靠性达95%,可进行t 检验;对单增李斯特菌原液、稀释2 倍、稀释3 倍、稀释5倍、稀释10 倍4 个浓度样品t 检验,两种固定方法对原浓度菌液稀释直至5 倍时的荧光检测结果均在95%置信区间内,不存在显著性差异(p>0.05),而浓度稀释10 倍的单增李斯特菌样品p 值为0.024,小于0.05,该浓度下两种固定方法存在显著性差异(表1)。其原因可能是由于稀释倍数过高,菌量不足以达到仪器检出水平。以上实验结果表明,不同单增李斯特菌样品经过增菌处理,当用于杂交的菌量大于109cfu 时可采用80%酒精加PBS 的杂交前处理方法,减少多聚甲醛的使用及其对实验人员造成的健康危害。
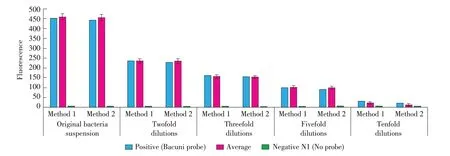
图1 两种杂交前处理方法检测结果Fig. 1 The results of two pre-hybridization methods
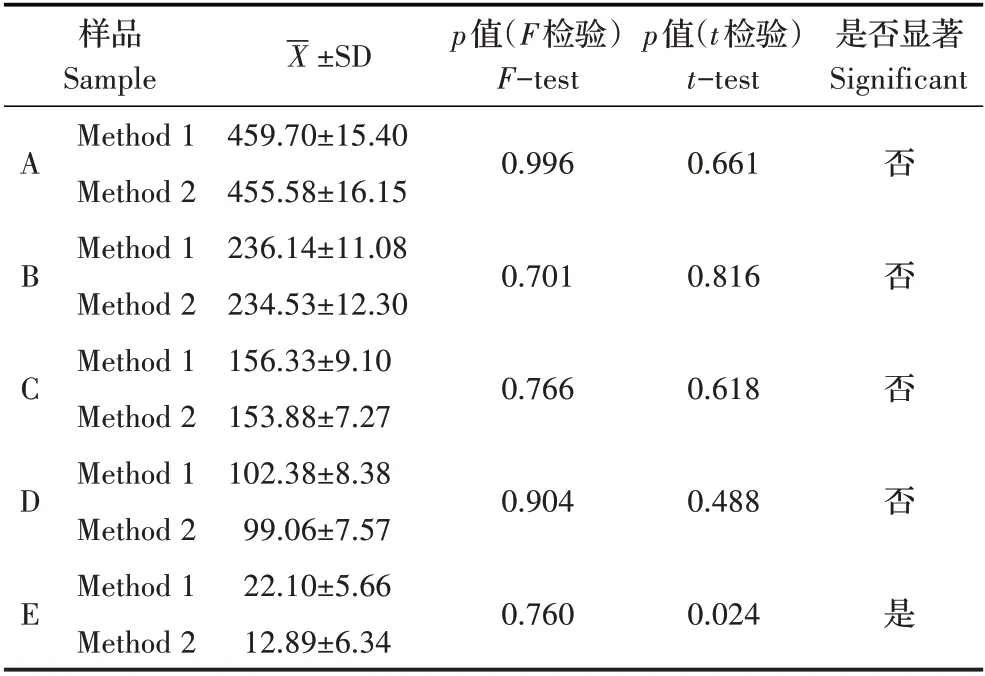
表1 两种细菌固定处理结果的假设检验Table 1 Hypothesis testing of two pre-hybridization treatments
2.2 液相PNA-FISH 方法特异性试验结果利用该方法对目标菌与非目标菌测定结果显示,通用探针与全部细菌杂交,荧光检测数值在300~600 间为阳性;特异性探针Lm-16S-2 与所有单增李斯特菌均杂交,数值多在200~500 之间,为阳性,在与非单增李斯特菌与非李斯特菌杂交时,特异性探针与之杂交均为阴性(表2),该探针具有高度特异性;统计分析荧光检测数值,结果显示,各组单增李斯特菌荧光检测数值较为均一,且与阳性对照组荧光值无明显差异,可作为结果判定依据;全部细菌阴性对照N1 的杂交荧光值均较低,数值小于10,该方法获得与细菌生化鉴定法一致的特异性结果;比较N1、N2 两组数据显示,RNase 酶对目标序列起到消化作用,PNA 探针杂交的靶位点为RNA 序列。上述试验表明利用Lm-16S-2 探针的杂交荧光值可区分阴阳性,有效避免了假阳性的结果,本研究中液相PNA-FISH 方法具有较强的特异性。
2.3 液相PNA-FISH 方法敏感性试验结果在10倍系列稀释的单增李斯特菌菌液,涂板培养后观察各个平板上菌落生长情况。结果显示,102cfu/mL 和103cfu/mL 的增菌液在单增李斯特菌显色培养基上没有出现明显可疑菌落,104cfu/mL 和105cfu/mL 的增菌液出现单增李斯特菌的特征性菌落。利用建立的液相PNA-FISH 方法和生化试验检测上述菌液,结果显示特征性菌落即为单增李斯特菌。因此,本研究中液相PNA-FISH 方法对单增李斯特菌检测的敏感性可达到与国标中生化鉴定法相同的水平,即104cfu/mL。表明本研究建立的单增李斯特菌液相PNA-FISH 方法具有较高的敏感性。
2.4 重复性试验结果利用液相PNA-FISH 检测方法对8 个批次的不同种单增李斯特菌进行批内和批间重复性检测,结果显示变异系数均低于5%(表3),表明该方法具有较好的可重复性。
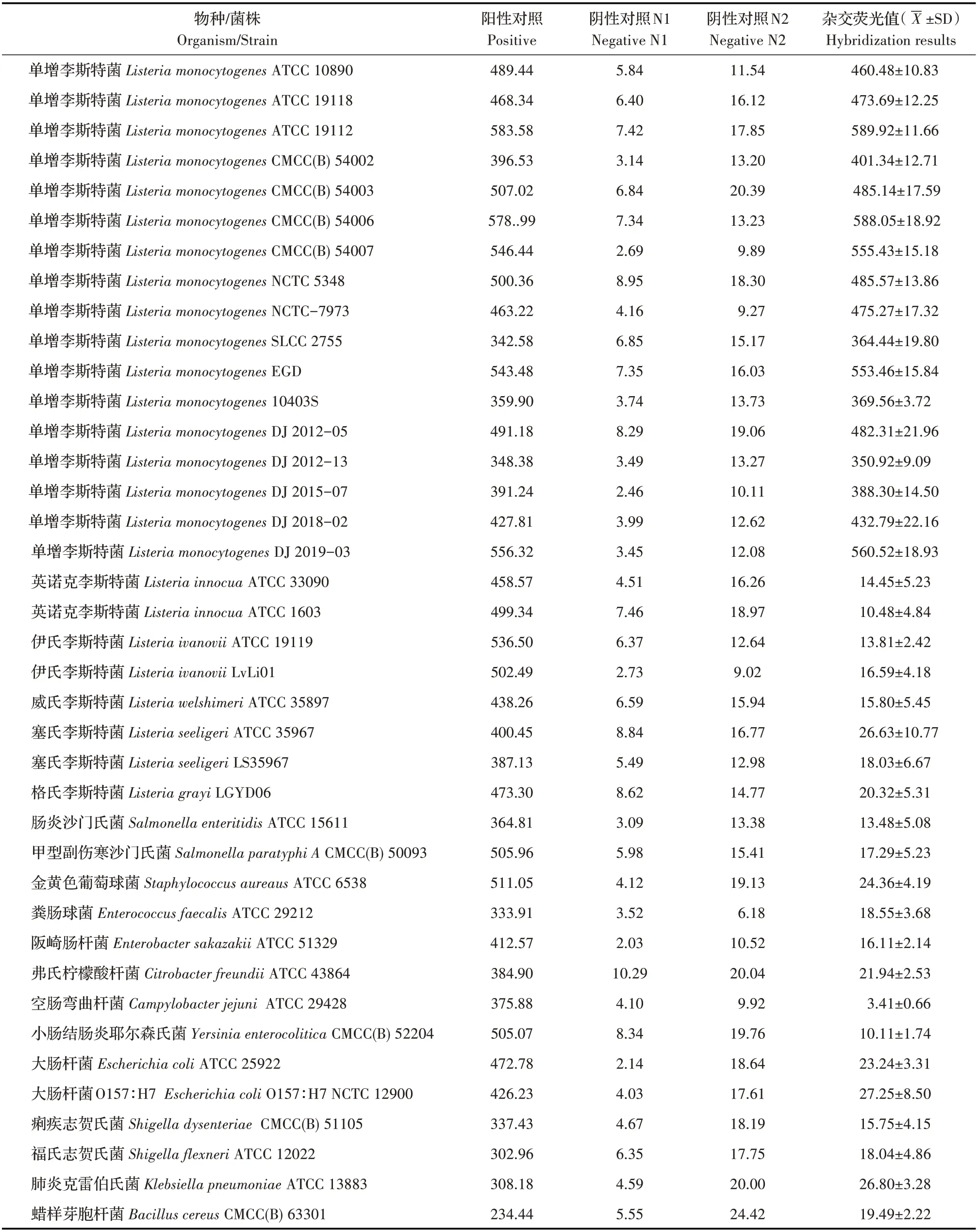
表2 液相PNA-FISH 方法的特异性试验结果Table 2 Specificity of liquid phase PNA-FISH method evaluated by bacterial species
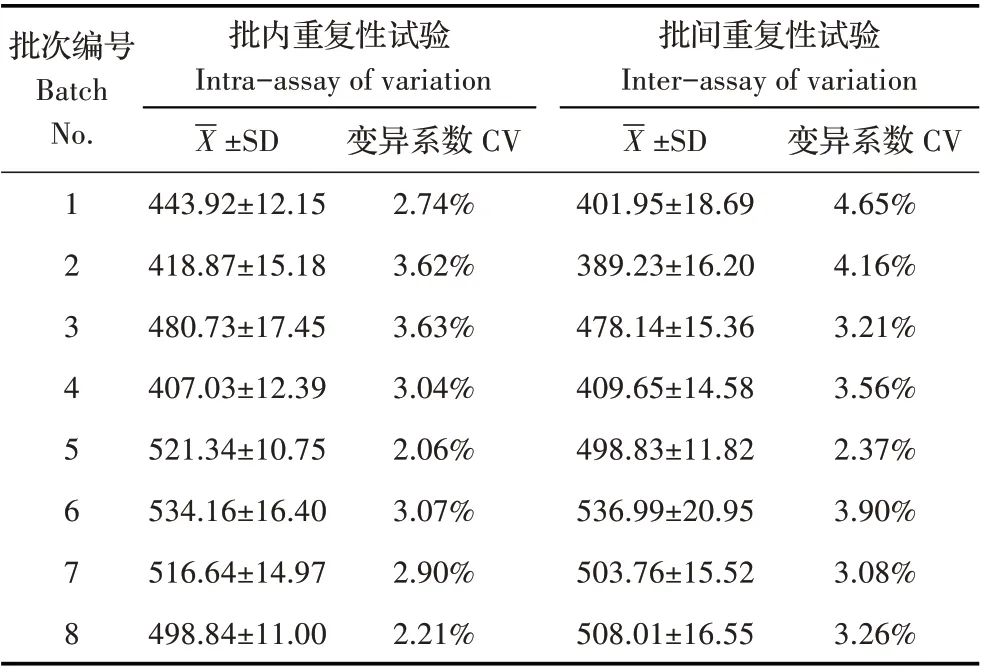
表3 重复性试验结果Table 3 Results of repeatability test
2.5 再现性试验结果选取4 个浓度的单增李斯特菌样品,更换实验室及操作人员后利用建立的液相PNA-FISH 方法检测,结果显示,单增李斯特菌原液样品荧光值为440.96±17.49(未更换人员时为455.58±16.15),稀释2 倍的样品荧光值为229.73±12.25(未更换人员时为234.53±12.30),稀释3 倍的样品荧光值为139.67±6.99(未更换人员时为153.88±7.27),稀释5 倍的样品荧光值为93.56±8.02(未更换人员时为99.06±7.57),检测结果较未经更换实验室及操作人员之前均有下降(图2),表明不同的操作人员会对检测结果造成一定影响,但该方法的检测结果一致,稳定性较好。

图2 再现性试验结果Fig. 2 Results of reproducibility test
2.6 家禽组织样品的检测结果利用本研究建立的液相PNA-FISH 方法与细菌生化鉴定法对28 份家禽组织样品检测,结果显示两种方法对相同的7 份家禽组织样品检测结果均为阳性,其余21 份家禽组织样品检测结果均为阴性,检测符合率达到100%,但是国标方法中的生化鉴定过程(动力试验、过氧化氢酶试验、糖发酵试验、MR-VP 试验、溶血试验等)通常需要3 d~5 d,而本研究中的方法仅需要2.5 h,大大缩短检测时间。因此本方法更有利于单增李斯特菌样品的快速检测。
3 讨 论
本研究中所用的特异性PNA 探针Lm-16S-2 在基于液相扫描的方法中具有较强的特异性,杂交数值与阳性对照探针无差异,同时实验发现在洗涤步骤中减少菌体的损失也可有效降低对同一单增李斯特菌样品检测的标准偏差(结果未显示)。近期SAN⁃TOS 等在对不同类型革兰氏菌的多因素杂交条件优化时发现,具有较厚的肽聚糖层的细菌在接近50%(v/v)的甲酰胺浓度下,可获得更高的荧光强度[12],这与本研究所使用的浓度差异较大,同时此项研究认为不同类型的革兰氏细菌的最优杂交体系各异,虽然在非最优杂交体系下不会改变液相PNA-FISH方法的杂交结果,但在节约实验成本、提高检测效率的基础上获得更高的荧光强度,将是液相PNAFISH 方法研究的方向。
在FISH 技术固定步骤中常使用固定剂(如多聚甲醛)稳定细胞形态,同时探针进入细胞的必要条件是细胞膜的渗透作用,多数革兰氏阳性菌和部分革兰氏阴性菌均需要使用渗透剂(如乙醇),对细胞膜组织结构造成物理损伤,使探针可以进入细胞内部,乙醇最佳浓度通常为70%~80%[13]。本研究在细菌固定步骤未使用多聚甲醛,规避其对实验人员造成的健康危害。本研究中细菌固定方式取得良好效果的主要原因可能在于液相方法的最终判定方式是对细菌累计的荧光量进行判断,可忽略细胞形态造成的影响。
本研究室在前期的液相PNA-FISH 研究中,同样设置N1 和N2 两组空白对照[5],与本研究方法特异性试验中N1、N2 数值结果相似,N2 值普遍高于N1值,可能是由于RNase 酶对靶序列的消化不彻底。但前期研究中是用测得的荧光值分别减去N1、N2两组空白值进行判定,由于检测仪器存在本底值,一定程度上造成了假阴性的干扰。本研究在充分洗涤过量探针的前提下降低了N2 的值,并直接使用测定所得荧光值与空白对照数值的显著性进行判定,具有明显差异的判定为阳性,因此针对该方法设定一个荧光值的检出范围,对于单增李斯特菌的检测具有重要意义。本研究建立的液相PNA-FISH方法为批量检测单增李斯特菌提供了一个快速、可行的新方案。

