猪附红细胞体eno 基因可视化LAMP 检测方法的建立与应用
金丽兰,付兢锋,马浩原,王静璇,李长春,薛书江,高 旭*
(1.延边大学农学院动物医学系,吉林 延吉 133000;2.敦化市农业综合行政执法大队,吉林 敦化 133700)
猪附红细胞体病(Porcine eperythrozoonosis,PE)是由猪附红细胞体(Mycoplasma suis,M. suis)寄生于猪红细胞表面,引起一种以溶血性贫血、黄疸和发热为主要临床症状的人畜共患传染病[1]。M. suis 宿主范围较广,除猪外,人、犬、猫、牛等动物均可感染,多呈隐性感染[2]。M. suis 寄生于宿主红细胞表面使其变形和衰亡,导致机体贫血和免疫力下降,易引起其它病原体继发感染,使病情加重和死亡率升高,严重制约了养猪业的健康发展[1-2]。截至目前,PE 无有效的治疗药物,一旦发病只能采取综合治疗方法延缓病程,幸存患病猪通常长期携带病原体,并持续向外排毒,这是该病预防与病原体净化的难题。因此,建立一种快捷、简便、特异和灵敏的早期检测诊断方法显得尤为重要。
目前,常用于PE 的检测方法有吉姆萨染色、ELISA、间接免疫荧光试验(IFA)、PCR 和荧光定量PCR 等方法,但吉姆萨染色法存在着检测结果不准确,ELISA 和IFA 不能用于早期诊断,以及PCR 和荧光定量PCR 需要昂贵专业仪器等缺点,而不能在基层推广应用,使PE 的早期临床诊断受到影响[3-4]。环介导等温扩增技术(Loop-mediated isother⁃mal amplification method,LAMP)与其它分子检测技术相比,不仅敏感性高,操作简便,而且不需要专业仪器,可用肉眼直接判读结果,养殖户可以自行操作检测,便于基层养殖户的实地推广应用。由于M. suis 的归属与定性较晚,以及全基因组刚被测通[5],至今仅见李月梅等[6]以M. suis 的16S rRNA 为目的基因建立了LAMP 检测方法,但由于所检测基因为16S rRNA,非病原体结构基因,使该方法存在一定局限。因此,本研究拟以M. suis 的结构基因α-烯醇化酶(eno)基因为目的基因,在保守区设计4 条特异性引物,通过对反应条件、反应程序的优化与筛选,建立一种快捷、简便、特异、敏感和易于推广的LAMP 方法,为PE 的早期诊断和病原体净化提供一种有效的检测手段。
1 材料与方法
1.1 主要实验材料弓形虫、大肠杆菌、猪链球菌I 型、牛源瑟氏泰勒虫和M. suis 及其阳性猪血液样品均由延边大学预防兽医学实验室保存。MgSO4(100 mmol/L)、EX Taq DNA 聚合酶、Bst DNA 聚合酶、10×ThemoPol Buffer、dNTP Mix(10 mmol/L)均购自NEB 公司;10 000×SYBR GreenⅠ染料购自北京索莱宝生物技术有限公司;E.Z.N.A.基因组提取试剂盒、E.Z.N.A. Bacterial DNA Kit、质粒提取试剂盒和胶回收试剂盒均购自Omega 公司;pMD18-T simple vector、DL2000 DNA Marker 购自宝生物工程(大连)有限公司。84 份临床疑似感染M. suis 的猪血液检测样品采自延边州5 家猪养殖场。
1.2 LAMP 引物设计根据GenBank 中登录的M.suis基因组(NC_015153),应用Oligo6.0 软件在eno 基因的保守区内设计1 对特异性引物,P1:GGATCCAT GGCTTTTAGTATAGAAAATC/P2:CTCGAGTTCTGATA GACATCCAGCTTTA,分别含有BamH I 和Xho I 酶切位点,预期克隆目的片段大小为864 bp;应用prim⁃er explorer V5 软件,在上述eno 基因保守区内设计4条特异引物,外引物为F3 和B3,即F3:GGGAA AATTCCTAAGTAAGAAGA/B3:AGAACTTGACAGATT CTTAATGG;内引物为FIP 和BIP,即FIP:CAGCT AAGGTATTAGTTCCCTC/BIP:GGAGTTAAGAAAGCTG TTCACTACA。引物由英潍捷基贸易有限公司合成。
1.3eno的扩增与TA 克隆采用E.Z.N.A.基因组提取试剂盒提取本实验室保存的M. suis 基因组DNA 为模板,以P1/P2 为引物,进行eno 基因扩增,退火温度为55 ℃,PCR 产物经1%琼脂糖电泳检测后回收目的基因,进一步进行TA 克隆、酶切和测序,将酶切与测序正确的质粒命名为pMD-eno。
1.4 LAMP 的反应条件优化与可视化检测以测序正确的质粒pMD-eno 为模板,LAMP 检测方法的基础,反应体系为:总体积为25 μL,质粒F3/B3各取0.5 μL,FIP/BIP 各取4 μL,dNTPs(1.4 mmol/L)取3.5 μL,Mg2+1.5 μL(100 mmol/L),BstDNA Poly⁃merase 1 μL(320 U/mL),10×ThermoPol Buffer 2.5 μL,模板2 μL,用ddH2O 补至25 μL。反应条件:63 ℃,50 min,结束后80 ℃,2 min 终止反应后进行电泳观察。
基于以上LAMP 反应体系,利用方阵法进行退火温度(57 ℃、59 ℃、61 ℃、63 ℃和65 ℃)、反应时间(30 min、40 min、50 min和60 min)、内外引物浓度比(1∶2、1∶4、1∶6、1∶8 和1∶10)和镁离子浓度(1 mmol/L、2mmol/L、4 mmol/L、6 mmol/L、8 mmol/L、10 mmol/L)的筛选,确定最优的反应条件。同时,以最优条件进行试验,在反应结束后加入SYBR Green I 染料,观察反应体系是否发生有效颜色变化。
1.5 特异性试验利用E.Z.N.A.基因组提取试剂盒和E.Z.N.A. Bacteral DNA Kit 分别提取弓形虫、大肠杆菌、猪链球菌I 型、牛源瑟氏泰勒虫和M.suis 的基因组作为模板,利用上述建立的LAMP 方法检测,进行特异性试验,同时设立ddH2O 空白对照。
1.6 敏感性试验将重组质粒pMO-eno 进行10 倍倍比稀释(100~107倍)后作为模板,即8 个梯度浓度(3×107拷贝/μL~3 拷贝/μL),同时设立空白对照,按照建立的LAMP 检测方法进行敏感性试验。同时用1.3 中PCR 方法检测,对两种方法检测结果进行对比分析。
1.7 重复性试验取同一时间提取M.suis基因组进行10 倍倍比稀释(10-1~10-6)后,应用本研究已建立的LAMP 试验方法检测,进行组内重复试验;取6个不同时间提取的M.suis基因组进行10 倍倍比稀释后,应用本研究已建立的LAMP 试验方法检测,进行组间重复试验。均设立ddH2O 阴性对照组。
1.8 临床应用试验应用本研究建立的LAMP 方法和1.3 中PCR 方法,对延边州84 份疑似感染M.suis的猪血液检测样品进行检测,同时设2 份镜检和PCR 检测M.suis 阳性样品做阳性对照,对实验结果进行分析。
2 结 果
2.1 LAMP 方法的建立以重组质粒pMO-eno 为模板,利用方阵法优化LAMP 检测方法,结果显示,当反应60 min,反应温度为63 ℃时,梯状条带最清晰(图1A)。以63 ℃为最优反应温度进行LAMP 试验反应,结果显示在设立的时间梯度中50 min 为最优反应时间(图1B)。以63 ℃为反应温度,50 min 为反应时间,进行LAMP 试验,结果显示在设立的镁离子浓度6 个梯度中,6 mmol/L 为最佳反应浓度(图1C)。以M.suis基因组DNA 为目的基因,将外引物F3/B3 均设为0.2 μmol/L,设立外引物与内引物浓度比梯度,进行LAMP 试验。结果显示,当外内引物浓度比为1∶6 时(图1D),反应梯度条带最清楚,即为最佳引物浓度比。
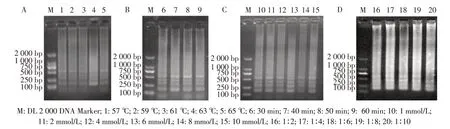
图1 LAMP 反应温度(A)、反应时间(B)、Mg2+浓度(C)和引物浓度比(D)筛选结果Fig. 1 LAMP test results under different temperature(A), time(B), Mg2+ concentration(C), primer concentration ratio(D) screening
2.2 LAMP 可视化检测在应用建立的LAMP 试验反应后,向试管里加入SYBR Green I 染料,在紫外灯下可见到阳性组呈现绿色荧光,而阴性组呈现橙色(图2),表明本研究建立的LAMP 方法可以用肉眼直观判读结果。
2.3 特异性试验分别以双蒸水,以及弓形虫、大肠杆菌、猪链球菌I 型、牛源瑟氏泰勒虫和M. suis的基因组为模板,进行LAMP 检测。结果显示,仅M.suis出现荧光,ddH2O 空白对照和其它4 个病原体组均无荧光(图3),即为阴性反应,表明本研究建立的LAMP 检测方法具备良好的特异性。
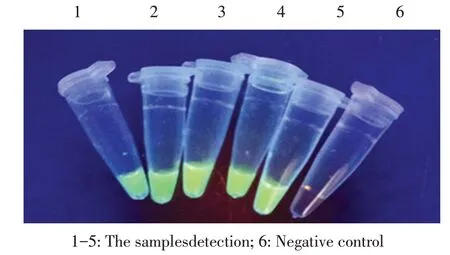
图2 LAMP 可视化结果Fig. 2 Visualization results of LAMP
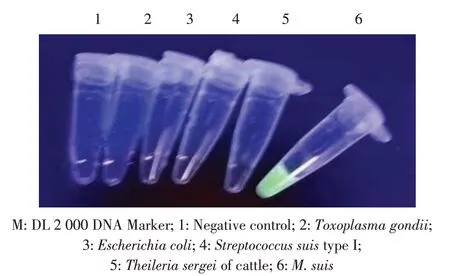
图3 LAMP 特异性试验结果Fig. 3 Results of LAMP specificity test
2.4 敏感性试验将提取的重组质粒pMO-eno 按照10 倍倍比稀释成8 个梯度(100~107),按照本试验建立的LAMP 检测方法进行试验。结果显示,其最低检测稀释倍数可达到106倍(30 拷贝/μL)(图4),而普通PCR 检测方法仅能检测到104倍。以上结果表明,本研究建立的LAMP 检测方法具有较好的敏感性,比普通PCR 检测方法敏感度高100 倍。

图4 LAMP 敏感性试验结果Fig. 4 Results of LAMP sensitivity test
2.5 重复性试验应用已建立的LAMP 试验方法,进行组内与组间重复试验。结果显示,各反应管均呈现绿色荧光,均为阳性。表明本研究建立的LAMP 检测方法具有良好的重复性。
2.6 临床应用结果对84 份疑似感染M. suis 猪血液样品、2份M.suis阳性猪血液样品进行LAMP和PCR检测。结果显示,2 份阳性样品LAMP 检测为阳性,而84份猪血液样品中,LAMP 检测出34份为阳性,阳性率为40%,其与平行PCR 检测结果相符。表明本研究建立的LAMP检测方法能够进行临床应用。
3 讨 论
2007 年,陈金山等在对河南省的几个猪场进行了流行病学调查,发现其发病率为46.33%,死亡率达13.88%[7]。该病死亡率不高,但由于引起继发感染,使感染猪死亡率升高,对仔猪的危害更为惨重。近期研究发现,Julia 等在德国南部的21 个农场进行PE 调查发现,M. suis 可以垂直传播,初乳摄入前仔猪经垂直传播的感染率达14.35%[8]。这些发现进一步验证了PE 流行的严重现状,以及切断垂直传播的重要性。而且由于PE 是人兽共患传染病,通过血吸虫媒介传播,对人类健康也造成了极为严重的安全隐患,这使预防PE 传播与蔓延,切断和净化M. suis 成为目前研究的热点和难点。
防控PE 的发生与传播,早期发现和确诊是关键。2010 年本研究组成员李月梅等以M. suis 的16S rRNA 为目的基因建立了LAMP 检测方法,由于该方法选用16S rRNA 为目的基因,在提取与扩增过程中受到其它相似病原体的影响较大,导致所建立的LAMP 方法存在一定局限性[6]。因此,以M. suis 的结构基因为目的基因,建立用于M. suis 诊断的LAMP检测方法已是当务之急。然而,一直以来关于M. suis 的研究较少,对于附红细胞体的分类一直存在争议,以至于一定时间内对附红细胞体是否真正存在仍质疑,直至2011 年M. suis 的基因组被测通,最终证实了附红细胞存在,并将其划归为支原体[9],随后相关结构基因和结构蛋白被测通与证实,其中α-烯醇化酶基因(eno 基因)编码的α-烯醇化酶,是M. suis 粘附宿主细胞的主要功能蛋白,在M. suis 入侵宿主和粘附细胞过程中起重要作用,并具有很好的免疫原性[10],常用作血清学诊断的目的蛋白,而eno 基因由于其相对保守,常用作分子诊断的目的基因[9,11-13]。截止目前,未见有关于以M.suis 的结构基因建立的LAMP 检测方法的报导,本研究建立的M. suis 可视化LAMP 检测方法,由于其以M. suis 的结构基因作为检测基因,使检测结果更为准确可信。经一系列试验验证,本研究建立的LAMP 方法具有特异、便捷、操作简单、不需要专业仪器和专业技术等特点,可用于基层养殖户自己操作,便于随时采样、随时诊断和随时治疗与防控。与常规PCR 方法相比,其所需时间缩短,特异性强,成本低廉,操作简单,通过水浴锅加热即可实现核酸的扩增,不需要电泳,仅通过加入SYBR Green I染料即可通过紫外灯用肉眼判断结果。其敏感度是普通PCR 的100 倍,检测下限达30 拷贝/μL,与高旭等建立的M. suis TaqMan 荧光定量PCR 检测方法敏感性一致[2]。经对84 份疑似感染M. suis 猪血液样品、2份M.suis阳性样品进行LAMP 和PCR 检测,证明本研究建立的LAMP 可用于临床或实地检测,可及时调查猪场中M. suis 感染情况,可以在感染的早期阶段识别出携带病毒的仔猪,以便淘汰感染母猪,为控制疫情和净化M. suis 将起到积极作用。
本研究建立的LAMP 方法是一种新型、廉价、灵敏、特异且快速的M.suis 检测手段,临床应用与常规PCR 检测结果相一致,LAMP 不需要严格的反应条件、复杂的技术操作和专用设备,为养殖场M.suis 净化提供了快速、便捷的分子诊断方法。
——一道江苏高考题的奥秘解读和拓展

